Alkoholi
- opisati fizikalna i kemijska svojstva, upotrebu i dobivanje metanola i etanola
- objasniti proces alkoholnog vrenja
- pokusom dokazati alkohol u uzorku
- analizirati posljedice prekomjernog uzimanja alkohola.
Uvod
Sorbitol je čest nadomjestak za šećer u hrani. Nalazi se u namirnicama s oznakom “bez šećera” i nosi oznaku E 420. Takve proizvode najčešće biramo kada želimo kontrolirati količinu šećera koji unosimo hranom.
Količina energije koju dobivamo od sorbitola dvostruko je manja od energije koju dobijemo od iste količine šećera. Uz to, sorbitol čuva zdravlje usne šupljine jer se bakterije ne mogu njime hraniti.
Bezalkoholna pića, žvakaće gume, tvrdi bomboni, čokolade, sirup protiv kašlja i sladoled samo su neki od proizvoda koji sadrže sorbitol. Ipak treba pripaziti jer veće količine sorbitola u organizmu mogu izazvati smetnje u probavnom sustavu.
Osim sorbitola, za iste potrebe koriste se još maltitol i ksilitol.
U suradnji s prijateljima pronađite više informacija o tim spojevima na stručnim mrežnim stranicama i o svojim saznanjima izvijestite druge učenike u razredu.
Organski spojevi s kisikom
Osim ugljika i vodika, kisik je najčešći kemijski element u organskim spojevima.
Vrstu i svojstva organskog spoja određuje:
- broj atoma ugljika, vodika i kisika
- način njihova međusobnog spajanja.
Neki od organskih spojeva s kisikom jesu: alkoholi, eteri, aldehidi, ketoni, karboksilne kiseline, esteri i šećeri.
Funkcijska skupina atoma
Funkcijska skupina atoma posebna je skupina atoma koju sadrže svi organski spojevi osim ugljikovodika.
Ta skupina atoma određuje vrstu spoja i njegova svojstva.
Funkcijska skupina koju sadrže alkoholi prva je i najslabija u skupini organskih spojeva s kisikom.
Ona se sastoji od jednog atoma kisika i jednog atoma vodika.
Naziva se hidroksilna skupina, .
Alkoholi se među sobom razlikuju prema broju vezanih hidroksilnih skupina.
Molekula alkohola može imati jednu ili više hidroksilnih skupina vezanih na atome ugljika u molekuli.
Strukturne osobine i imenovanje alkohola
Prisjetite se!
Ugljikovodici kod kojih postoje samo jednostruke veze jesu zasićeni ugljikovodici ili alkani.
Alkani su metan, etan, propan, butan, pentan, heksan itd.
Ime zasićenog alkohola s jednom funkcijskom skupinom na početnom ugljikovu atomu tvorimo tako da imenu odgovarajućeg ugljikovodika iz homolognog niza alkana dodamo nastavak .
Primjeri: metan – metanol, etan – etanol itd.
Opća formula za alkohole jest , pri čemu oznaka R predstavlja ostatak alkana od kojega je alkohol izveden.
Organski spojevi s kisikom
Osim ugljika i vodika, kisik je najčešći kemijski element u organskim spojevima. Atomi ugljika i kisika mogu se međusobno spajati jednostrukom i dvostrukom vezom. Broj atoma ugljika, kisika i vodika, kao i način njihova međusobnog spajanja, određuje vrstu i svojstva organskog spoja. Neki od organskih spojevi s kisikom jesu: alkoholi, eteri, aldehidi, ketoni, karboksilne kiseline, esteri i šećeri.
Funkcijska skupina
Osim ugljikovodika, svi preostali organski spojevi sadrže neku od karakterističnih skupina atoma. Takva skupina atoma naziva se funkcijska skupina i ona određuje svojstva organskog spoja. U kemijskim reakcijama s drugim tvarima funkcijska skupina organskog spoja dio je molekule koji se najprije mijenja.
U skupini organskih spojeva s kisikom prvo ćemo se upoznati s funkcijskom skupinom koja karakterizira alkohole. Ona se sastoji od jednog atoma kisika i jednog atoma vodika i naziva se hidroksilna skupina (). Alkoholi se među sobom razlikuju prema broju vezanih hidroksilnih skupina, ali i prema mjestu vezivanja hidroksilne skupine u molekuli. Molekula alkohola može imati jednu ili više hidroksilnih skupina vezanih na atome ugljika u molekuli.
Struktura molekula alkohola i imenovanje alkohola
Ime alkohola s jednom funkcijskom skupinom na početnom ugljikovu atomu tvorimo tako da imenu odgovarajućeg ugljikovodika iz homolognog niza alkana dodamo nastavak -ol. Opća formula za alkohole jest , pri čemu oznaka R predstavlja ugljikovodični dio molekule.
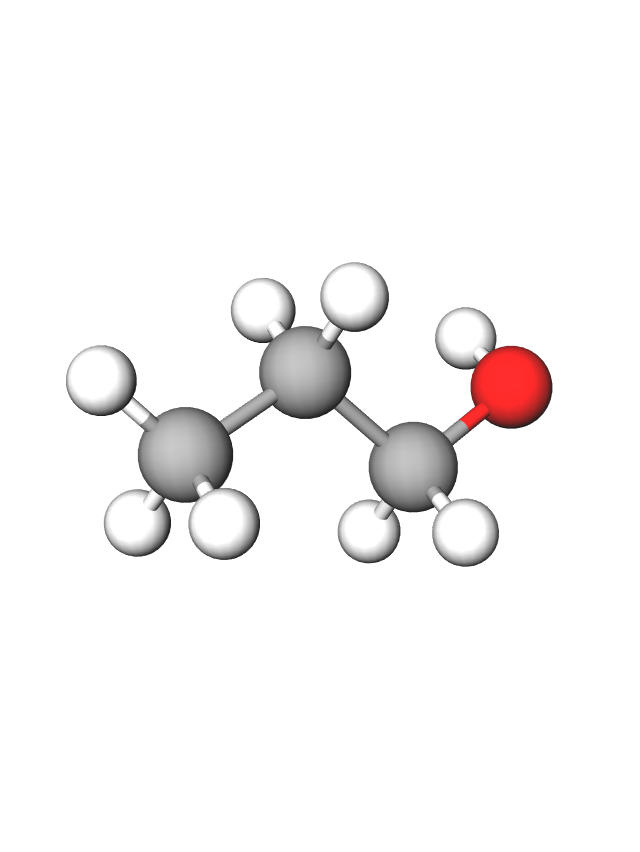
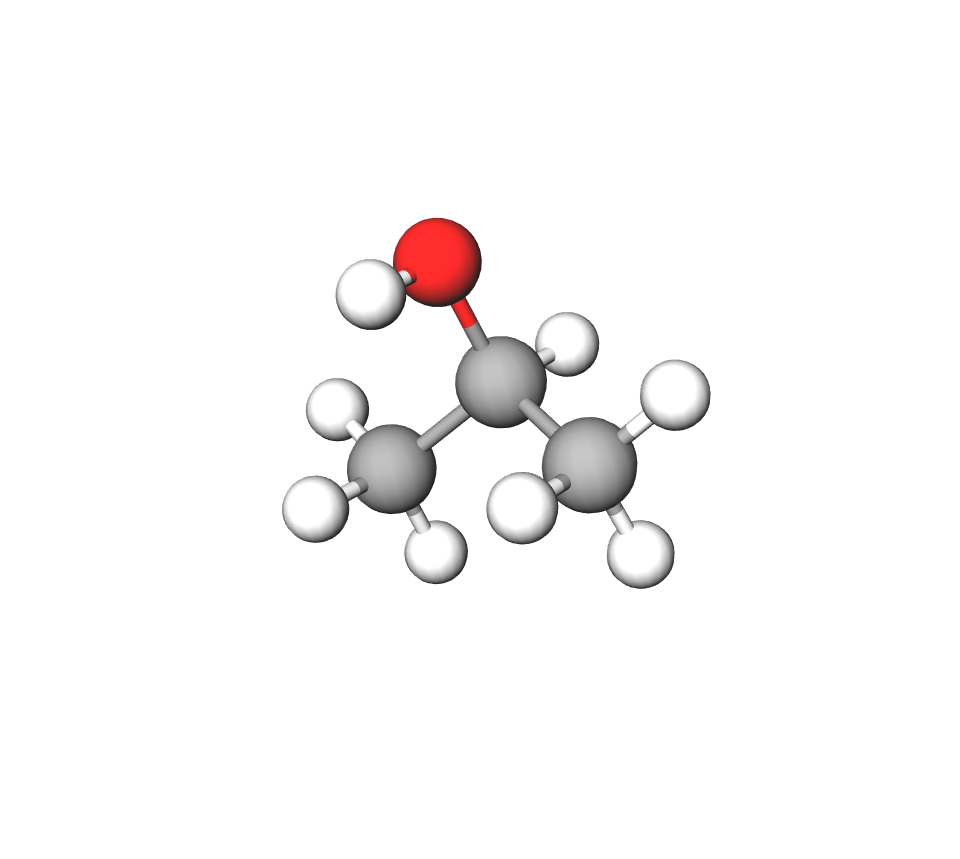
Ako hidroksilna skupina nije na prvom ugljiku u molekuli, u ime spoja stavlja se redni broj onog atoma ugljika na kojemu se skupina nalazi. Primjerice, strukturni su izomeri propanola: propan-1-ol i propan-2-ol (trivijalno ime izopropanol).
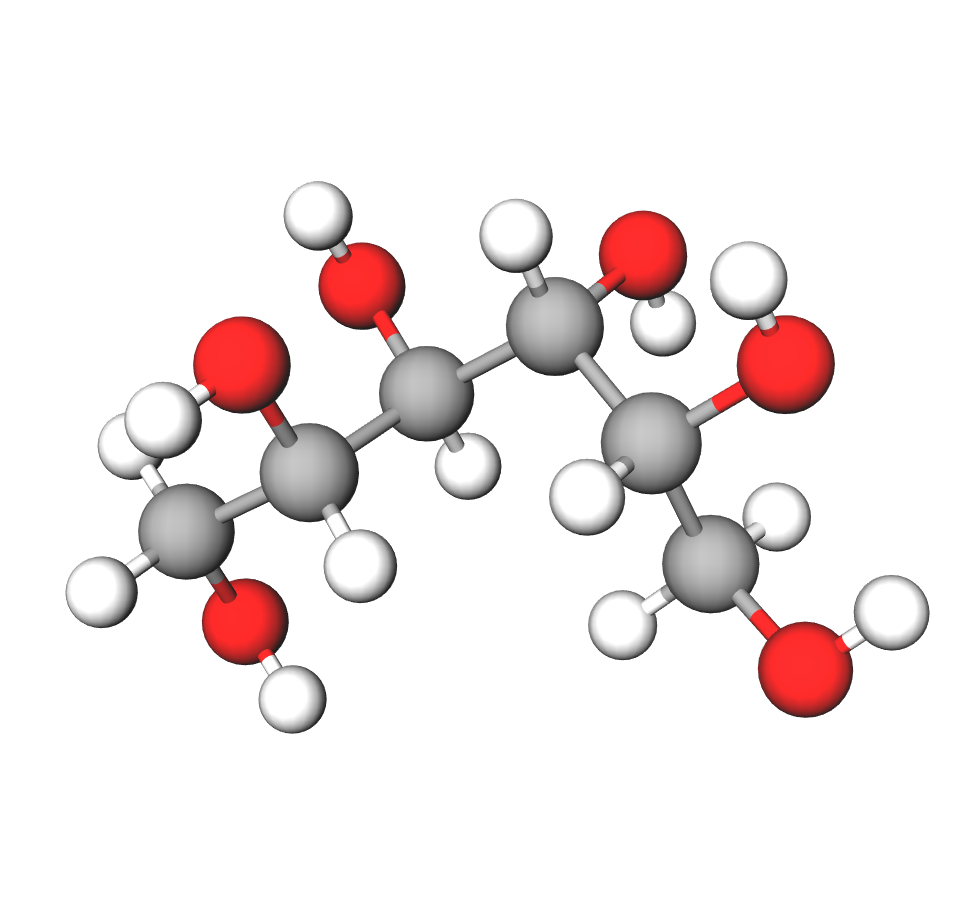
Ako molekula ima više hidroksilnih skupina, dva važna podatka ulaze u ime alkohola. Prvo za svaku skupinu treba navesti njezin položaj koji se označava brojem atoma ugljika na kojemu se skupina nalazi. Drugo, broj hidroksilnih skupina navodi se odgovarajućim slogovima iz grčkog jezika (di-, tri- itd.) kao predmetak nastavku -ol. Tako npr. -diol ima dvije, a -triol ima tri hidroksilne skupine.
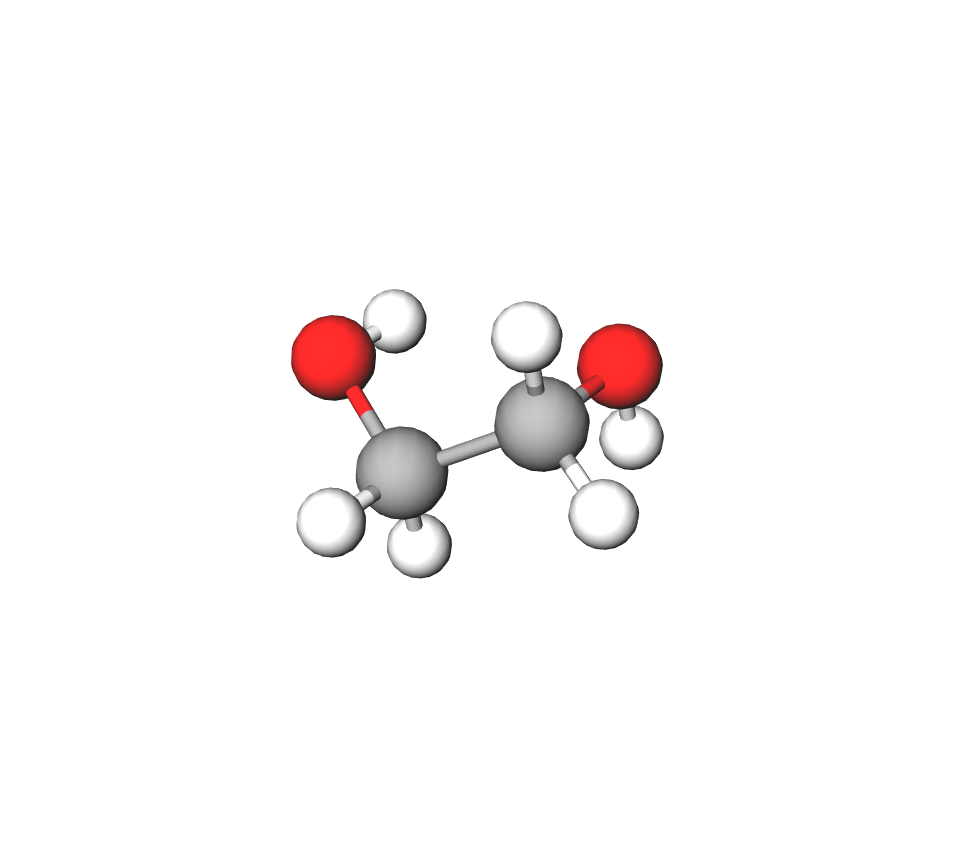
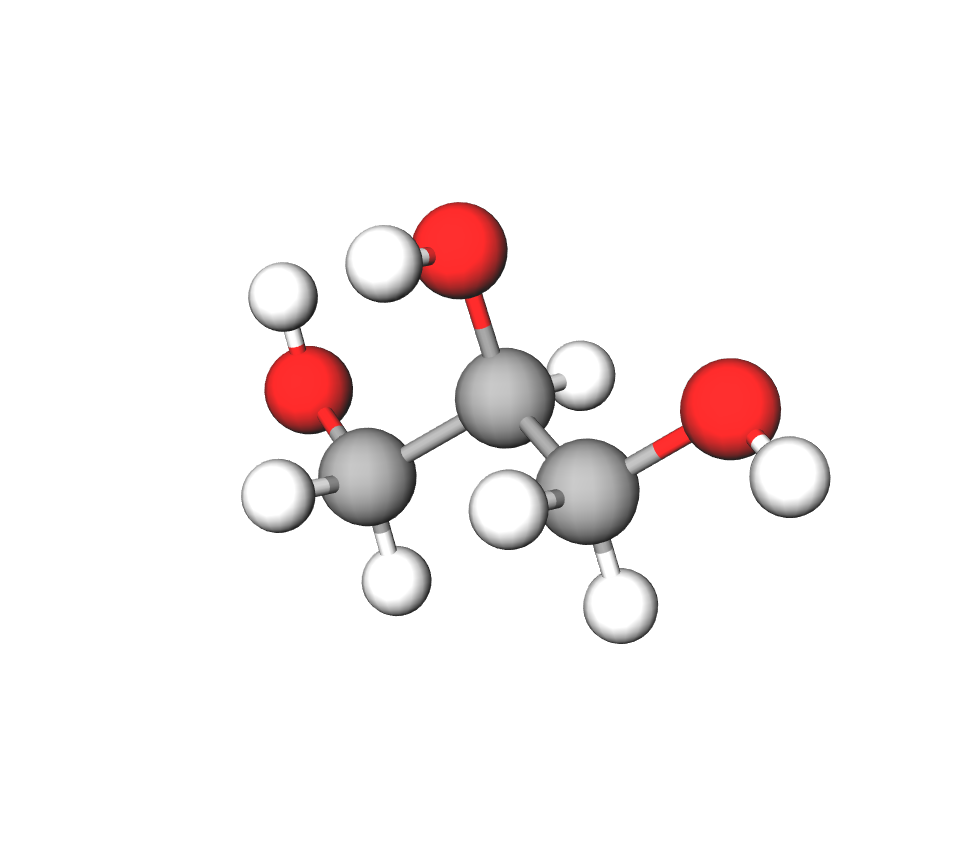
Etan-1,2-diol (glikol ili trivijalnim imenom etilenglikol) ima dvije hidroksilne skupine pa je zato -diol (po jednu na svakom ugljikovu atomu, tj. na prvom atomu ugljika i drugom atomu ugljika). Glikol je otrovna tvar koja se koristi za izradu antifriza u sustavima za hlađenje automobilskih motora.
Propan-1,2,3-triol ili glicerol (trivijalnim imenom glicerin) ima tri hidroksilne skupine (po jednu hidroksilnu skupinu vezanu na prvom, drugom i trećem atomu ugljika). To je bezbojna i gusta tekućina, slatkasta okusa. Koristi se u proizvodnji medicinskih i kozmetičkih proizvoda za kožu.
Organski spoj može imati više različitih funkcijskih skupina. Uz alkoholnu funkcijsku skupinu može biti još neka druga.
Fizikalna svojstva, dobivanje i upotreba metanola i etanola
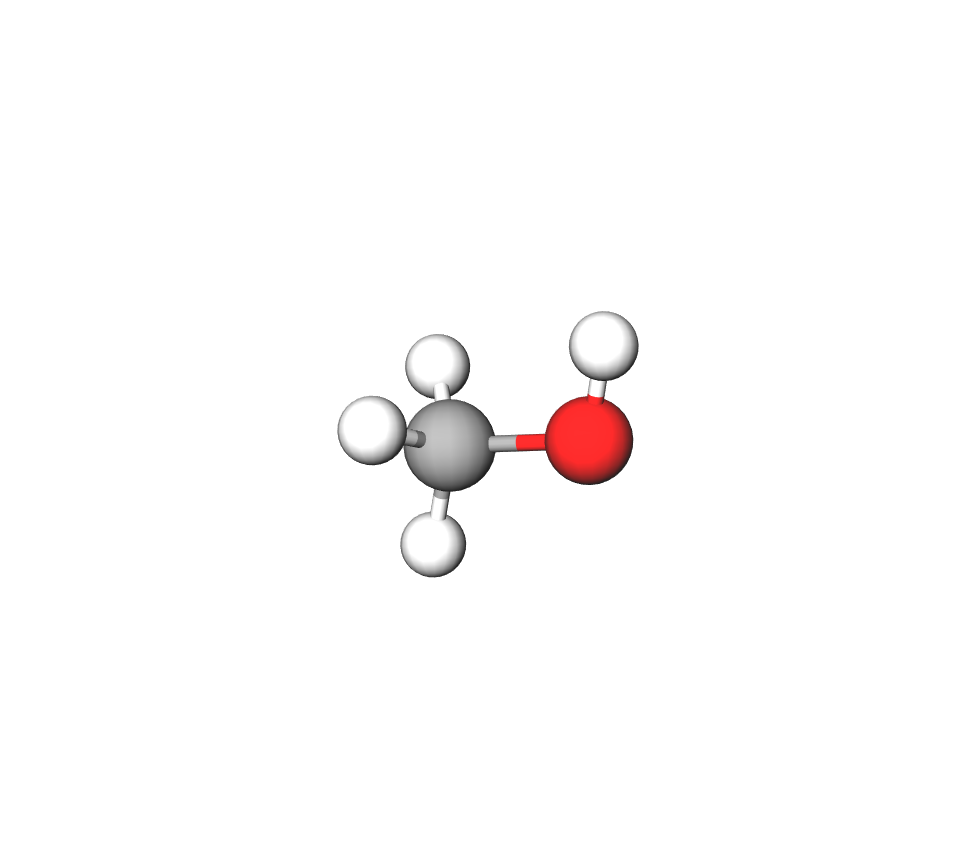
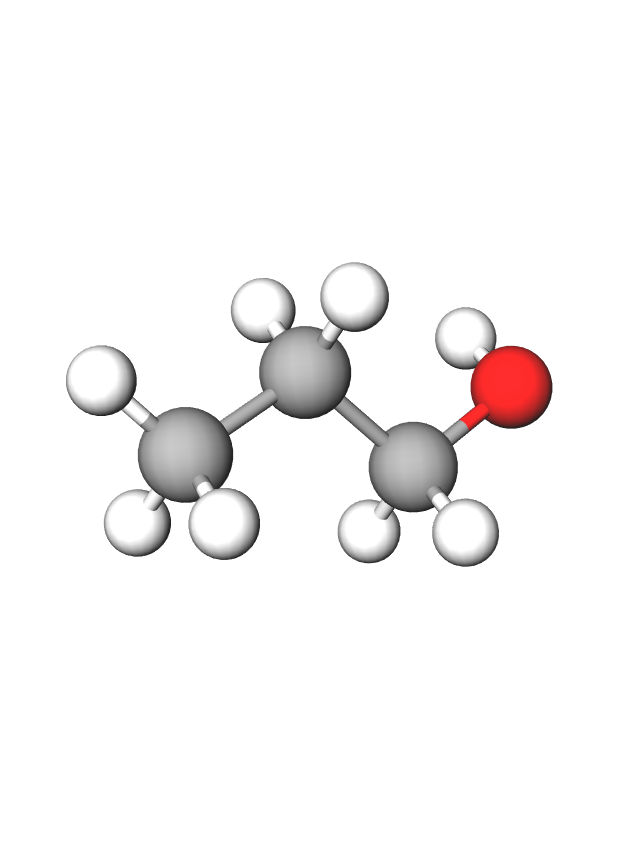
Metanol,
Metanol, (), najjednostavniji je alkohol.
Organski spoj može imati više različitih
Fizikalna svojstva, dobivanje i upotreba metanola i etanola
Metanol,
Metanol je najjednostavniji alkohol. To je bezbojna i prozirna tekućina pri sobnoj temperaturi. Miješa se s vodom u svakom omjeru, lako hlapi, a pare su mu zapaljive.
Svojstva metanola:
- bezbojna i prozirna tekućina pri sobnoj temperaturi
- lako hlapi
- gori plavim plamenom
- pare su zapaljive
- otrovan je za ljude – izaziva vrtoglavicu, povraćanje, smetnje vida, sljepoću, smrt
- koristi se u proizvodnji plastičnih masa.
Metanol je otrovan. Već male količine izazivaju vrtoglavicu, povraćanje, smetnje u vidu i sljepoću, a pijanstvo uzrokovano metilnim alkoholom dovodi do smrti.
Poznati su slučajevi gdje su već 4 cm3 izazvala sljepoću, a 6 cm3 smrt zbog paralize centra za disanje. Do trovanja metilnim alkoholom može doći ispijanjem, inhalacijom, pa čak i resorpcijom kroz kožu. Praktičnu opasnost predstavlja žestica iz koje nije uklonjena početna frakcija pri destiliranju (pečenje rakije!) u kućnoj radinosti. Naime, vrelište metanola je na 64,5 °C, a etanola na 78,3 °C, pa se bacanjem prve frakcije destilacije može izbjeći otrovni metanol u konzumnom piću.
Metanol se koristi kao otapalo i reagens u proizvodnji plastičnih masa. Industrijski se proizvodi sintezom iz ugljikova(II) oksida i vodika, uz katalizator i posebne uvjete tlaka i temperature.
Na stručnim mrežnim stranicama pročitajte više o industrijskom dobivanju metanola.
Napišite jednadžbu kemijske reakcije sinteze u kojoj se iz ugljikova(II) oksida i vodika dobiva metanol.
Istražite u kojim se uvjetima odvija ta sinteza. Uvjete napišite na reakcijsku strelicu.
Odgovor:
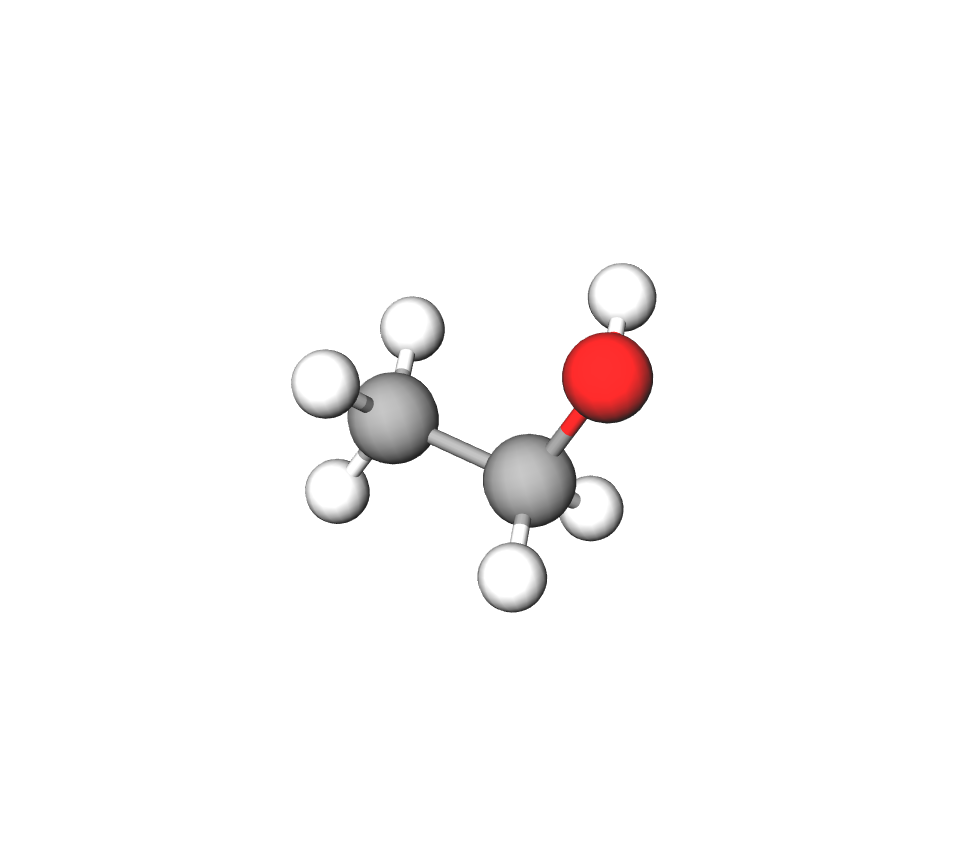
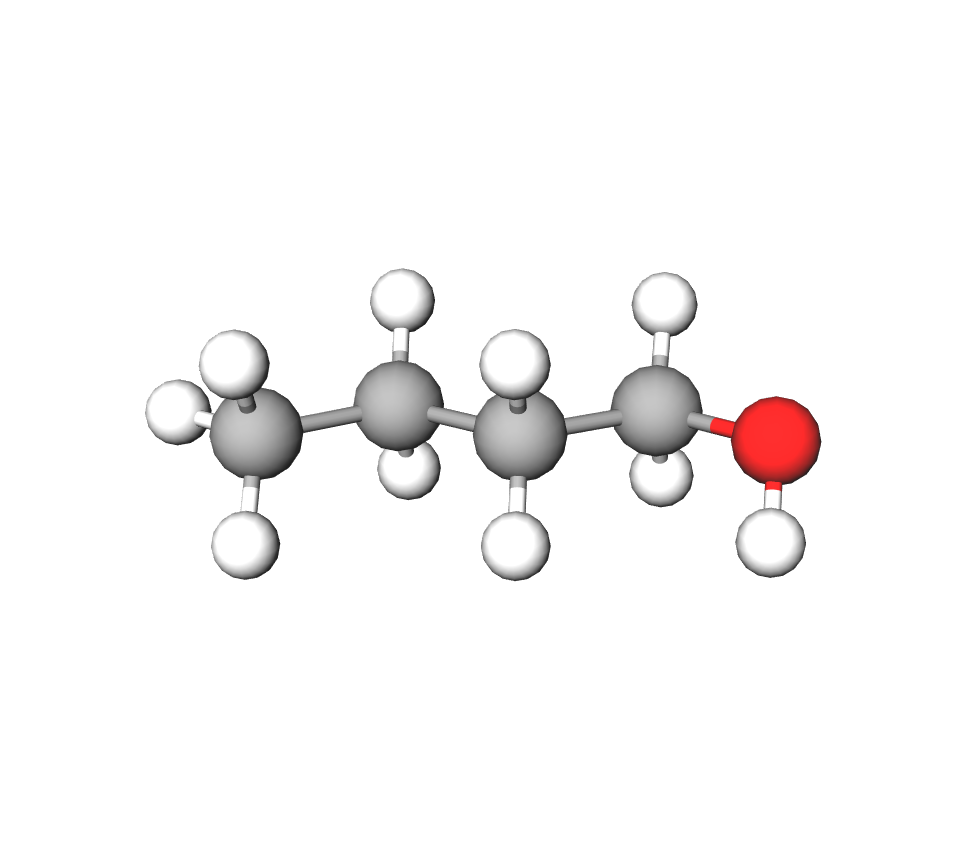
Etanol,
Etanol () ima fizikalna svojstva slična metanolu:
- bezbojna i prozirna tekućina pri sobnoj temperaturi
- lako hlapi
- gori žutim plamenom
- pare su mu zapaljive.
Etanol,
Etanol ima slična fizikalna svojstva kao i metanol i na pogled se ne mogu razlikovati. Oba su alkohola bezbojne tekućine, topljive u vodi u svakom omjeru, hlape, a pare su im zapaljive. Pri gorenju alkohola može se primijetiti različita boja plamena – metanol gori plavim plamenom, a etanol žutim.
Etanol se koristi u medicini kao sredstvo za dezinfekciju i sterilizaciju. Nalazi se u termometrima umjesto žive.
Etanol se također koristi u sintezi organskih spojeva i kao otapalo, ali i u medicini kao sredstvo za dezinfekciju i sterilizaciju. Obojeni etanol nalazi se u termometrima umjesto žive.
Etanol se može proizvesti u industrijskom procesu, ali i prirodnim procesom alkoholnog vrenja.
Etanol je također otrov, pa neumjerena konzumacija alkoholnih pića može dovesti do bolesnih stanja, čak i do smrti ako čovjek u kratkom roku popije 500 mL etanola.
Alkoholno vrenje
Alkoholno vrenje ili fermentacija prirodni je proces u kojemu od šećera nastaju etanol i ugljikov dioksid.
Taj se proces odvija uz prisutnost enzima iz kvaščevih gljivica.
šećer glukoza → alkohol etanol + ugljikov dioksid
Etanol se industrijski proizvodi reakcijom adicije vode na eten. Reakcija se odvija uz prisutnost katalizatora i posebnih uvjeta tlaka i temperature.
Osim tim industrijskim procesom, etanol nastaje i prirodnim procesom alkoholnog vrenja slatkog voća. Etanol se destiliranjem može ekstrahirati, pa se u nekom omjeru s vodom nalazi na tržištu kao konzumno alkoholno piće. Samo neka alkoholna pića sadrže više
od 45 % alkohola. Etanol je također otrov, pa neumjerena konzumacija alkoholnih pića može dovesti do bolesnih stanja, čak i do smrti ako čovjek u kratkom roku popije 500 mL 98-postotnog etanola.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Proučite grafikon i odgovorite na sljedeća pitanja.
Zaključite kako se mijenja vrelište svih alkohola s porastom relativne molekulske mase.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Alkoholno vrenje
Prirodni proces u kojemu od šećera nastaje etanol i ugljikov dioksid naziva se alkoholno vrenje ili fermentacija. Taj se proces odvija uz prisutnost enzima iz kvaščevih gljivica.
Kako od šećera dobivamo alkohol?
Ukratko, zrelom grožđu uklanja se peteljka, a bobe grožđa gnječe.
Dobiveni sok stavlja se u bačve u kojima ubrzo započinje proces vrenja.
Više informacija o kvascima možete pronaći u jedinici 4.3 Gljive i lišajevi – znati, razumjeti i primijeniti u DOS-u Biologija 2.
Kako od šećera dobivamo alkohol?
Ukratko, zrelom se grožđu uklanja peteljka, a bobe grožđa gnječe. Dobiveni sok stavlja se u bačve u kojima ubrzo započinje proces vrenja.
Bačva ne smije biti začepljena jer se stvara plin ugljikov dioksid.
Taj je plin važan za zaštitu mošta od procesa kiseljenja, ali ga se treba čuvati jer je opasan za zdravlje, pa treba izbjegavati boravak u zatvorenim prostorijama gdje se događa alkoholno vrenje.
Nakon završetka vrenja mošt postaje vino.
Vinogradarstvo i vinarstvo važne su gospodarske grane. U mnogim zemljama te vještine imaju dugu tradiciju, pomno ih se istražuje i unapređuje.
Tijekom vrenja slatki sok grožđa postaje mošt. Bačva ne smije biti začepljena jer se stvara plin ugljikov dioksid. Taj je plin važan u zaštiti mošta od procesa kiseljenja, ali ga se treba čuvati jer je opasan za zdravlje ako ga u okolišu ima više od 0,035 %. Opasnost boravka u atmosferi s povećanom količinom ugljikova(IV) oksida detaljno je obrađena u drugom modulu u jedinici Anorganski spojevi ugljika. Nakon završetka vrenja mošt postaje vino. Iz bačve u kojoj je nastalo, vino se prelijeva u druge bačve i tako se odvaja od taloga.
Vinogradarstvo i vinarstvo važne su gospodarske grane. U mnogim zemljama te vještine imaju dugu tradiciju, pomno ih se istražuje i unapređuje.
Proces alkoholnog vrenja poznat je odavno. U prošlosti se smatralo da alkohol ima ljekovita svojstva i da produljuje život. Nazivali su ga vodom života (“aqua vitae”).
Daljnjom destilacijom vina nastaje konjak i njemu slična pića, a destilacijom fermentirane mase gnječenoga grožđa ili slatkog voća dobivaju se različite vrste žestica.
Proces
Posljedice prekomjernog uzimanja alkohola
Etanol se nalazi u sastavu alkoholnih pića u različitim količinama.
Volumni udio etanola u vinu i pivu može biti do 16%, dok je u žestokim pićima i preko 40%.
Već i manje količine etanola umanjuju radnu sposobnost, izazivaju vrtoglavicu i utječu na ravnotežu tijela.
Veće količine etanola, uz već opisane simptome, mogu izazvati povraćanje, gubitak svijesti, komu i smrt.
Često pijenje alkoholnih pića izaziva ovisnost.
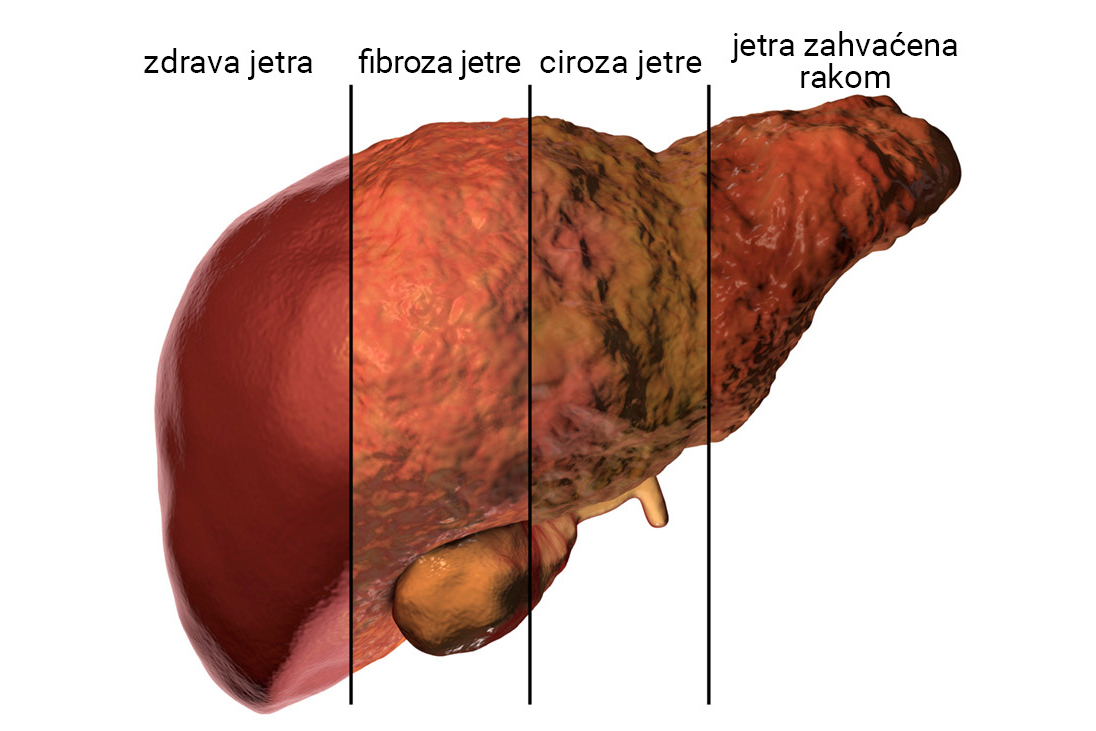
Etanol dugoročno štetno djeluje na cijeli organizam, a najviše posljedica ostavlja na mozgu i jetrima.
Posljedice prekomjernog uzimanja alkohola
Etanol se nalazi u sastavu alkoholnih pića u raznim količinama. Volumni udio etanola u vinu i pivu može biti do 16 %, dok je u žestokim pićima i preko 40 %.
Manje količine etanola utječu na raspoloženje, umanjuju psihomotoričke funkcije i radne sposobnosti, izazivaju vrtoglavicu i utječu na ravnotežu tijela. Etanol je također otrov, pa veće količine etanola, uz već opisane simptome, mogu izazvati povraćanje, gubitak svijesti, komu, čak i smrt ako čovjek u kratkom roku popije 500 mL 98-postotnog etanola.
Učestalo konzumiranje alkoholnih pića izaziva ovisnost. Etanol dugoročno štetno djeluje na organizam, a najprije su vidljive posljedice u oštećenju mozga i jetara. Jetra sporo razgrađuju etanol, a za to vrijeme alkohol kruži tijelom u krvotoku i štetno djeluje na sve organe, naročito na mozak. Metanol je opasniji od etanola zato što se metanol veoma sporo razgrađuje pa već vrlo mala količina dugo vremena kruži tijelom i izaziva nepopravljiva oštećenja u organizmu.
Alkoholometar je instrument kojim policija utvrđuje volumni udio alkohola u dahu vozača. Vožnja u alkoholiziranom stanju uzrok je brojnih prometnih nesreća sa smrtnim posljedicama.
Zašto je opasna vožnja pod utjecajem alkohola?
- 0,5 promila etanola u krvi – usporeni refleksi, treba više vremena za reakciju
- 1 promil etanola u krvi – jako je narušena ravnoteža, zamagljuje se vid
- 4 promila etanola u krvi – teško pijano stanje i nesvjestica
Utjecaj etanola na sposobnost upravljanja motornim vozilima:
- pri 0,2 ‰ etanola u krvi primjećuju se prve smetnje psihomotoričkih funkcija (dopuštena granica alkohola za upravljanje motornim vozilima u Norveškoj i Švedskoj)
- pri 0,5 ‰ etanola u krvi oslabljene su psihomotoričke funkcije, usporeni su refleksi, više vremena treba za reakciju (dopuštena granica alkohola za upravljanje motornim vozilima u RH)
- pri 0,8 ‰ promila etanola u krvi gotovo sve osobe pokazuju ozbiljne smetnje u spremnosti upravljanja vozilom (dopuštena granica alkohola za upravljanje motornim vozilima u Velikoj Britaniji)
- pri 1 ‰ etanola u krvi poremećen je osjećaj ravnoteže i zamagljen je vid
- pri 2 ‰ etanola u krvi ravnoteža je toliko poremećena da nastupa teturanje; osoba je pijana
- pri 3 ‰ etanola u krvi osoba gubi prisebnost jer je u stanju teškog pijanstva
- pri 4 ‰ etanola u krvi osoba je u teškom pijanom stanju i često se onesvijesti, pada u alkoholnu komu što može u roku od nekoliko sati dovesti do smrti.
Etanol se razgrađuje u jetrima i njegova se koncentracija smanjuje za 0,1 ‰ na sat.

Što je tinktura?
Tinkture su alkoholne otopine tvari. Najpoznatija tinktura u medicini koja se koristi kao antiseptik jest tinktura joda. U kućnoj izradi popularne su tinkture ljekovitih biljaka. Pri tome se alkohol koristi kao otapalo i konzervans. Smjesa alkohola i vode može biti u različitim omjerima, a omjer biljke i tekućine najčešće je 1 : 5.
Osim etanola, otapalo u tinkturi mogu biti glicerin ili ocat.
Potražite na mrežnim stranicama legendarni recept za izradu tinkture na bazi jabučnog octa i ljekovitog bilja: Ocat četvorice lopova. U prošlosti je korišten i kao lijek protiv kuge.
Na kraju…
Rješavanjem interaktivnog zadataka, usustavite pojmove obrađene u ovoj jedinici DOS-a te potom riješite interaktivni kviz.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Alkohol molekulske formule jest:
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Hidroksilna skupina () sastoji se od jednog atoma vodika i jednog atoma kisika.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Označite 2 svojstva metanola.
Unesite odgovore na pripadajuća mjesta.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Spojite odgovarajuće parove.
glicerol
alkoholno vrenje
hidroksilna skupina
propan-1,2,3-triol
reagens za alkotest
otopina kalijeva bikromata / sumporna kiselina
fermentacija
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Jedan od izomera alkohola, molekulske formule , jest:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izbacite uljeza.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Spojite odgovarajuće parove.
propan-2-ol
4-metilpentan-1-ol
etanol
heksan-2-ol
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Jedan od produkata gorenja alkohola uz dovoljan dotok zraka jest:
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Spojite odgovarajuće parove.
reagens za alkotest
fermentacija
propan-1,2,3-triol
glicerol
alkoholno vrenje
hidroksilna skupina
otopina kalijeva bikromata / sumporna kiselina
Želite li pokušati ponovo?