Karboksilne kiseline
- povezati prirodne izvore organskih kiselina i njihova trivijalna imena
- opisati i objasniti svojstva, upotrebu i dobivanje octene kiseline
- jednadžbom kemijske reakcije prikazati proces octeno-kiselog vrenja.
Uvod
Organske kiseline
Iz svakidašnjeg života čovjeku su poznate organske tvari kao hrana, začin, lijek ili materijal za druge namjene.
Od davnina su travari i ljekarnici prikupljali brojna znanja i iskustva s prirodnim organskim tvarima.
Uvod
Iz svakidašnjeg života čovjeku su poznate organske tvari kao hrana, začin ili lijek. Od davnina su travari i ljekarnici prikupljali brojna znanja i iskustva s prirodnim organskim tvarima.
U sastavu naše hrane nalaze se organske kiseline.
Mliječna kiselina nalazi se u kiselom mlijeku.
Limunska kiselina nalazi se u narančama, grejpu i limunu (agrumi).
Oleinska kiselina nalazi se u biljnom ulju.
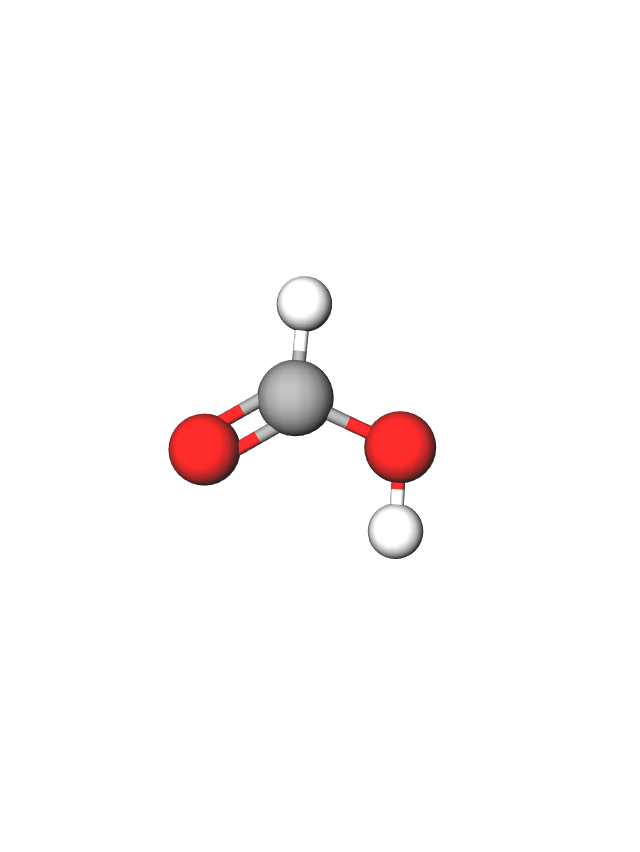
U 17. stoljeću engleski kemičar S. Fisher prvi je pripravio mravlju kiselinu u kemijskom laboratoriju.
Brojne druge organske kiseline izolirao je Carl W. Scheele tijekom 18. stoljeća: vinsku, jabučnu, limunsku, mliječnu, oksalnu i druge.
Karboksilne kiseline
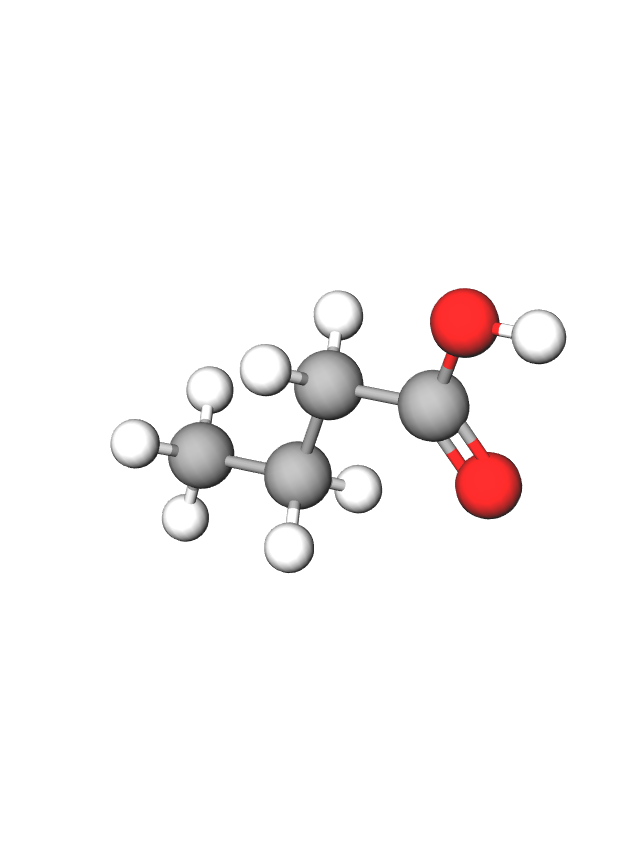
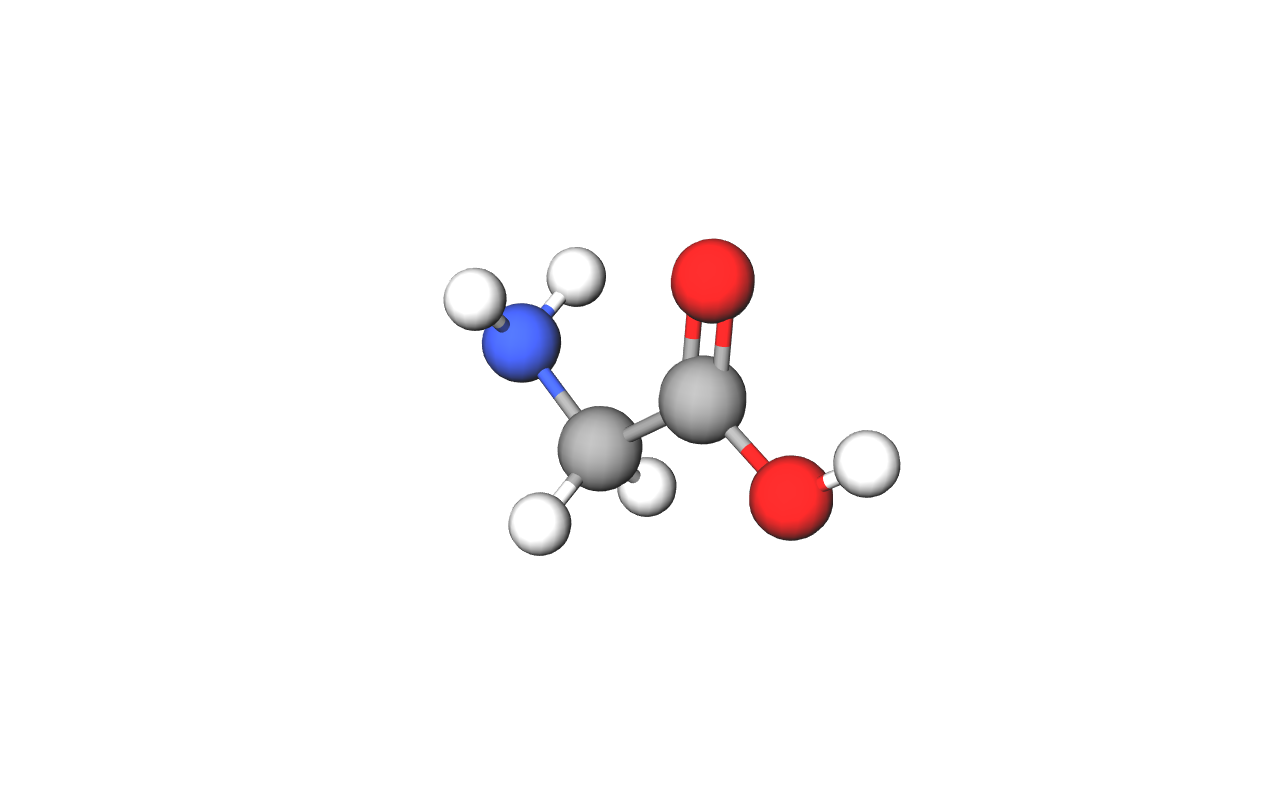
Organske kiseline u svojoj građi sadrže karboksilnu funkcijsku skupinu.
Zato ih nazivamo karboksilne kiseline.
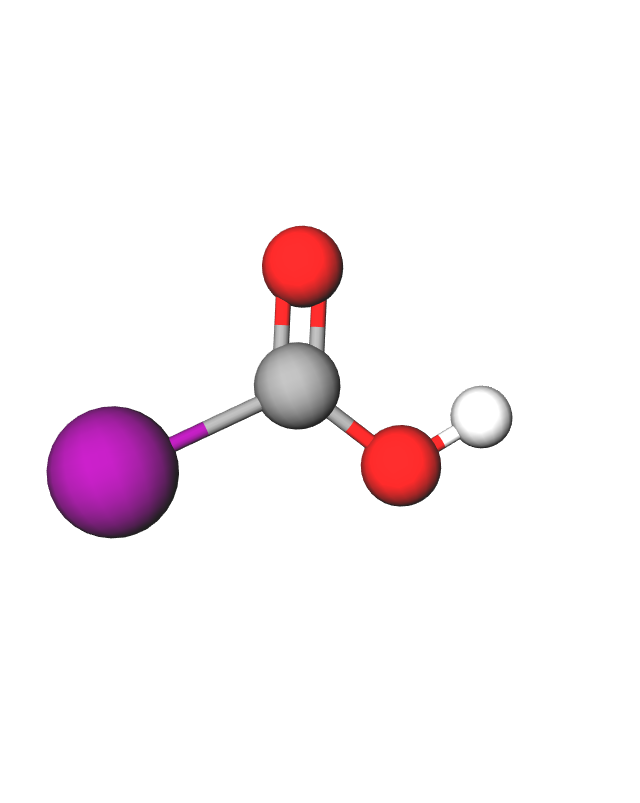
Fotografija prikazuje model molekule karboksilne kiseline.
U sastavu naše hrane nalaze se organske kiseline. Mliječna kiselina nalazi se u kiselom mlijeku, agrumi (limun, naranča, grejp) sadrže limunsku kiselinu, a biljno ulje sadrži oleinsku kiselinu.
Engleski kemičar S. Fisher 1670. godine prvi je pripravio mravlju kiselinu suhom destilacijom mrava. Brojne druge organske kiseline izolirao je Carl W. Scheele tijekom 18. stoljeća: vinsku, jabučnu, limunsku, mliječnu, oksalnu i druge.
Karboksilne kiseline
Organske kiseline nazivamo karboksilne kiseline jer u svojoj građi sadrže karboksilnu funkcijsku skupinu. Ta funkcijska skupina sastoji se od jednog atoma ugljika, dvaju atoma kisika i jednog atoma vodika. Ugljik iz karboksilne funkcijske skupine početni je (prvi) ugljik u molekuli. Kod najmanje karboksilne kiseline to je i jedini ugljik u molekuli.
Karboksilna funkcijska skupina () sastoji se od:
- jednog atoma ugljika –
- dvaju atoma kisika – ,
- jednog atoma vodika – .
Znakom R označen je dio molekule koji može biti različita sastava. Kod najmanje karboksilne kiseline na tome je mjestu atom vodika, a kod većih molekula karboksilnih kiselina to je najčešće ugljikovodični dio molekule.
Karboksilne kiseline mogu imati jednu ili više karboksilnih skupina.
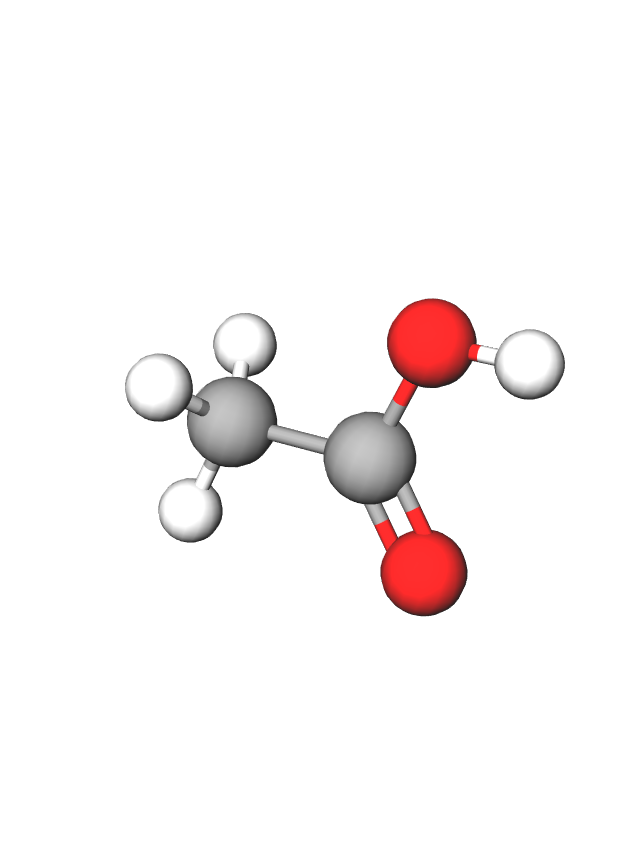
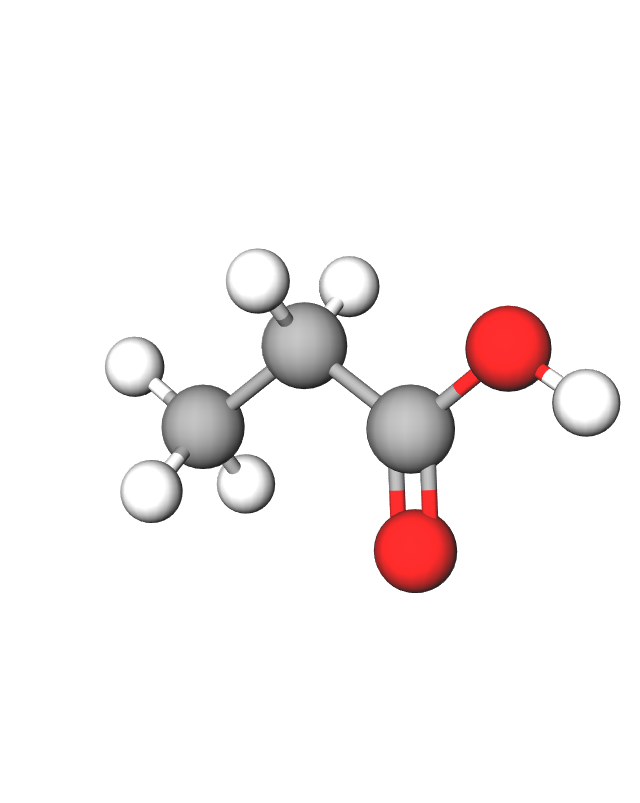
Prikažimo nekoliko karboksilnih kiselina s jednom karboksilnom skupinom i zasićenim ugljikovodičnim lancem. Njihova trivijalna imena navedena su u zagradama.
Ime karboksilne kiseline određeno je brojem ugljikovih atoma u najduljem ugljikovodičnom lancu. Sustavno ime karboksilne kiseline određuje se prema imenu najduljeg ugljikovodičnog lanca kojemu se doda nastavak -ska i riječ kiselina. Lanac uključuje i ugljikov atom karboksilne skupine. Tako je ime za prvu kiselinu u nizu dobiveno spajanjem riječi: metan + ska kiselina; metanska kiselina.
Budući da su ti spojevi poznati odavno, imaju i trivijalna imena koja su najčešće povezana uz način njihova dobivanja u prošlosti. Metanska kiselina prvi je put izolirana iz mrava pa se zato zove mravlja kiselina.
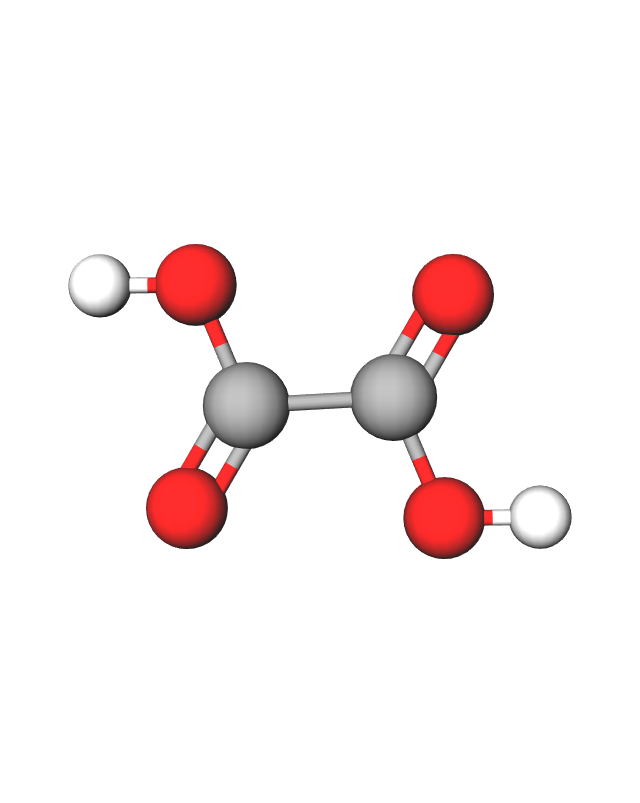
Ako molekula ima više istih funkcijskih skupina, koriste se poznati predmetci di- , tri-, tetra- itd. Primjer: etanska dikiselina (oksalna).
Istražite utječe li hrana bogata oksalnom kiselinom na stvaranje bubrežnih kamenaca.
Etanska dikiselina ili oksalna kiselina prirodni je sastojak nekih biljaka. Neke su od njih: kupine, borovnice, grožđe, špinat, blitva, peršin, poriluk i zeleni čaj.
U reakciji s kalcijevim ionima oksalna kiselina stvara netopljivu sol kalcijev oksalat. Iz tijela čovjeka ta se sol ne može izbaciti putem mokraće pa se taloži u obliku kamenčića.
Neke poznate karboksilne kiseline
Svojstva karboksilnih kiselina
Karboksilne kiseline s manjim brojem ugljikovih atoma pri sobnoj su temperaturi tekućine koje se miješaju s vodom. Kiseline koje u svojem sastavu imaju manje od sedam ugljikovih atoma imaju oštar miris i kiseo okus (npr. metanska kiselina).
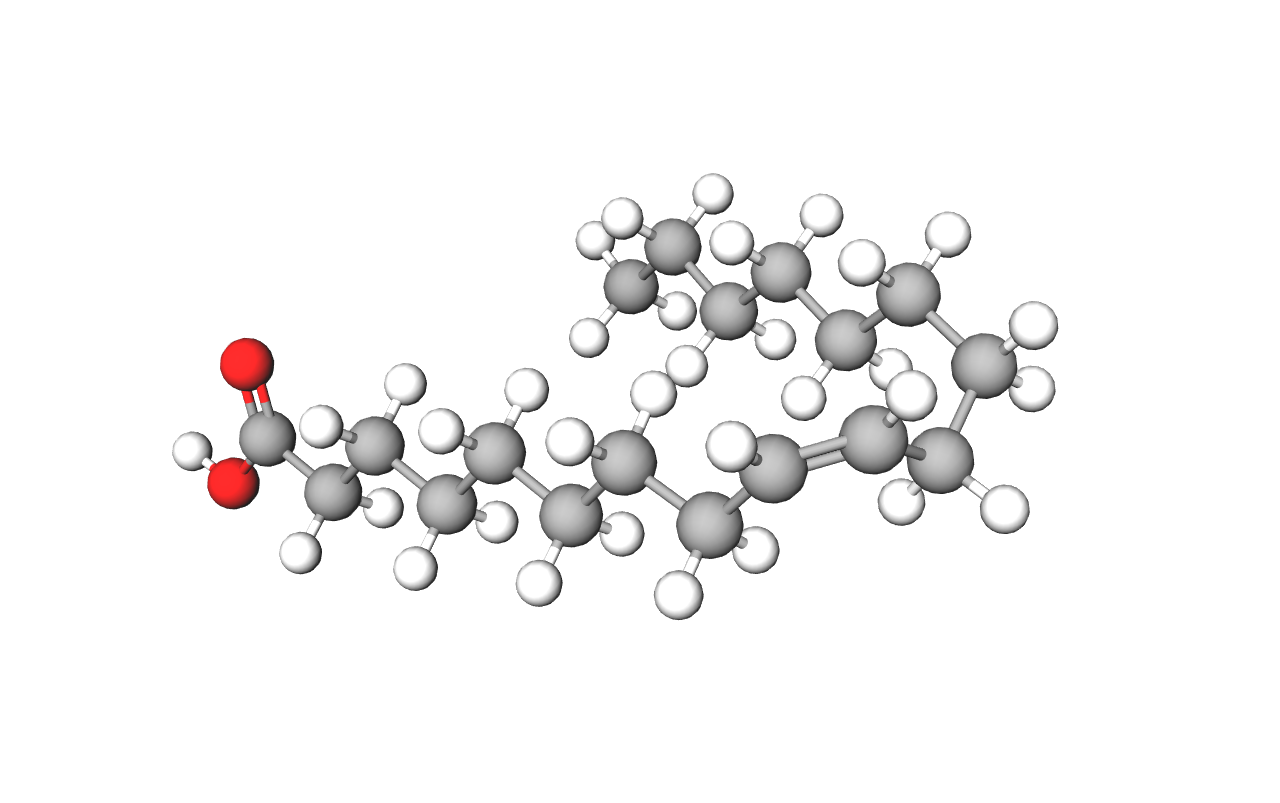
Karboksilne kiseline s više od devet ugljikovih atoma u svojem sastavu čvrste su tvari bez mirisa i okusa te nisu topljive u vodi. Najpoznatije su među njima masne kiseline, primjerice, stearinska kiselina.
Poput anorganskih (mineralnih) kiselina i karboksilne kiseline reagiraju s metalima, metalnim oksidima i lužinama.
Svojstva, upotreba i dobivanje octene kiseline
Etanska kiselina (octena) najčešće je korištena karboksilna kiselina u svakodnevnom životu.
To je bezbojna tekućina karakteristična oštra mirisa.
Čista octena kiselina (99,5 %) ima ledište pri 17 °C.
Njezini kristali izgledaju poput leda te je dobila ime ledena octena kiselina.
Svojstva, upotreba i dobivanje octene kiseline
Etanska kiselina (octena) najpoznatija je i najčešće korištena karboksilna kiselina u svakodnevnom životu. To je bezbojna tekućina karakteristična oštra mirisa. Ledište čiste octene kiseline (99,5 %) jest pri 17 °C, a pri nižoj temperaturi od te prelazi u čvrsto agregacijsko stanje. Njezini kristali izgledaju poput leda te je dobila ime ledena octena kiselina.
U kemijskim laboratorijima često se koristi 80 %-tna octena kiselina.
U kućanstvu se koristi 9 %-tna octena kiselina kao začin jelima ili konzervans za povrće.
Octena kiselina nastaje u procesu octeno-kiselog vrenja.
Pri tome se događa oksidacija molekule alkohola kisikom iz zraka.
Nastaju etanska (octena) kiselina i voda.
| CH3CH2OH(l) | + | O2(g) | → | CH3COOH(l) | + | H2O(l) |
| ↓ | ↓ | ↓ | ↓ | |||
| alkohol etanol | + | kisik | → | etanska (octena) kiselina | + | voda |
Proizvodnja octa nekad i danas
Octena kiselina jedina je kiselina koja je poznata tako dugo kao i vino.
Od davnina su vinari znali da se vino stajanjem na zraku ukiseli.
To su pokušali izbjeći tako što su posude od pečene gline napunili vinom do vrha, zatvorili ih glinenim čepom i zalili voskom.
No kiseljenje vina ipak se nije u potpunosti uspjelo izbjeći pa su imali velike količine kiselog vina, odnosno vinskog octa.
Vinski ocat koristio se kao začin i konzervans.
Koristio se i za liječenje rana, kao antibiotik i za pripravu ljekovitog napitka u smjesi s medom.
Najstariji podatak o proizvodnji octa potječe iz 17. stoljeća, a tek se krajem 19. stoljeća ocat započeo proizvoditi na temelju znanstvenih spoznaja. Postoje razni postupci proizvodnje octa, primjerice Pasteurov i Schützenbachov.
U kemijskim laboratorijima često se koristi 80-postotna octena kiselina. U kućanstvu se koristi 5 %-tna, 6 %-tna i 9 %-tna octena kiselina kao začin jelima ili konzervans za povrće, a u industriji za proizvodnju lijekova, plastičnih masa i boja.
Octena kiselina koja se koristi u kućanstvima vrlo je razrijeđena kiselina i može se konzumirati. Iako je s kemijskog stajališta octena kiselina slaba kiselina jer se tek mali postotak molekula disocira na ione, koncentrirana octena kiselina opasna je jer jako nagriza sluznicu. Nekada je bilo moguće koncentriranu octenu kiselinu kupiti u trgovinama prehrambenim proizvodima jer su je domaćice same razrjeđivale i koristile pri konzerviranju povrća za zimnicu. Budući da je bilo trovanja takvom koncentriranom kiselinom, zabranjena je njezina prodaja u trgovinama prehrambenim proizvodima.
Octena kiselina nastaje u procesu octeno-kiselog vrenja. Pri tome se događa oksidacija molekule alkohola kisikom iz zraka.
Produkti su etanska (octena) kiselina i voda. To se vrenje odvija uz prisutnost octenih bakterija.
Proizvodnja octa nekad i danas
Octena je kiselina jedina kiselina poznata od davnina – za nju se zna otkad i za vino. Drevni su vinari dobro znali da se vino stajanjem na zraku ukiseli. To su pokušali izbjeći tako što su posude od pečene gline napunili vinom do vrha, zatvorili ih glinenim čepom i zalili voskom. Kiseljenje vina ipak se nije u potpunosti uspjelo izbjeći. Što učiniti s kiselim vinom, tj. vinskim octom? Povijest bilježi neobične primjere, pa se njime čak polijevalo tlo i kopali se rovovi u rudniku. Od davnina se ocat koristio kao začin i konzervans. Vinski je ocat korišten i za liječenje rana, kao antibiotik i za pripravu ljekovitog napitka u smjesi s medom.
Najstariji podatak o proizvodnji octa potječe iz 17. stoljeća, a tek se krajem 19. stoljeća ocat započeo proizvoditi na temelju znanstvenih spoznaja. Postoje različiti postupci proizvodnje octa, primjerice Pasteurov i Schützenbachov.
Danas se ocat dobiva na dva načina: octenim vrenjem alkoholnih tekućina i razrjeđivanjem koncentrirane octene kiseline dobivene u kemijskoj industriji.
Vinski se ocat proizvodi octenim vrenjem vina. Od gustog voćnog soka ili vinskog mošta dugotrajnim i kompliciranim postupkom proizvodi se balzamski ocat. Dodatkom aromatičnog i ljekovitog bilja u vinski ocat dobiva se aromatizirani ocat. U današnjoj kuhinji popularni su još jabučni ocat i ocat od riže.
Istražite stvara li se bol u mišićima, nakon opterećenja, zbog nakupljanja mliječne kiseline.
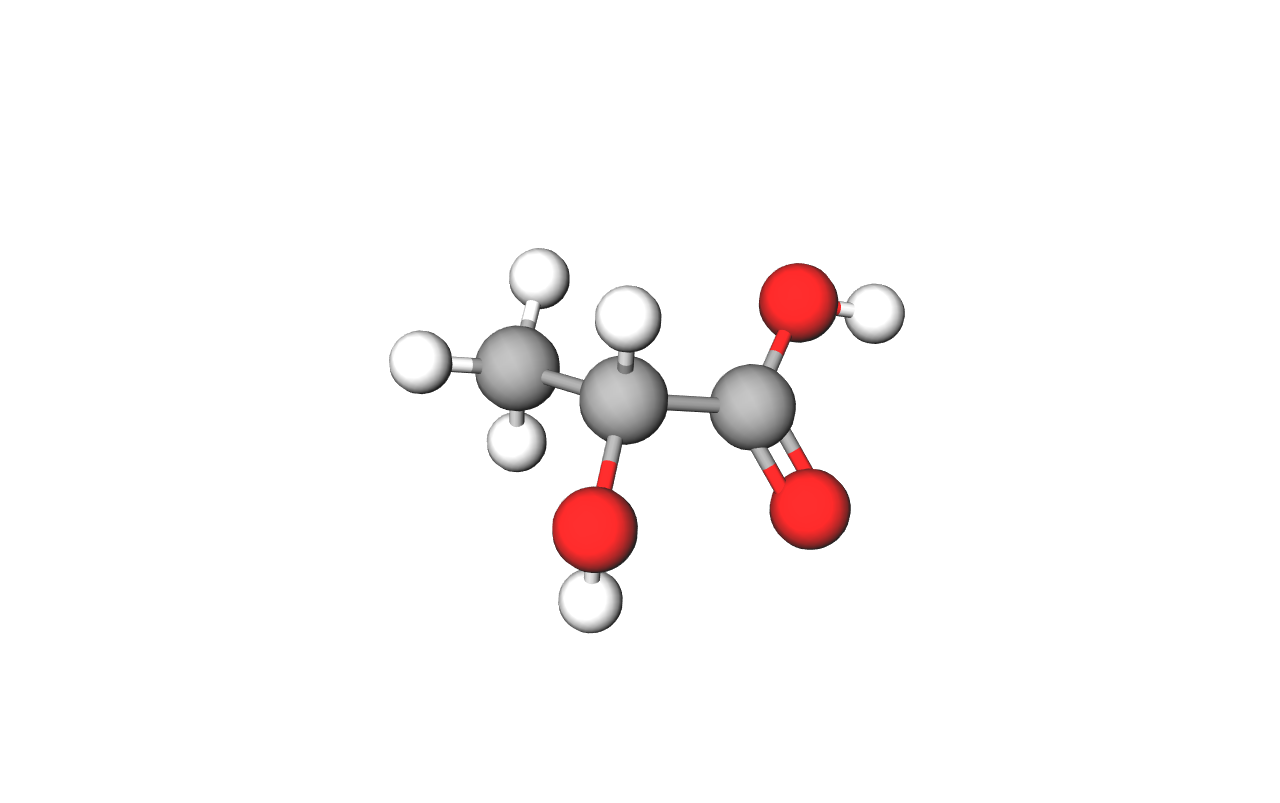
Ako se uz hidroksilnu skupinu na molekuli nalazi još neka funkcijska skupina, tada se u imenovanju spoja za označavanje alkoholne funkcijske skupine koristi predmetak: hidroksi-.
Primjer takve kiseline jest 2-hidroksipropanska kiselina čije je trivijalno ime mliječna kiselina.
2-hidroksipropanska kiselina ima dvije funkcijske skupine, hidroksilnu i karboksilnu. Nastaje u procesu kiseljenja mlijeka. Mliječno-kiselim vrenjem nastaju još i kiselo zelje, sirevi, jogurt i dr.
Smatra se da mliječna kiselina nastaje u mišićima nakon naporne tjelesne aktivnosti zbog nedovoljne količine kisika. Pri tome mliječna kiselina nastaje iz glukoze. Je li to uistinu tako ili postoje i druga mišljenja?
Na kraju…
Riješite interaktivne zadatke koji slijede!
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Prva organska kiselina koju je u laboratoriju pripravio S. Fisher bila je:
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Karboksilna funkcijska skupina sastoji se od 2 atoma kisika, 1 atoma vodika i 1 atoma ugljika.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Uparite ime karboksilne kiseline sa sažetom strukturnom formulom.
octena kiselina
maslačna kiselina
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Što je produkt mliječno-kiselog vrenja?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izbacite uljeza.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Što je produkt mliječno-kiselog vrenja?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliki je maseni udio kisika u mravljoj kiselini?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kako glasi empirijska formula butanske kiseline?
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Spojite odgovarajuće parove.
viša masna kiselina
kemijska reakcija oksonijeva i hidroksidna iona pri čemu je produkt voda
oksidacija etanola djelovanjem octenih bakterija
kiseline na kojih je na dugački ugljikovodični lanac vezana karboksilna skupina
karboksilna skupina
alkoholno vrenje
neutralizacija
-COOH
Želite li pokušati ponovo?