Esteri
- prikazati procese esterifikacije i hidrolize estera s pomoću jednadžbe kemijske reakcije
- usporediti reakciju nastajanja soli s reakcijom nastajanja estera
- navesti fizikalna svojstva estera.
Uvod
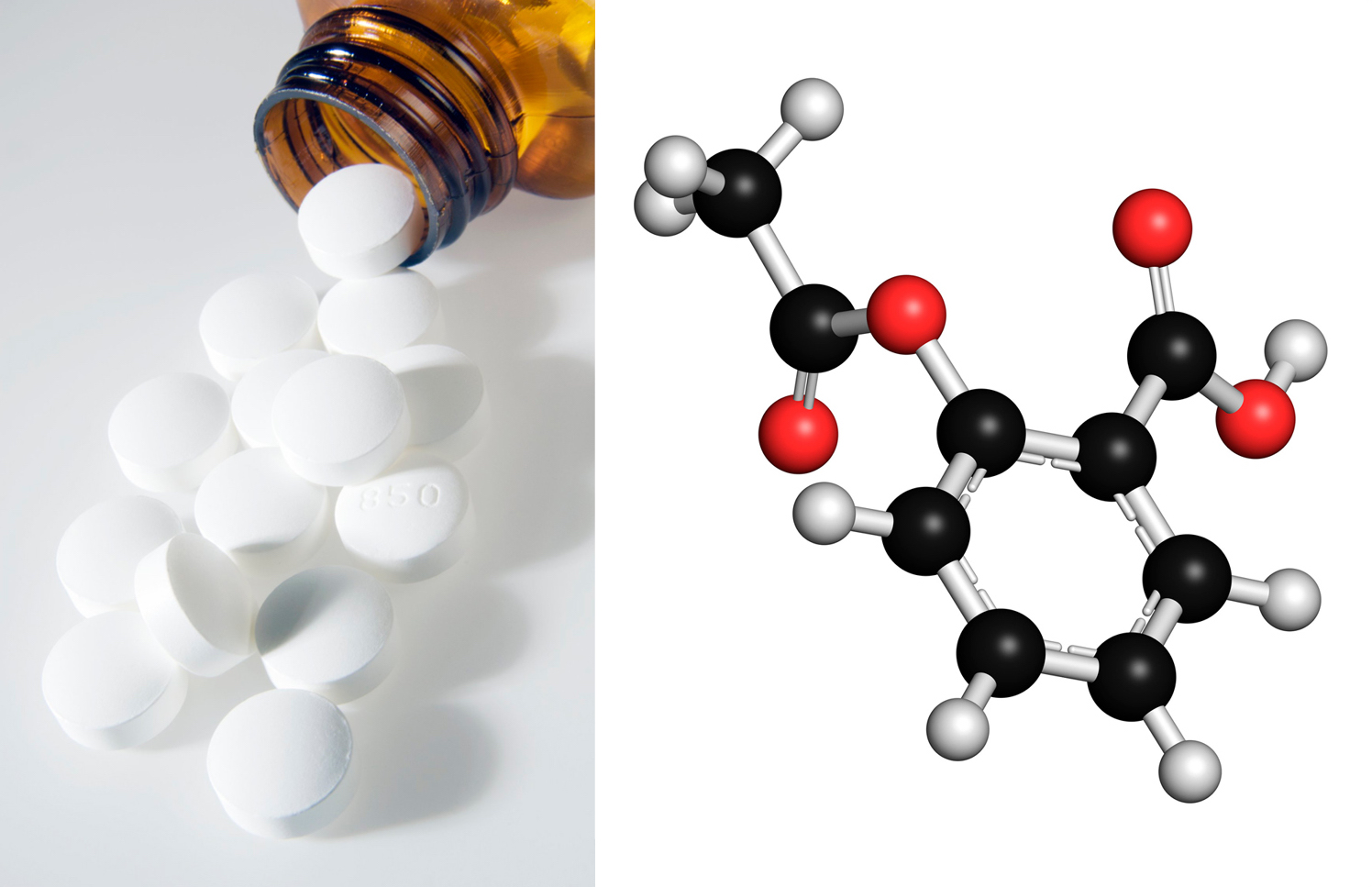
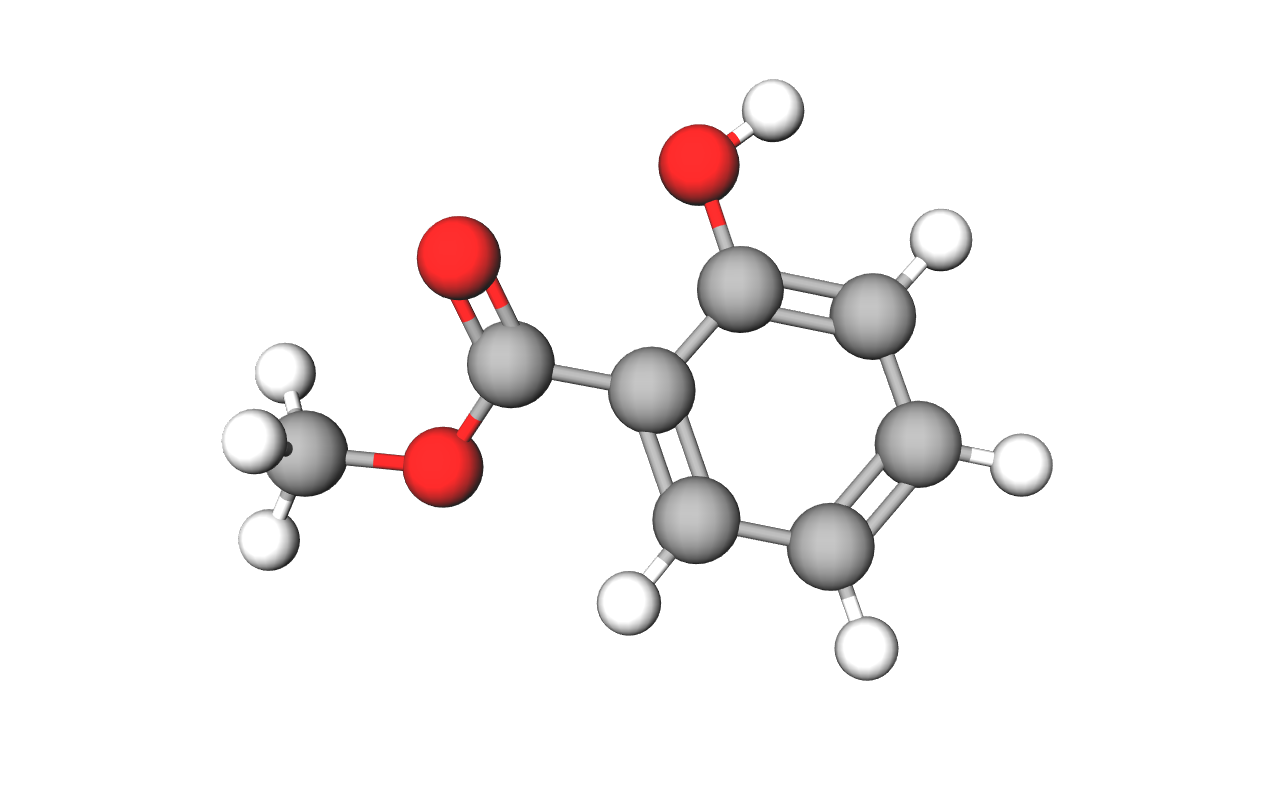
Francuski kemičar Charles Frederic Gerhardt pripravio je aspirin 1853. godine, a njemački je kemičar Felix Hoffmann razvio postupak za tvorničku proizvodnju aspirina oko 1890. godine. Od tada je aspirin najpoznatiji i najprodavaniji lijek protiv bolova i za snižavanje temperature.
Istražite kako je otkriće aspirina povezano s čajem od vrbine kore. Neka vam u radu pomognu prijatelji iz razreda. A što je aspirin po kemijskom sastavu? Saznajte u ovom poglavlju.
Esteri
Esteri su zanimljivi organski spojevi zahvaljujući kojima cvijeće i voće u prirodi krasno miriše.
Esteri se proizvode i u laboratoriju i često su dio prehrambenih i kozmetičkih proizvoda.
Postoje i esteri koji nemaju mirisa, ali su izuzetno važni.
Jedan je od njih aspirin, a tu su i pčelinji vosak, kao i pleksiglas.
Biljna ulja i životinjske masti također pripadaju esterima.
I esteri pripravljeni u laboratoriju zanimljivi su zbog svojih mirisa. Brojni esteri proizvedeni u laboratoriju sastavni su dio prehrambenih i kozmetičkih proizvoda.
Osim estera lijepa mirisa, postoje i drugi esteri koji nemaju mirisa, ali su značajni po nečemu drugome. Spomenut je već lijek aspirin, a dodamo li k tome indikator za lužine fenolftalein, pa prirodni pčelinji vosak i još jednu poznatu plastičnu masu – pleksiglas, već imamo široku lepezu estera. Biljna ulja i životinjske masti također pripadaju esterima.
Esterifikacija
Esterifikacija je kemijska reakcija nastajanja estera.
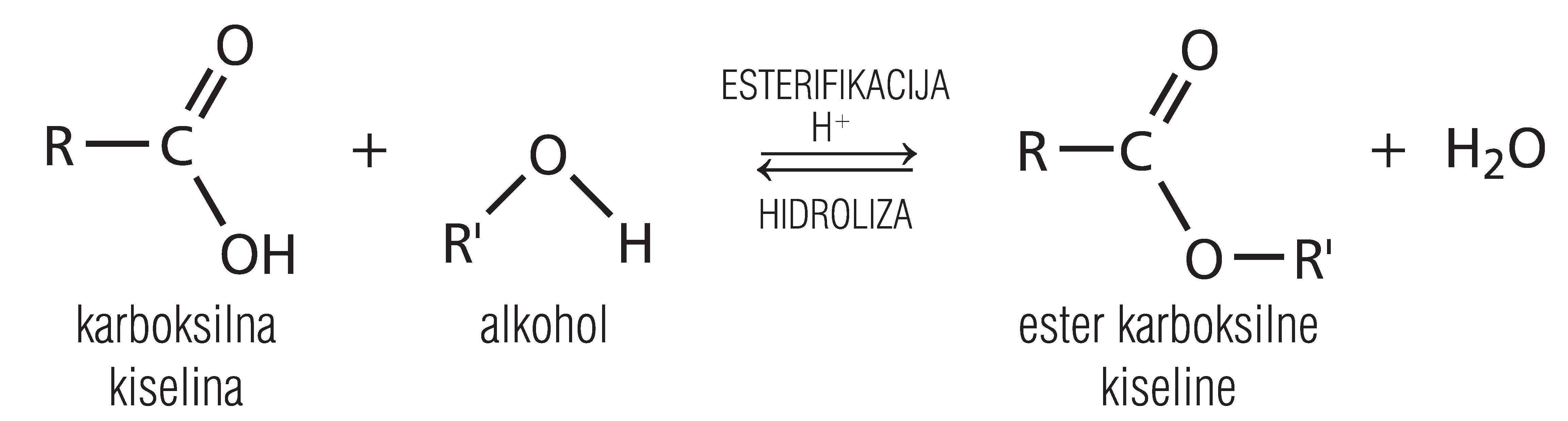
U toj reakciji reaktanti su karboksilna kiselina i alkohol, a produkti su ester i voda.
Prikažimo jednadžbu kemijske reakcije esterifikacije u kojoj sudjeluje molekula etanske kiseline (octene kiseline) i alkohola etanola.
| + | + | |||||
| ↓ | ↓ | ↓ | ↓ | |||
| etanska kiselina | etanol | etil-etanoat | voda |
Dobiveni ester naziva se etil–etanoat i ima karakterističan miris po ljepilu.
Nakon nekog vremena nastali ester razgrađuje se ponovo na početne tvari uz djelovanje vode.
Zato kažemo da je esterifikacija reverzibilna – zbog razgradnje na početne tvari.
U molekuli estera istaknimo funkcijsku skupinu estera koja se sastoji od ugljika i dva kisika: R-COO-R.
.
Slovo “R” označava ugljikovodični dio molekule.
U molekuli estera kratice “R” ne moraju biti iste. U općoj formuli estera, R − COO − R, prvi znak “R” označava dio koji potječe od molekule karboksilne kiseline, dok zadnji znak “R” označava dio koji potječe od molekule alkohola.
Esterifikacija
Esterifikacija je kemijska reakcija nastajanja estera. U toj reakciji reaktanti su karboksilna kiselina i alkohol, a produkti su ester i voda. Uz prisutnost katalizatora esterifikacija će biti provedena uz nižu energiju aktivacije i vrijeme reakcije bit će kraće.
Reakcija esterifikacije je reverzibilna, što znači da se nakon nekog vremena nastali ester razgrađuje ponovo na početne tvari uz djelovanje vode.
Prikažimo jednadžbu kemijske reakcije esterifikacije u kojoj sudjeluju molekula etanske kiseline (octene kiseline) i alkohola etanola.
| + | + | |||||
| ↓ | ↓ | ↓ | ↓ | |||
| etanska kiselina | etanol | etil-etanoat | voda |
Dobiveni ester naziva se etil-etanoat (trivijalnog imena etil-acetat) i ima karakterističan miris. Neka ljepila mirišu po etil-etanoatu.
U molekuli estera istaknimo funkcijsku skupinu estera koja se sastoji od ugljika i dvaju kisika:
.
Slovo “R” označava ugljikovodični dio molekule. U molekuli estera kratice “R” ne moraju biti iste. U općoj formuli estera, , prvi znak “R” označava dio koji potječe od molekule karboksilne kiseline, dok zadnji znak “R” označava dio koji potječe od molekule alkohola.
Prikažimo kemijskom jednadžbom nastajanje estera.
Imenovanje estera
Naziv estera sastoji se od dvaju dijelova.
- Prvi dio u imenu estera potječe od alkohola koji je sudjelovao u reakciji esterifikacije.
Pri tome se u imenu alkohola nastavak -ol zamjenjuje nastavkom -il: propanol – propil
etanol – etil. - Drugi dio u imenu estera potječe od karboksilne kiseline.
Nazivu kiseline nastavak -ska zamjenjuje se nastavkom -oat:
etanska – etanoat
metanska – metanoat.
Ester koji je nastao reakcijom metanola i butanske kiseline nazivamo metil-butanoat.
Taj ester daje lijep miris našim jabukama.
U sljedećoj tablici pogledajte nekoliko primjera imenovanja estera.
Imenovanje estera
Naziv estera sastoji se od dvaju dijelova. Prvi dio u imenu estera potječe od alkohola koji je sudjelovao u reakciji esterifikacije.
Pri tome se u imenu alkohola dometak -ol zamjenjuje nastavkom -il (npr. metanol/metil).
Drugi dio imena estera potječe od karboksilne kiseline. Nazivu kiseline nastavak -ska i riječ kiselina zamjenjuju se nastavkom -oat (npr. butanska kiselina / butanoat).
Ester koji je nastao reakcijom metanola i butanske kiseline nazivamo metil-butanoat. Taj je ester zaslužan za lijep miris jabuka.
U sljedećoj tablici pogledajte nekoliko primjera imenovanja estera.
| alkohol | karboksilna kiselina | ester | miris estera |
|---|---|---|---|
| propanol | etanska kiselina | propil-etanoat | miris kruške |
| etanol | metanska kiselina | etil-metanoat | miris ruma |
| etanol | butanska kiselina | etil-butanoat | miris ananasa |
| pentanol | etanska kiselina | pentil-etanoat | miris banane |
Usporedba nastajanja estera i nastajanja soli
Reakcija esterifikacije slična je kemijskoj reakciji nastajanja soli.
Promotrite i usporedite:
Esterifikacija:
Nastajanje soli:
Prikažimo neke primjere jednadžbi kemijskih reakcija.
a) reakcija etanske kiseline i metanola – esterifikacija
CH3COOH(aq) + CH3OH(aq) <-->[H+] CH3COOCH3(l) + H2O(l)
etanska kiselina + metanol ⇄ ester + voda
b) reakcija etanske kiseline i magnezija – nastajanje soli
2 CH3COOH(aq) + Mg(s) → Mg(CH3COO)2(aq) + H2(g)
etanska kiselina + magnezij → sol + voda
Hidroliza estera
Hidroliza je kemijska reakcija u kojoj molekula vode (hidro-) rastavlja (-liza) molekulu estera. Pri tome nastaju alkohol i karboksilna kiselina. Reakcija hidrolize estera suprotna je reakciji esterifikacije.
Primjer hidrolize metil-propanoata prikazan je jednadžbom kemijske reakcije:
.
Fizikalna svojstva estera
Esteri su lako hlapljive tekućine, imaju karakterističan mirisa, niska vrelišta i dobro su topljivi u organskim otapalima. U vodi se otapaju samo esteri koji imaju male vrijednosti relativnih molekulskih masa. Esteri s velikom relativnom molekulskom masom čvrste su tvari bez mirisa i lako se tale.
Usporedba nastajanja estera i nastajanja soli
Iako se mehanizam reakcije esterifikacije sasvim razlikuje od mehanizma reakcije nastajanja soli, moguće je povući određenu analogiju. Naime, u objema reakcijama sudjeluje karboksilna kiselina, ali je kod esterifikacije drugi reaktant alkohol, a kod dobivanja soli to može biti metal, metalni oksid ili hidroksid metala. U reakciji esterifikacije produkti su ester i voda, a u reakciji kiseline i metala produkti su sol i voda. Tu također treba uočiti važne razlike između dobivenih spojeva jer su esteri kovalentni spojevi koji nastaju reakcijom esterifikacije uz sumpornu kiselinu kao katalizator, a soli su ionski spojevi metala i kiselinskog ostatka.
Prikažimo neke primjere jednadžbi kemijskih reakcija.
a) reakcija etanske kiseline i metanola:
b) reakcija etanske kiseline i magnezija:
c) reakcija etanske kiseline i kalcijeva oksida:
d) reakcija etanske kiseline i natrijeva hidroksida:
Magnezij i kalcij su dvovalentni, a natrij je jednovalentan. Etanska je kiselina jednovalentna. U opisanim reakcijama iz molekule etanske kiseline izdvaja se vodik u sastavu karboksilne skupine.
Pri pisanju soli natrijeva etanoata, , vodik se izdvaja, a natrij dolazi na njegovo mjesto jer su oba atoma jednovalentna.
Kod pisanja oznake za soli kalcijeva, , ili magnezijeva etanoata, , spajamo dvovalentni kation metala s jedovalentnim kiselinskim ostatkom, (etanoatni ion).
Za jedan kation kalcija ili magnezija potrebna su dva etanoatna iona. U formulskoj jedinki kalcijeva i magnezijeva etanoata, složeni etanoatni ion pišemo u zagradi, a broj iona koji je potreban pišemo kao indeks izvan zagrade.
Hidroliza estera
Hidroliza je ime kemijske reakcije u kojoj molekula vode (hidro-) rastavlja (-liza) molekulu estera. Pri tome nastaju alkohol i karboksilna kiselina. Reakcija hidrolize estera suprotna je reakciji esterifikacije.
Primjer hidrolize metil-propanoata prikazan je jednadžbom kemijske reakcije:
.
Fizikalna svojstva estera
Esteri su lako hlapljive tekućine, imaju karakterističan miris, niska vrelišta i dobro su topljivi u organskim otapalima. U vodi se otapaju samo esteri koji imaju male vrijednosti relativnih molekulskih masa. Esteri s velikom relativnom molekulskom masom čvrste su tvari bez mirisa i lako se tale.
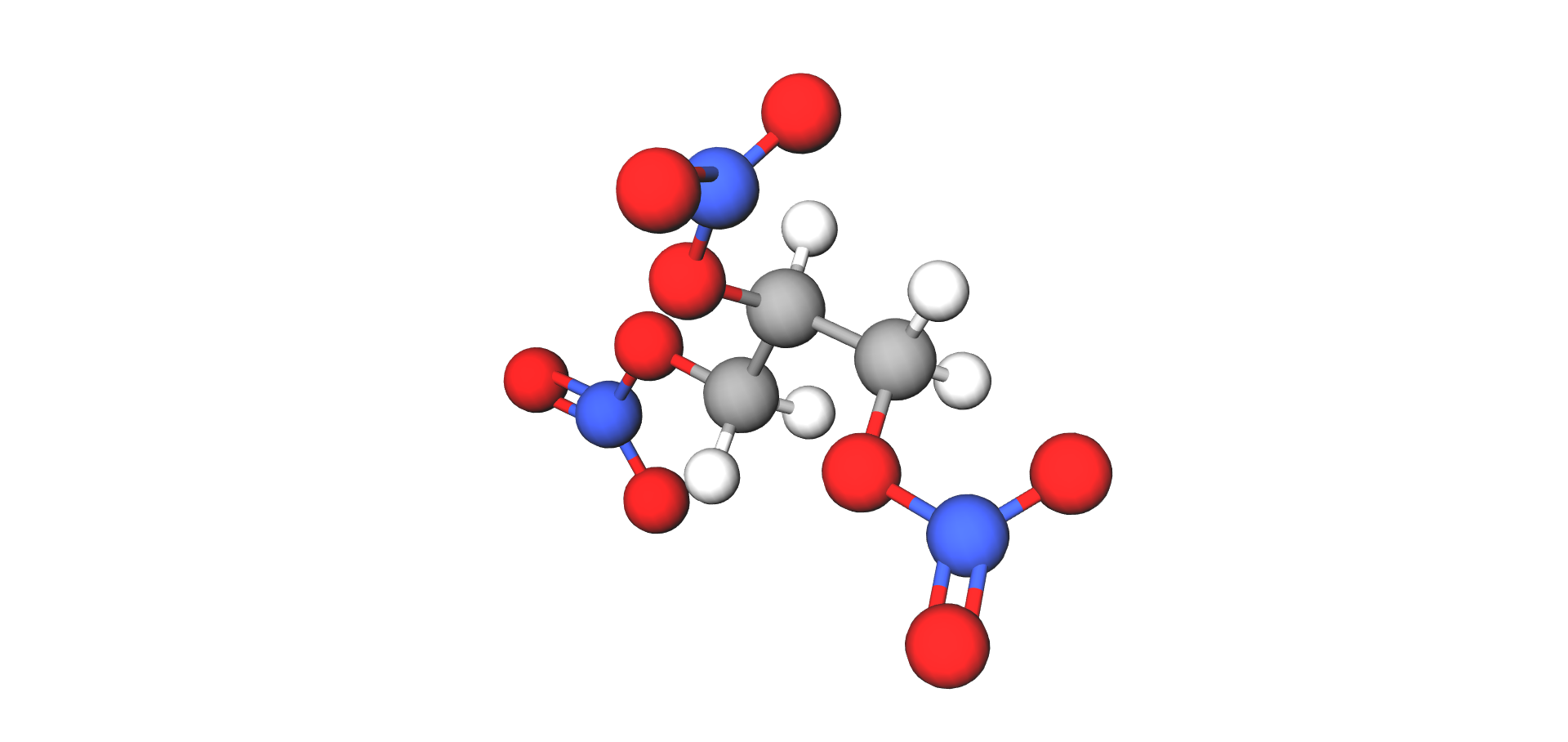
Nitroglicerin
Osim karboksilnih kiselina u procesu esterifikacije mogu sudjelovati i neke anorganske kiseline. Takve su sumporna, fosforna i dušična kiselina. Esteri dušične kiseline tekućine su osjetljive na udar pri čemu nastaje eksplozija. Najpoznatiji ester dušične kiseline jest gliceril-trinitrat (trivijalnog imena nitroglicerin) koji nastaje esterifikacijom alkohola glicerola i dušične kiseline. To je bezbojna i uljasta tekućina, netopljiva u vodi i osjetljiva na udar. Brzina detonacije jest oko 8000 m/s.
U suradnji s prijateljima iz razreda istražite kako je Alfred Nobel od gliceril-trinitrata pripravio dinamit te kakvu ulogu ima nitroglicerin u liječenju nekih srčanih bolesti.
Prikažite jednadžbom kemijske reakcije proces eksplozije gliceril-trinitrata, , ako su produkti dušik, kisik, ugljikov(IV) oksid i voda.
Odgovor:
Na kraju…
Riješite interaktivne zadatke!
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Kemijsku reakciju nastajanja estera nazivamo esterifikacija.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
U reakciji esterifikacije reaktanti su karboksilna kiselina i alkohol, a produkti ester i voda.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
U reakciji nastajanja soli reaktanti su karboksilna kiselina i metal, a produkti sol i ester.
Želite li pokušati ponovo?
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Spojite odgovarajuće parove.
etil-etanoat
etil-metanoat
metil-metanoat
metil-propanoat
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Spojite odgovarajuće parove.
katalizator
reakcija karboksilne kiseline i alkohola
hidroliza estera
reakcija estera s vodom
esterifikacija
sumporna kiselina
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kisik u molekuli vode kod reakcije esterifikacije potječe iz molekule:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Katalizator u reakciji esterifikacije jest:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji se ester dobije esterifikacijom propanola i mravlje kiseline?
Želite li pokušati ponovo?