Otopine i vrste otopina
- definirati pojmove otopina, nezasićena, zasićena i prezasićena otopina
- očitati podatke iz grafičkog ili tabličnog prikaza podataka o sastavu zasićene otopine
- definirati pojmove otapanje i topljivost
- dijagramom topljivosti prikazati ovisnost topljivosti tvari o temperaturi
- izračunati najveću masu soli koju je moguće otopiti u određenoj količini vode pri danoj temperaturi na temelju podataka
- predložiti postupak pripreme otopine zadanog sastava otapanjem čvrste tvari opisati topljivost plinova
- opisati topljivost plinova
- razvrstati otopine na kisele, bazične i neutralne.
Uvod
U svakodnevnom životu često pripremamo otopine:
povrće kuhamo u slanoj vodi, dodajemo šećer u čaj.
U trgovini kupujemo ledeni čaj, bistri voćni sok.
Sve su to
Uvod
U svakodnevnom životu često pripremamo otopine, a da toga nismo nekada niti svjesni. Primjerice, povrće kuhamo u slanoj vodi ili dodajemo šećer u vodu za čaj. Na policama trgovina nalaze se također brojne otopine. Sjetite se koliko ste puta uzeli bocu s mineralnom vodom, ledeni čaj ili bistri voćni sok – sve su to
Što su otopine?
Otopine su homogene smjese koje nastaju otapanjem tekućina,
plinova ili čvrstih tvari u nekoj tekućini.
Tekućina u kojoj se otapaju topljive tvari naziva se otapalo.
Tvari koje se otapaju u otapalu nazivaju se topljivim tvarima.
U otopinama koje se sastoje od dviju tekućina
otapalo je ona tekućina koje ima više.
Voda je najčešće otapalo.
Otopine u kojima je voda otapalo
nazivaju se vodenim otopinama.
Priprema otopine
Želimo li u laboratoriju pripremiti vodenu otopinu bakrova(II) sulfata,
izvagat ćemo odgovarajuću masu modre galice
(bakrova(II) sulfata pentahidrata)
i usuti je u čašu.
U čašu se dolije potreban volumen vode
i promiješa.
Što su otopine?
Otopine su homogene smjese koje nastaju otapanjem tekućina, plinova ili čvrstih tvari u nekoj tekućini.
Tekućina u kojoj se otapaju topljive tvari naziva se otapalo, a tvari koje se otapaju u otapalu nazivaju se topljivim tvarima. U otopinama koje se sastoje od dviju tekućina otapalo je ona tekućina koje ima više. Voda je najčešće otapalo. Otopine u kojima je voda otapalo nazivaju se vodenim otopinama.
Priprema otopine
Želimo li u laboratoriju pripremiti vodenu otopinu bakrova(II) sulfata, izvagat ćemo odgovarajuću masu modre galice (bakrova(II) sulfata pentahidrata) i usuti je u čašu. U čašu se dolije potreban volumen vode i promiješa.
Odredite sastojke zadanih smjesa.
Pred vama su sastojci različitih otopina koje susrećete u svakodnevnom životu. Pridružite određenim otopinama njihovo otapalo i otopljene tvari.Otapanje soli
Tijekom otapanja čestice otapala i otopljene tvari
se bitno ne mijenjaju.
Zbog toga otapanje fizikalna promjena.
Otapanje soli
Tijekom otapanja čestice otapala i otopljene tvari se bitno ne mijenjaju pa je otapanje fizikalna promjena.
Otapanje tvari može se ubrzati:
- usitnjavanjem,
- mješanjem otopine
- ili zagrijavanjem.
Neke se tvari ne otapaju u vodi,
ali se otapaju u drugim otapalima,
primjerice, alkoholu ili benzinu.
Topljivost se iskazuje masenim udjelom otopljene tvari
u zasićenoj otopini pri određenoj temeperaturi.
Označava se s w, gdje je
m1 – masa otapala
m2 – masa otopljene tvari
(engl. saturation = zasićenje)
Otopine mogu biti:
- nezasićene,
- zasićene
- i prezasićene.
Otopina u kojoj se može otopiti još topljive tvari
naziva se nezasićenom otopinom.
Otopina u kojoj se ne može otopiti dodatna količina tvari
zove se zasićena otopina.
Temperatura utječe na topljivost tvari.
To se može eksperimentalno ispitati
te pročitati iz tabličnih podataka
ili iz dijagrama topljivosti.
Otapanje neke čvrste tvari može se ubrzati njenim usitnjavanjem, miješanjem otopine ili promjenom temperature.
Neke se tvari ne otapaju u vodi, ali se otapaju u drugim otapalima, primjerice, alkoholu ili benzinu.
Koliko će se neke tvari otopiti u određenoj količini otapala ovisi o vrsti tvari i temperaturi.
Topljivost se iskazuje masenim udjelom otopljene tvari u zasićenoj otopini pri određenoj temperaturi,
– masa otapala
– masa otopljene tvari
(engl. saturation = zasićenje)
Prema količini otopljene tvari koja je u njima otopljena, otopine mogu biti nezasićene, zasićene i prezasićene.
Otopina u kojoj se pri određenoj temperaturi može otopiti još topljive tvari naziva se nezasićenom otopinom.
Otopina u kojoj se pri određenoj temperaturi ne može otopiti dodatna količina tvari zove se zasićena otopina.
Kako temperatura utječe na topljivost tvari može se eksperimentalno ispitati te pročitati iz tabličnih podataka ili iz
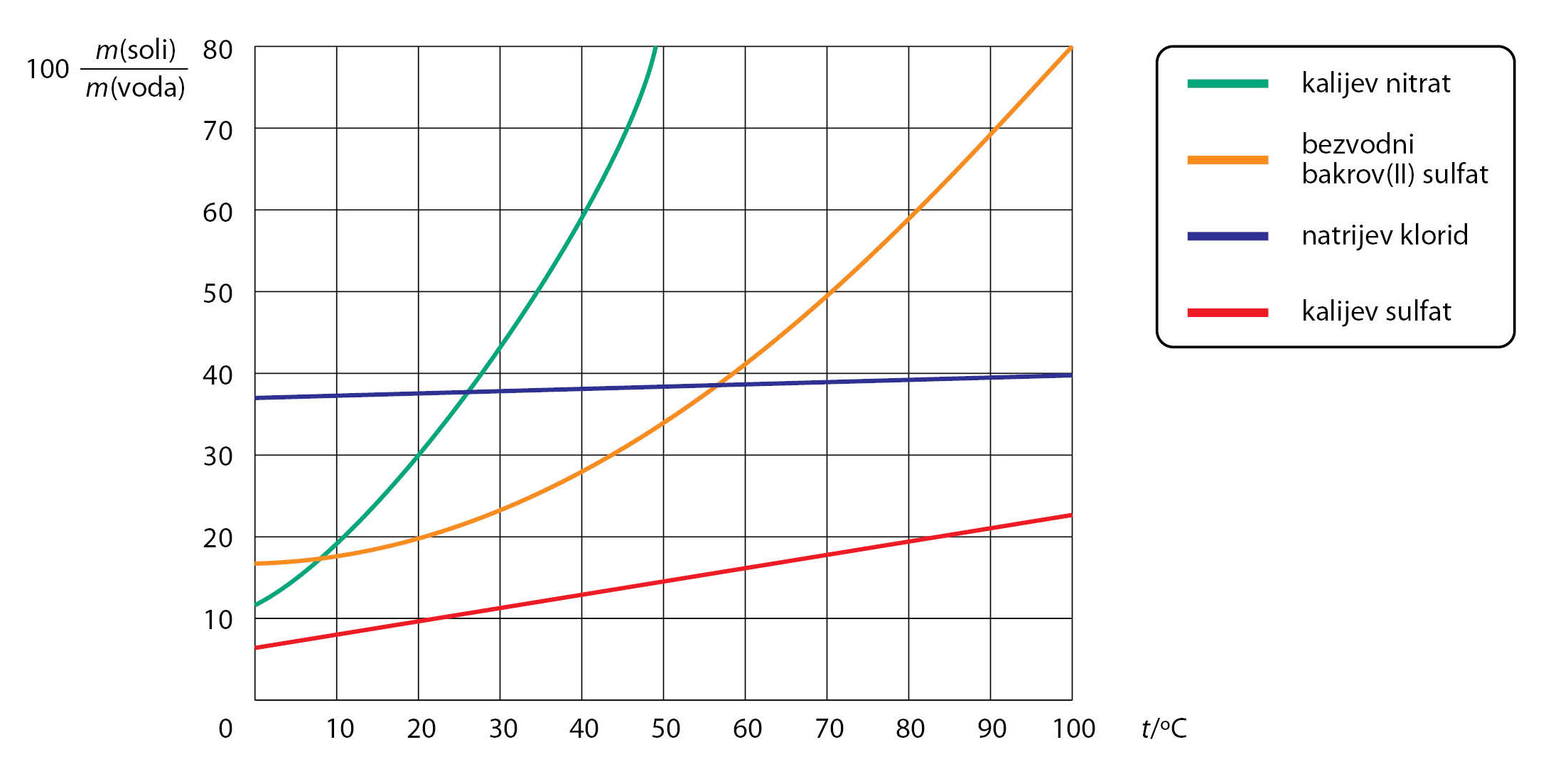
Iz grafičkog prikaza uočavamo da topljivost
kalijeva nitrata i bakrova(II) sulfata raste s porastom temperature,
dok se topljivost natrijeva klorida slabo mijenja porastom temperature.
Riješite zadatke.
1. Proučite krivulju topljivosti kalijeva sulfata
i zaključite kako povišenje temperature
utječe na topljivost te tvari?
Topljivost tvari nekada se iskazuje
i masom otopljene tvari u 100 g otapala.
Na temelju tabličnih podataka napravite krivulju topljivosti soli u ovisnosti o temperaturi.
Pri tome možete koristiti digitalni alat Meta-Chart.
| t/°C | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
|---|---|---|---|---|---|---|---|---|
| litijev sulfat | 35,0 | 32,0 | 30,0 | 29,0 | 28,0 | 27,0 | 26,0 | 25,0 |
| natrijev klorid | 35,7 | 36,0 | 36,4 | 36,7 | 37 | 37,4 | 37,6 | 38,0 |
| modra galica | 18,0 | 20,0 | 24,0 | 28,0 | 35,0 | 42,0 | 50,0 | 59,0 |
Iz grafičkog prikaza uočavamo da topljivost kalijeva nitrata i bakrova(II) sulfata raste s porastom temperature, dok se topljivost natrijeva klorida slabo mijenja porastom temperature.
Riješite zadatke.
1. Proučite krivulju topljivosti kalijeva sulfata i zaključite kako povišenje temperature utječe na topljivost te tvari?
Topljivost tvari nekada se iskazuje i masom otopljene tvari u 100 g otapala.
Na temelju tabličnih podataka napravite krivulju topljivosti soli u ovisnosti o temperaturi. Pri tome možete koristiti digitalni alat Meta-Chart.
| t/°C | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
|---|---|---|---|---|---|---|---|---|
| litijev sulfat | 35,0 | 32,0 | 30,0 | 29,0 | 28,0 | 27,0 | 26,0 | 25,0 |
| natrijev klorid | 35,7 | 36,0 | 36,4 | 36,7 | 37 | 37,4 | 37,6 | 38,0 |
| modra galica | 18,0 | 20,0 | 24,0 | 28,0 | 35,0 | 42,0 | 50,0 | 59,0 |
2. Pomoću svog prikaza dijagrama topljivosti
odredite o kakvoj se otopini radi (dobro ili slabo topljivoj)
ako je pri temperaturi 40 °C
otopljeno 40 g natrijeva klorida u 100 g vode.
2. Pomoću svog prikaza dijagrama topljivosti odredite o kakvoj se otopini radi, ako je pri temperaturi 40 °C otopljeno 40 g natrijeva klorida u 100 g vode.
Nekim se tvarima topljivost jako povećava
porastom temperature.
Pažljivim postupnim hlađenjem takvih otopina
može se postići da otopina sadrži više otopljene tvari
nego zasićena otopina pri istoj temperaturi.
Takva se otopina naziva prezasićena otopina.
Prezasićena otopina je nestabilna.
Tek slabo protresanje ili dodatak jednog kristala,
dovoljni su da se suvišak otopljene tvari
istaloži u obliku kristala.
Otopina koja tada zaostane iznad kristala
po sastavu je zasićena otopina.
Nekim se tvarima topljivost jako povećava porastom temperature. Pažljivim postupnim hlađenjem takvih otopina može se postići da otopina sadrži više otopljene tvari nego što pri toj temperaturi sadrži zasićena otopina. Takva se otopina naziva prezasićena otopina.
Prezasićena otopina je nestabilna. Tek slabo protresanje ili dodatak jednog kristala, dovoljni su da se suvišak otopljene tvari istaloži u obliku kristala. Otopina koja tada zaostane iznad kristala po sastavu je zasićena otopina.
Topljivost plinova u vodi
Topljivost plinova u vodi ovisi o tlaku i temperaturi.
Plinovi se bolje otapaju pri nižoj temperaturi i višem tlaku.
Topljivost plinova u vodi
Topljivost plinova u vodi ovisi o tlaku i temperaturi. Plinovi se bolje otapaju pri nižoj temperaturi i višem tlaku.
Hladna mora, jezera i rijeke bogatija su kisikom.
Ljeti je u vodama stajaćicama voda uz površinu vrlo topla
s malo otopljenog kisika pa je čest pomor riba.
Objasnite zašto nije uputno akvarij s ribicama držati pokraj izvora topline.

Hladna mora, jezera i rijeke bogatija su kisikom. Ljeti je u vodama stajaćicama voda uz površinu vrlo topla s malo otopljenog kisika pa je čest pomor riba.
Objasnite zašto nije uputno akvarij s ribicama držati pokraj izvora topline.

Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.

Dva su odgovora točna. Prokuhavanjem mineralne vode:
Želite li pokušati ponovo?
Na kraju…
Ako želite saznati više o termalnom onečišćenju vode, riješite zadatak koji slijedi.
Istražite što je termalno onečišćenje vode.
To znači da dolazi do zagrijavanja vode.
Što se desi s količinom kisika u zagrijanoj vodi?
Koje su negativne posljedice za život vodenih organizama
u takvim vodama.
Predložite neke mjere zaštite
kojima se mogu spriječiti neželjene posljedice
termalnog onečišćenja voda.

Termalno onečišćenje voda
Istražite što je termalno onečišćenje vode. Koje su negativne posljedice za život vodenih organizama u takvim vodama. Predložite neke mjere zaštite kojima se mogu spriječiti neželjene posljedice termalnog onečišćenja voda.