Građa elementarnih tvari i kemijskih spojeva
- kemijskim simbolima označiti elementarne tvari
- usporediti značenje pojmova atom i molekula
- razlikovati pojmove koeficijent i indeks
- objasniti kvalitativno i kvantitativno značenje kemijskog simbola
- prikazati molekule elementarnih tvari crtežom i modelom
- usporediti prostornu građu molekula kisika, ozona, sumpora i fosfora
- razlikovati spojeve građene od molekula od ionskih spojeva
- usporediti značenja pojmova ion, kation i anion
- objasniti nastajanje jednostavnijih kationa i aniona
- prikazati spoj kemijskom formulom, crtežom i modelom
- protumačiti značenje pojma formulska jedinka, prepoznati ionski spoj na temelju sastava (metal – nemetal)
- sastaviti empirijsku formulu spoja na temelju naboja zadanih iona.
Uvod
Čiste tvari dijele se na kemijske elemente i spojeve.
Atomi kemijskih elemenata grade spojeve i kemijske elemente.
Elementarne tvari mogu biti građene od istovrsnih atoma ili od molekula.
Molekule elementarnih tvari nastaju povezivanjem dvaju ili više istovrsnih atoma.
Elementarne su tvari i plemeniti plinovi.
Oni su građeni od mnoštva pojedinačnih, slabo povezanih atoma.
Označujemo ih simbolima tih kemijskih elemenata.
Simbolima kemijskih elemenata označujemo također:
– metale i polumetale
– nemetal ugljik.
Oni su građeni od mnoštva povezanih atoma.
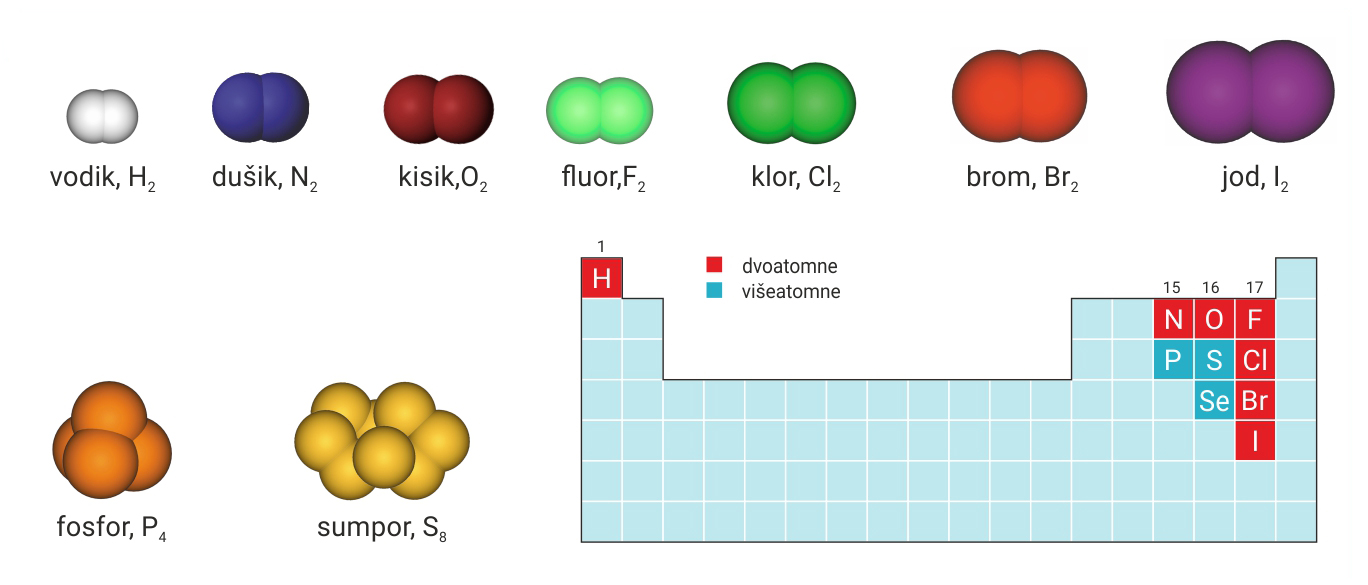
Nemetale izgrađene od molekula označujemo formulom njihovih molekula.
Uvod
Čiste tvari dijele se na elementarne tvari i spojeve. Atomi kemijskih elemenata grade i jedne i druge.
Građa i označivanje elementarnih tvari
Elementarne tvari mogu biti građene od istovrsnih atoma ili od molekula. Molekule elementarnih tvari nastaju povezivanjem dvaju ili više istovrsnih atoma.
Elementarne tvari građene od mnoštva pojedinačnih, slabo povezanih atoma, a to su plemeniti plinovi, označujemo simbolima tih kemijskih elemenata.
Simbolima kemijskih elemenata označujemo također metale i polumetale te nemetal ugljik, koji su građeni od mnoštva čvrsto povezanih atoma.
Nemetale izgrađene od molekula označujemo formulom njihovih molekula.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Masa nekog kemijskog elementa X je 1,98 put veća od mase atoma klora.
a) Izračunajte relativnu atomsku masu atoma X i b) napišite njegov kemijski simbol.
Relativna atomska masa elementa X je:
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
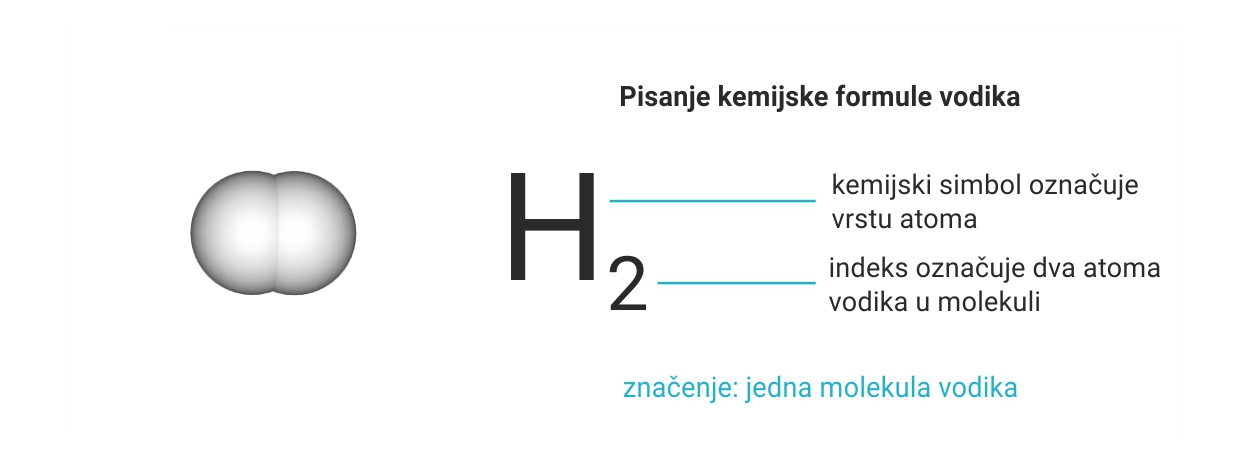
Molekule su samostalne čestice točno određenog sastava.
Njihov sastav prikazuje se kemijskom formulom.
Kemijska formula elemenata izgrađenih od molekula sastoji se od:
– simbola elementa
– donjeg desnog indeksa koji označava broj atoma u molekuli.
Molekule su čestice sastavljene od dvaju ili više atoma. Njihov sastav prikazuje se kemijskom formulom.
Kemijska formula elementarnih tvari izgrađenih od molekula sastoji se od simbola elementa i donjeg desnog indeksa koji označava broj atoma u molekuli.
Dakle, možemo zaključiti:
Simbolima kemijskih elemenata označujemo:
– sve metale
– polumetale.
Nemetale označujemo:
– simbolima kemijskih elemenata (sve plemenite plinove i ugljik)
– kemijskim formulama (nemetale građene od molekula).
Dakle, možemo zaključiti:
Simbolima kemijskih elemenata označujemo sve metale i polumetale, a od nemetala sve plemenite plinove i ugljik.
Kemijskim formulama označujemo sve nemetale građene od molekula.
Građa molekula elementarnih tvari
Za prikazivanje građe tvari kemičari se često koriste modelima.
Modeli atoma su i do nekoliko stotina milijuna puta uvećani prikazi atoma.
Boje modela atoma međunarodno su dogovorene:
vodik – bijela, kisik – crvena, ugljik – crna, dušik – plava, sumpor – žuta, klor – zelena, jod – ljubičasta.
Građa molekula elementarnih tvari
Za prikazivanje građe tvari kemičari se često koriste modelima. Modeli atoma su i do nekoliko stotina milijuna puta uvećani prikazi atoma. Modeli atoma imaju međunarodno dogovorene boje: vodik – bijela, kisik – crvena, ugljik – crna, dušik – plava, sumpor – žuta, klor – zelena, jod – ljubičasta.
Molekula ozona izgrađena je od triju atoma kisika pa je njezina kemijska formula .
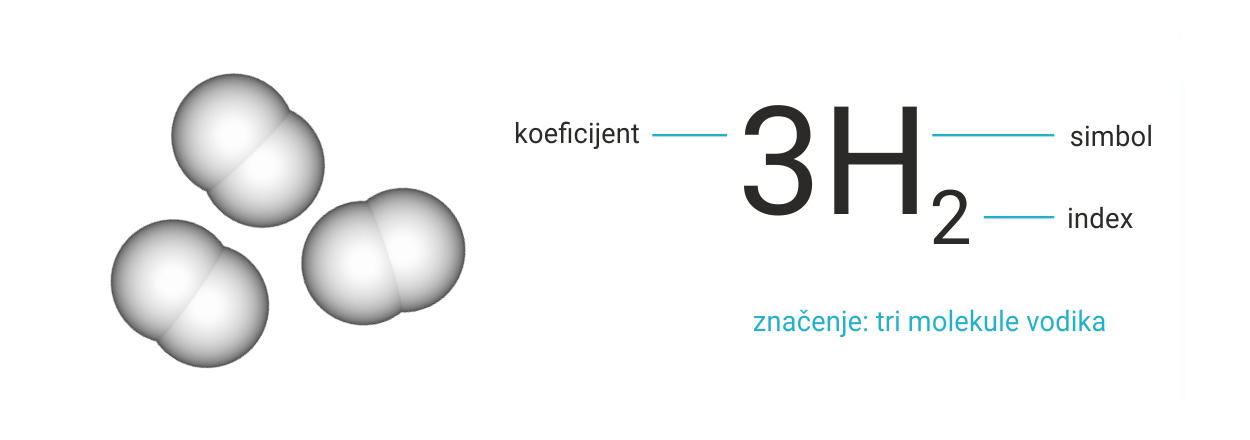
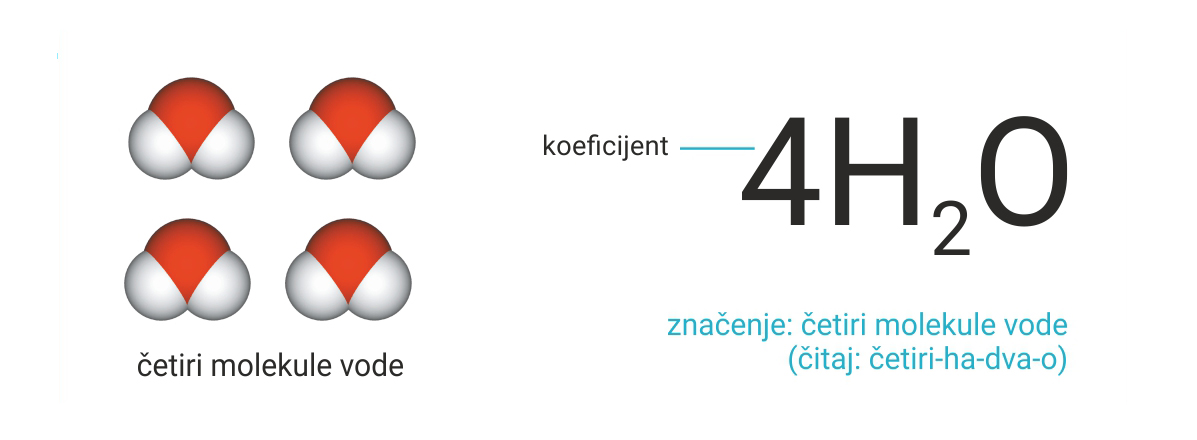
Koeficijentima označujemo veći broj istovrsnih molekula elementarnih tvari.
Taj broj pišemo ispred kemijske formule molekule.
Označivanje više molekula elementarne tvari:
Veći broj istovrsnih molekula elementarnih tvari označujemo koeficijentom. Taj broj pišemo ispred kemijske formule molekule.
Označivanje više molekula elementarne tvari:
Građa i označivanje kemijskih spojeva
Atomi svih elemenata osim plemenitih plinova povezuju se s drugim atomima.
Plemeniti su plinovi stabilni kao pojedinačni samostalni atomi.
Plemeniti plinovi kemijski su inertni (ne ulaze u reakciju s drugim kemijskim elementima).
Plemeniti plinovi u periodnom sustavu elemenata nalaze se u 18. skupini (stupcu).
Atomi svih drugih elemenata povezuju se s drugim atomima.
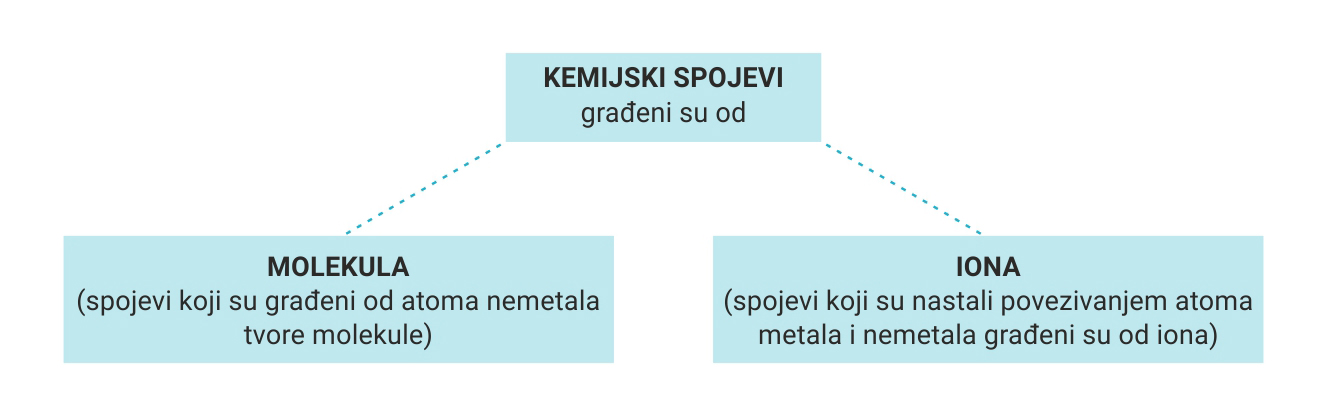
Pri povezivanju atoma nastaju tvari građene od iona ili od molekula.
Građa i označivanje kemijskih spojeva
Atomi svih elemenata osim plemenitih plinova povezuju se s drugim atomima. Plemeniti su plinovi stabilni kao pojedinačni samostalni atomi i kemijski su inertni. U periodnom sustavu elemenata nalaze se u 18. skupini.
Atomi svih drugih elemenata povezuju se s drugim atomima. Pri tom povezivanju nastaju tvari građene od iona ili od molekula.
Molekule kemijskih spojeva građene su od dvaju ili više raznovrsnih atoma nemetala.
Kemijski sastav molekula prikazuje se kemijskom formulom.
Takva se formula naziva molekulska formula
i ona u potpunosti opisuje sastav molekule.
U molekulskoj formuli pojedina se vrsta atoma označuje kemijskim simbolom.
Broj atoma u molekuli označava se kao donji desni indeks uz simbol.
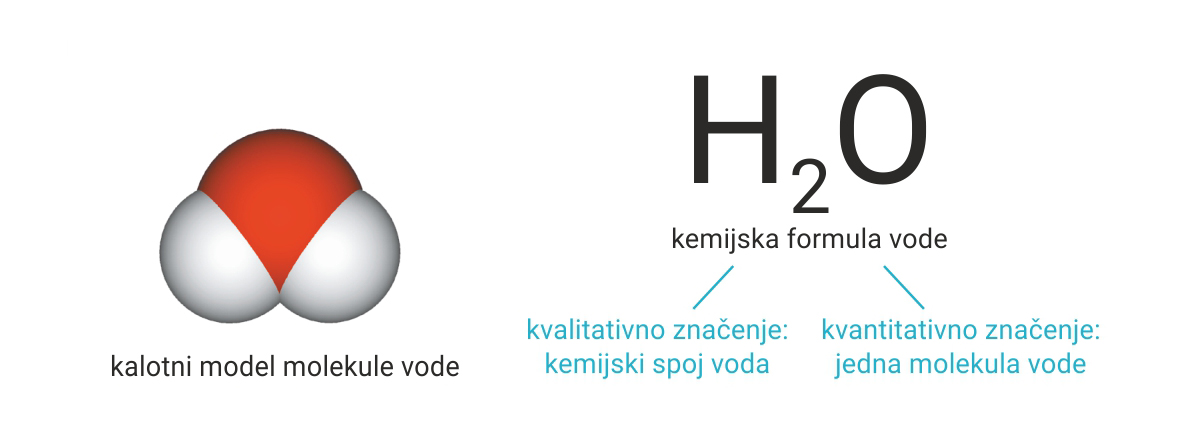
Primjerice, molekula vode građena je od dvaju atoma vodika i jednog atoma kisika.
Uz simbol vodika piše se indeks dva.
Uz simbol kisika nije potreban indeks jedan
jer simbol elementa već predstavlja jedan atom.
Molekule kemijskih spojeva građene su od dvaju ili više raznovrsnih atoma nemetala.
Kemijski sastav molekula prikazuje se kemijskom formulom. Takva se formula naziva molekulska formula i ona u potpunosti opisuje sastav molekule.
U molekulskoj formuli pojedina se vrsta atoma označuje kemijskim simbolom, a broj atoma u molekuli piše se uz simbol kao donji desni indeks.
Primjerice, molekula vode građena je od dvaju atoma vodika i jednog atoma kisika. Uz simbol vodika piše se indeks dva. Uz simbol kisika nije potrebno pisati indeks jedan jer simbol elementa već označava jedan atom.
Kemijske formule imaju kvalitativno i kvantitativno značenje.
Kvalitativno označuju vrstu kemijskog spoja,
a kvantitativno broj molekula tog spoja.
Kemijske formule imaju kvalitativno i kvantitativno značenje. Kvalitativno označuju vrstu kemijskog spoja, a kvantitativno broj molekula tog spoja.
Veći broj istovrsnih molekula kemijskog spoja označuje se koeficijentom
koji se piše ispred molekulske formule.
Veći broj istovrsnih molekula kemijskog spoja označuje se koeficijentom koji se piše ispred molekulske formule.
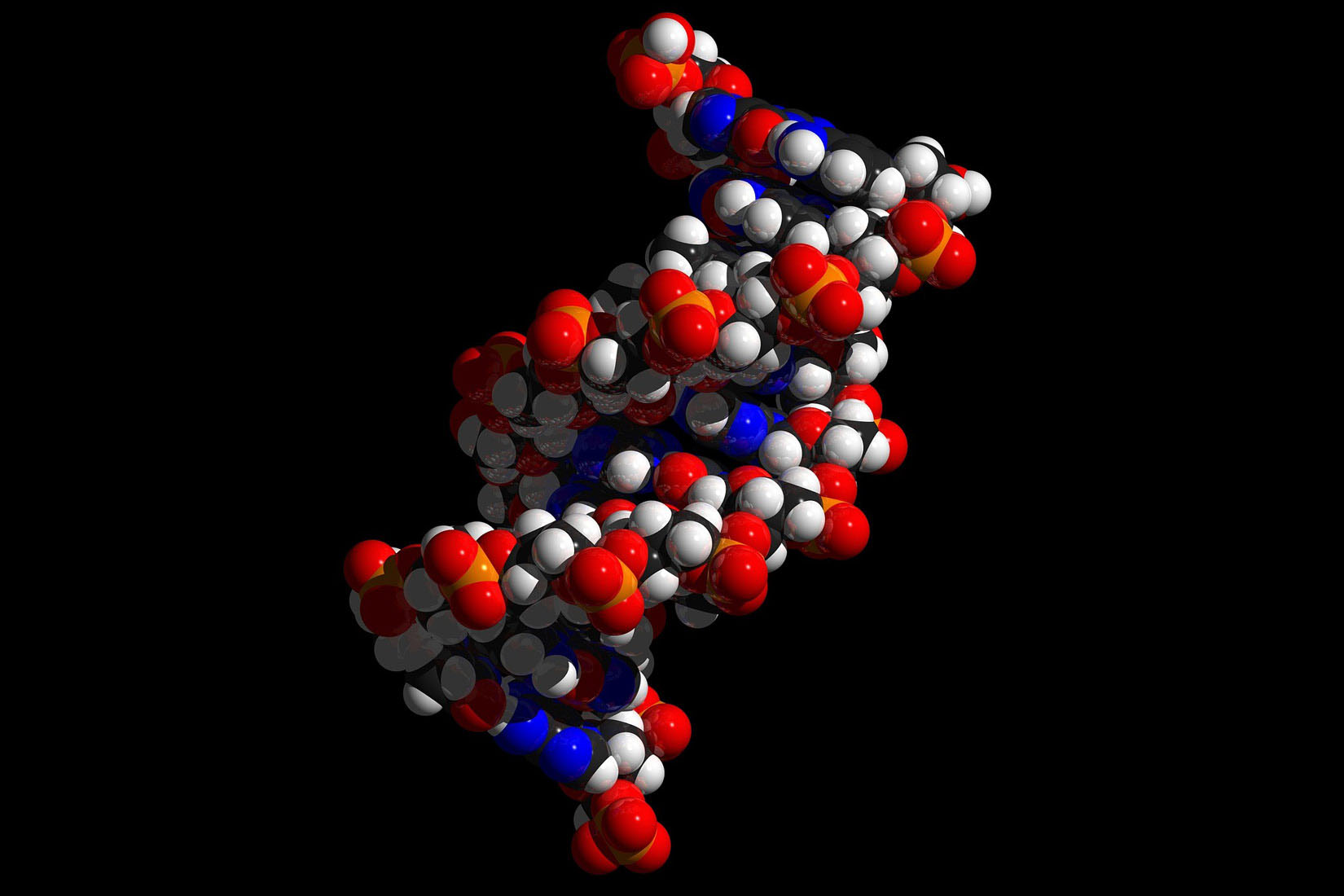
Kako je građena molekula DNK?
Kako je građena molekula DNK?
Molekule građene od više tisuća atoma nazivamo makromolekulama (velikim molekulama).
To su molekule prirodnih spojeva, poput bjelančevina, škroba i celuloze,
ali i molekule umjetno dobivenih spojeva poput plastičnih masa.
Prirodna makromolekula koja izaziva najveće zanimanje znanstvenika
zasigurno je molekula DNK.
To je vrlo složena molekula koja prenosi nasljedne osobine (boja kose, očiju, građa tijela, sklonost nekoj bolesti).
Sastoji se od dvaju povezanih zavojitih lanaca.
Na internetskim stranicama potražite podatke o kemijskom sastavu, građi i svojstvima molekule DNK.
Pokušajte napraviti model DNK koristeći dvije žice i kuglice različitih boja koje prate strukturu DNK.
Koristeći neki od prezentacijskih alata, timski pripremite kratko izlaganje i model DNK.

Kako je građena molekula DNK?
Molekule građene od više tisuća atoma nazivamo makromolekulama. To su molekule prirodnih spojeva poput bjelančevina, škroba i celuloze, ali i molekule umjetno dobivenih spojeva poput plastičnih masa.
Prirodna makromolekula koja izaziva najveće zanimanje znanstvenika zasigurno je molekula DNK. To je vrlo složena molekula nasljeđa, a sastoji se od dvaju povezanih zavojitih lanaca. Na internetskim stranicama potražite podatke o kemijskom sastavu, građi i svojstvima molekule DNK. Koristeći neki od prezentacijskih alata, timski pripremite kratko izlaganje.
Kemijski spojevi građeni od iona
Ioni grade mnoge kemijske spojeve, primjerice soli.
Spojevi građeni od iona nazivaju se ionski spojevi.
Ionski spojevi jesu spojevi metala i nemetala.
Ioni nastaju od atoma otpuštanjem ili primanjem elektrona.
To su stabilne čestice pozitivnog ili negativnog naboja.
Pozitivno nabijeni ioni zovu se kationi.
Negativno nabijeni ioni zovu se anioni.
Naboj iona označuje se kao gornji desni indeks uz simbol elementa.
Kako nastaje kation?
Pozitivno nabijeni ioni nazivaju se kationi.
Kationi nastaju kad atom, npr. nekog metala, otpusti elektrone.
Proučimo građu atoma natrija.
Kemijski spojevi građeni od iona
Ioni su građevne jedinice mnogih kemijskih spojeva, primjerice soli. Spojevi građeni od iona nazivaju se ionski spojevi. Ionski spojevi jesu spojevi metala i nemetala.
Ioni nastaju od atoma, otpuštanjem ili primanjem elektrona. To su stabilne čestice pozitivnog ili negativnog naboja.
Pozitivno nabijeni ioni zovu se kationi. Negativno nabijeni ioni zovu se anioni.
Naboj iona označuje se kao gornji desni indeks uz simbol elementa.
Kako nastaje kation?
Pozitivno nabijeni ioni nazivaju se kationi. Kationi nastaju kada atom, npr. nekog metala, otpusti elektrone.
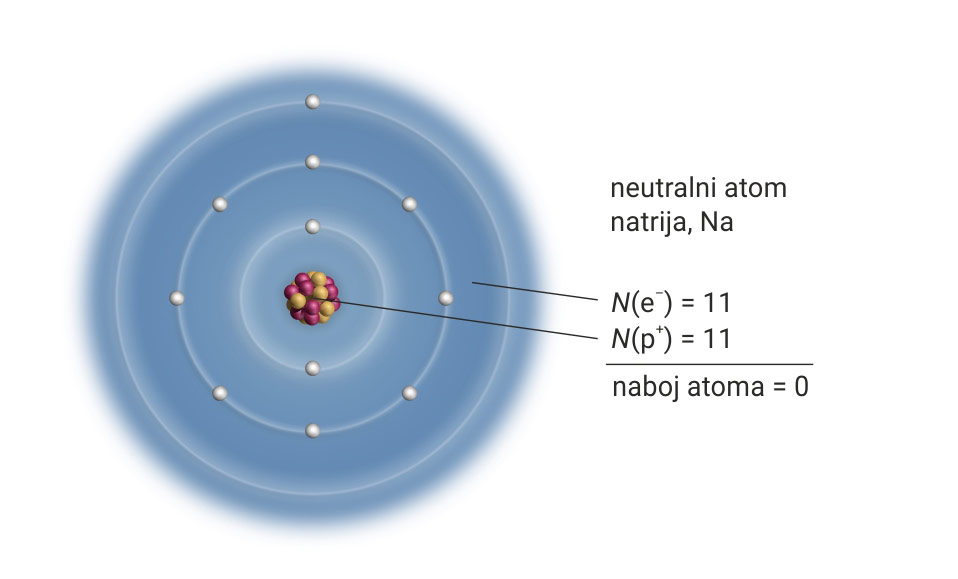
Proučimo građu atoma natrija.
Protonski broj natrija jest 11.
To znači da atom natrija u jezgri ima 11 protona,
a u elektronskom omotaču 11 elektrona.
Proučimo građu iona natrija.
Protonski broj natrija jest 11. To znači da atom natrija u jezgri ima 11 protona, a u elektronskom omotaču 11 elektrona.
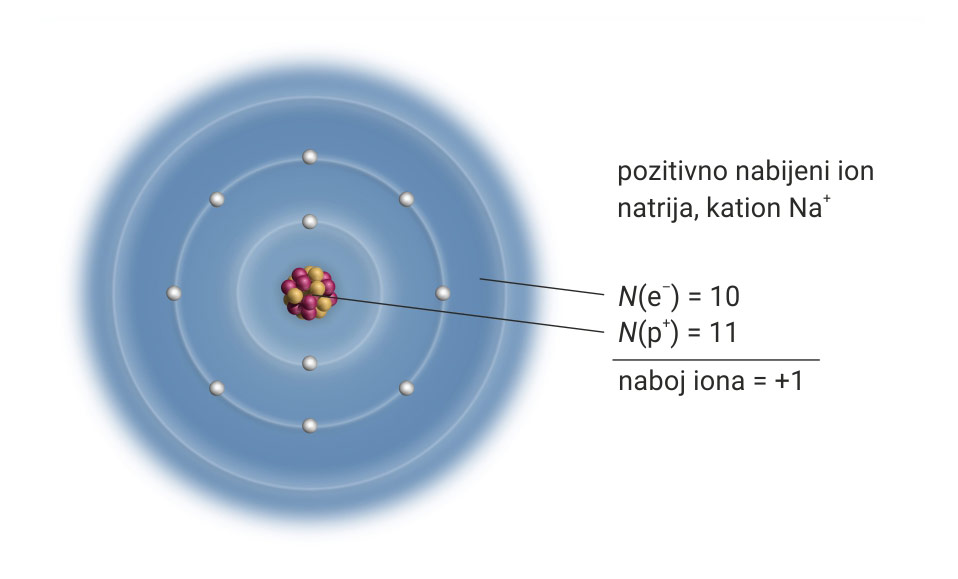
Proučimo građu iona natrija.
Odbaci li atom natrija jedan elektron, u elektronskom omotaču ostaje 10 elektrona. Nastao je pozitivno nabijeni kation natrija, .
Kako nastaju anioni?
Negativno nabijeni ioni nazivaju se anioni.
Anioni nastaju kada atom, primjerice nekog nemetala, primi elektrone.
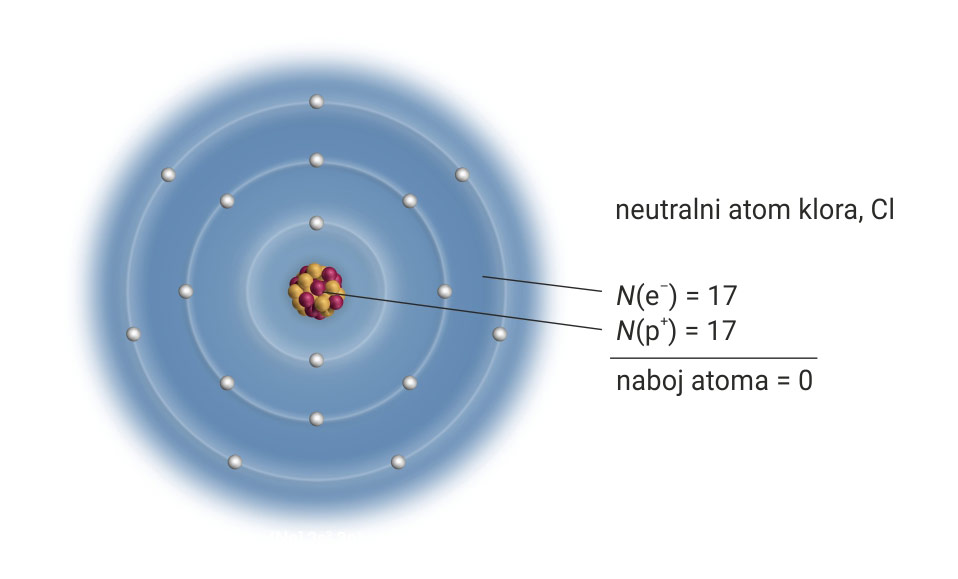
Proučimo građu atoma klora.
Kako nastaju anioni?
Negativno nabijeni ioni nazivaju se anioni. Anioni nastaju kada atom, primjerice, nekog nemetala, primi elektrone.
Proučimo građu atoma klora.
Protonski broj klora jest 17.
To znači da ima 17 protona u jezgri i 17 elektrona u elektronskom omotaču.
Ako taj atom primi jedan elektron, imat će 18 elektrona,
odnosno jedan negativni naboj više.
Nastaje negativno nabijeni ion klora – anion klora, Cl–.
Protonski je broj klora 17. To znači da atom klora ima 17 protona u jezgri i 17 elektrona u elektronskom omotaču. Ako taj atom primi jedan elektron, imat će 18 elektrona, odnosno jedan negativni naboj više. Tako nastaje negativno nabijeni ion klora – anion klora, .
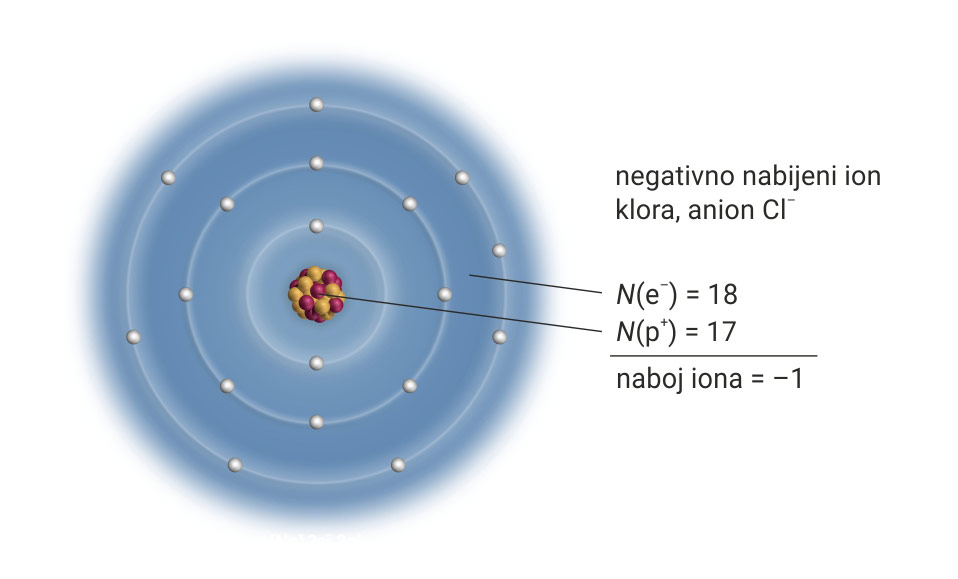
Proučimo građu iona klora.
Neki atomi mogu odbaciti ili primiti više elektrona.
Njihovi ioni imaju više pozitivan ili negativan naboj.
To se prikazuje dodatkom koeficijenta uz naboj u gornjem desnom indeksu.
Neki atomi mogu odbaciti ili primiti više elektrona. Naboj iona prikazuje se kao koeficijent u gornjem desnom indeksu.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kad atom dušika primi tri elektrona nastane:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Tvar Y sastoji se od dvije vrste iona. Kation je građen od jednog atoma dušika i određenog broja atoma vodika. Masa kationa je 18,042 Da, a njegov nabojni broj je 1+. Odredite broj atoma vodika u kationu i odaberite točno napisanu kemijsku oznaku tog kationa.
Želite li pokušati ponovo?
Neki ioni i njihove oznake
| oznaka kationa | N(p+) | N(e–) | naziv kationa | oznaka aniona | N(p+) | N(e–) | naziv aniona |
|---|---|---|---|---|---|---|---|
| K+ | 19 | 18 | kalijev ion | Br– | 35 | 36 | bromidni ion |
| Ca2+ | 20 | 18 | kalcijev ion |
S2– | 16 | 18 | sulfidni ion |
| Al3+ | 13 | 10 | aluminijev ion |
N3– | 7 | 10 | nitridni ion |
Neki ioni i njihove oznake
| oznaka kationa |
ime kationa |
oznaka aniona |
ime aniona |
||||
|---|---|---|---|---|---|---|---|
| 19 | 18 | kalijev ion | 35 | 36 | bromidni ion |
||
| 20 | 18 | kalcijev ion |
16 | 18 | sulfidni ion |
||
| 13 | 10 | aluminijev ion |
7 | 10 | nitridni ion |
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Kemijskim oznakama iona u lijevom stupcu, pridružite odgovarajući naziv.
jodidni ion
aluminijev ion
oksidni ion
sulfidni ion
Želite li pokušati ponovo?
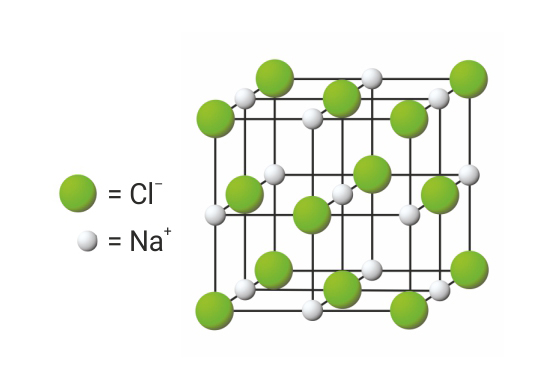
Svaki ion privlači ione suprotnog naboja, a odbija ione istog naboja.
Među ionima suprotnog naboja djeluju jake privlačne sile.
Gustim slaganjem iona nastaju kristali ionskog spoja.
U ionskim kristalima svaki je kation okružen anionima i obrnuto.
Sastav ionskog spoja prikazuje se simboličkim zapisom koji nazivamo formulska jedinka.
Formulska jedinka pokazuje i najmanji omjer broja kationa i aniona u tom spoju.
Svaki ion privlači ione suprotnog naboja, a odbija ione istog naboja. Među ionima suprotnog naboja djeluju jake privlačne sile. Gustim slaganjem iona nastaju kristali ionskog spoja. U ionskim kristalima svaki je kation okružen anionima i obrnuto.
Sastav ionskog spoja prikazuje se simboličkim zapisom koji nazivamo formulska jedinka. Osim sastava, formulska jedinka prikazuje najmanji brojčani omjer kationa i aniona u ionskom spoju.
Formulska jedinka simbolički je zapis (formula) koja pokazuje sastav ionskog spoja i najmanji omjer broja kationa i aniona u tom spoju.
Zbroj pozitivnih i negativnih naboja u ionskim spojevima uvijek je jednak nuli pa su kristali u cjelini električki neutralni.
| ioni koji grade kristal | najmanji brojčani omjer iona u kristalu | formulska jedinka spoja | čitanje kemijske formule |
|---|---|---|---|
| i | EN-A-CE-EL | ||
| i | KA-DVA-ES | ||
| i | A-EL-BE-ER-TRI | ||
| i | EF-E-DVA-O-TRI |
Na kraju…
Riješite interaktivni kviz!
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Povežite kemijsku formulu spoja s njezinim kvalitativnim značenjem.
voda
kalcijev bromid
amonijak
kalijev bromid
ugljikov(IV) oksid
klorovodik
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja tvrdnja opisuje nastajanje kationa?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Informacije o čestičnoj građi tvari možete pronaći u jedinici 1.7 Građa tvari u DOS-u Fizika 7.