Valencije i kemijske formule
- objasniti značenje pojma valencija atoma i pojma valencija iona u spoju
- izraziti valencije elemenata u spoju na temelju poznate formule jednostavnih spojeva
- izraziti formulu nekog spoja na temelju poznatih valencija elemenata
- povezati valenciju elementa u spoju s njegovim položajem u periodnom sustavu elemenata
- imenovati spoj na temelju kemijske formule
- izraziti kemijsku formulu na temelju kemijskog naziva tvari
- odrediti kvalitativno i kvantitativno značenje kemijske formule spoja.
Uvod
Atomi različitih elementa razlikuju se po građi i svojstvima.
Jedno od svojstava jest sposobnost vezivanja različitih atoma
pri čemu nastaju kemijski spojevi.
Svojstvo atoma da se veže s točno određenim brojem atoma drugog elementa
naziva se valencija.
Valencije elemenata označuju se rimskim brojem.
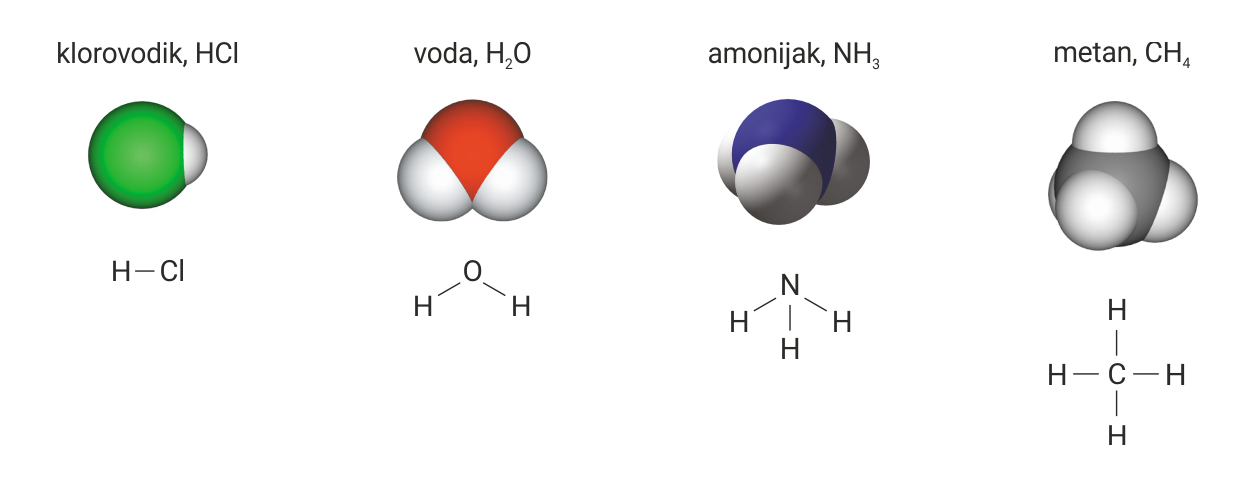
Promotrimo modele i kemijske formule klorovodika, vode, amonijaka i metana.
Za prikazivanje građe molekula koristit ćemo kemijske simbole s valentnim crticama.
Jedna valentna crtica prikazuje jednu valenciju, odnosno jednostruku kemijsku vezu.
Na taj se način mogu prikazati samo molekule spojeva,
ne i struktura ionskih tvari (ionski spojevi).
Uvod
Atomi različitih elementa razlikuju se po građi i svojstvima. Jedno od svojstava jest sposobnost vezivanja različitih atoma pri čemu nastaju kemijski spojevi.
Svojstvo atoma da se veže s točno određenim brojem atoma drugog elementa naziva se valencija.
Valencije elemenata označuju se rimskim brojem.
Promotrimo modele i kemijske formule primjerice klorovodika, vode, amonijaka i metana.
Za prikazivanje građe molekula koristit ćemo kemijske simbole s valentnim crticama. Jedna valentna crtica prikazuje jednu valenciju odnosno jednostruku kemijsku vezu. Na taj se način mogu prikazati samo molekule spojeva, ne i ionske tvari.
Na prikazanim molekulama lako je uočiti da se pojedini atomi vodika
vežu samo s jednim atomom drugog elementa.
Zato je vodik jednovalentan.
U molekuli klorovodika, , atom klora vezan je sa samo jednim atomom vodika.
Zato je klor jednovalentan.
U molekuli vode, , atom kisika veže se s dva atoma vodika
pa je atom kisik dvovalentan.
U molekuli amonijaka, , atom dušika veže se s tri atoma vodika
pa je atom dušika trovalentan.
U molekuli metana, , atom ugljika vezan je s četiri atoma vodika
pa je atom ugljika četverovalentan.
Atom vodika uvijek je jednovalentan.
Valenciju nekog elementa određujemo prema tome
s koliko se atoma vodika mogu vezati njegovi atomi.
U spojevima koji su građeni od dvaju elemenata
možemo odrediti valenciju atoma jednog elementa
ako nam je poznata valencija drugog elementa u spoju.
Neki atomi uvijek imaju istu valenciju,
bez obzira s kojim se drugim atomima spajaju.
Pored vodika koji je uvijek jednovalentan,
jednovalentni su i metali prve skupine elemenata poput natrija.
Metali druge skupine elemenata su uvijek dvovalentni.
Kisik je dvovalentan u većini svojih spojeva.
Međutim, postoje elementi čiji atomi u spojevima mogu imati različite valencije.
Na prikazanim molekulama lako je uočiti da se svaki atom vodika veže samo s jednim atomom drugog elementa, stoga je vodik jednovalentan.
U molekuli korovodika, , atom klora vezan je sa samo jednim atomom vodika pa je klor jednovalentan.
U molekuli vode, , atom kisika veže se s dvama atomima vodika pa je atom kisika dvovalentan.
U molekuli amonijaka, , atom dušika veže se s trima atomima vodika pa je atom dušika trovalentan.
U molekuli metana, , atom ugljika vezan je s četirima atomima vodika pa je atom ugljika četverovalentan.
Atom vodika uvijek je jednovalentan. U našim primjerima valenciju nekog elementa odredili smo prema tome s koliko se atoma vodika vezao njegov atom. Valencija označuje broj veza koje neki atom može ostvariti.
U spojevima koji su građeni od dvaju elemenata možemo odrediti valenciju atoma jednog elementa ako nam je poznata valencija drugog elementa u spoju.
Neki atomi imaju samo jednu valenciju, bez obzira na to s kojim se drugim atomima spajaju. Pored vodika koji je uvijek jednovalentan, jednovalentni su i metali prve skupine elemenata poput natrija.
Metali druge skupine elemenata uvijek su dvovalentni, slično kao i kisik koji je dvovalentan u većini svojih spojeva.
Međutim, ima elemenata čiji atomi u spojevima mogu imati različite valencije.
| simboli elemenata | valencije elemenata | simboli elemenata | valencije elemenata |
|---|---|---|---|
| H, Na, K, F | I | Fe | II, III |
| Cu, Hg | I, II | C, Pb | II, IV |
| Au | I, III | S | II, IV, VI |
| Cl, Br, I | I, V, VII | Al | III |
| Mg, Ca, Zn, O | II | N, P | III, V |
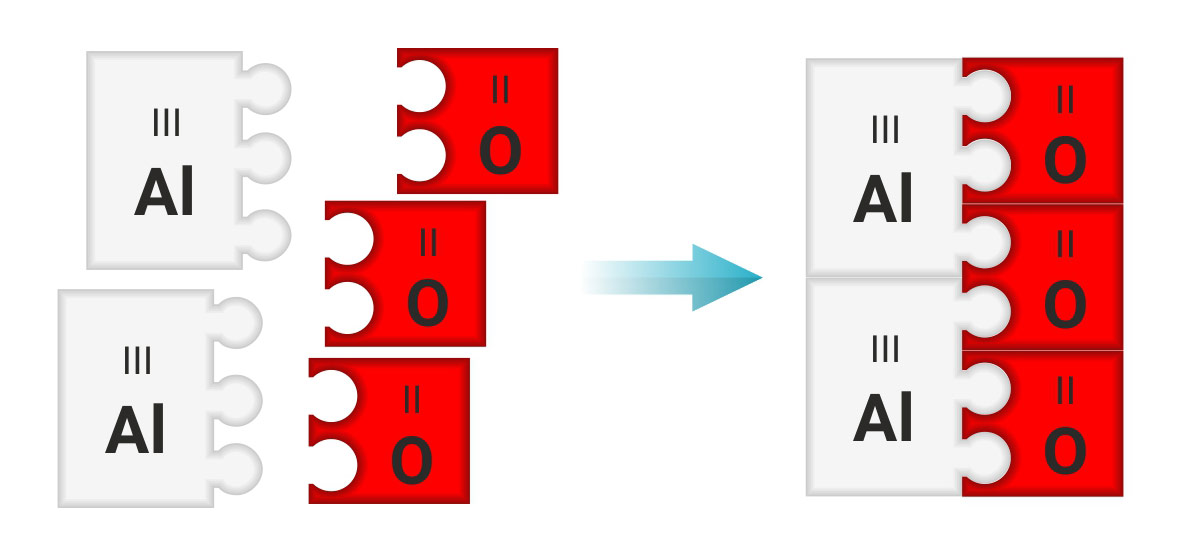
Sastavljanje formula spojeva na temelju valencija elemenata
| naziv spoja | aluminijev oksid | |
|---|---|---|
| simboli elemenata u spoju | ||
| valencije atoma u spoju | ||
| najmanji zajednički višekratnik valencija atoma aluminija i kisika | ||
| broj atoma aluminija i kisika s jednakim zbrojem valencija | ||
| omjer broja atoma aluminija i kisika | ||
| formula spoja | ||
Kako odrediti valencije atoma u spoju koji ne sadržava vodik?
Odredi valencije elemenata u spoju P4O10.
Treba odrediti valenciju fosfora znajući da je kisik u spojevima dvovalentan.
Valenciju fosfora u tom spoju odredit ćemo tako da najprije izračunamo zbroj svih atoma kisika u molekuli P4O10.
U formuli spoja koji se sastoji od dvaju elemenata
zbroj valencija atoma jednog elementa mora biti jednak zbroju valencija atoma drugog elementa.
Zbroj valencija atoma kisika (O) = Zbroj valencija atoma fosfora (P).
Zbroj valencija atoma kisika:
II (valencija) kisika ? 10 atoma kisika
Zbroj valencija atoma kisika = 20 valencija atoma kisika
Valencija (P) fosfora = ?
Valencija O (kisika) = II (dva)
Zna se: broj atoma P (fosfora)= 4
Traži se: valencija P (fosfora)
20 valencija atoma kisika = valencija P ? 4 atoma P
Vrijednost svih valencija atoma kisika (20) u molekuli P4O10 podijelimo brojem atoma fosfora u molekuli (4).
Valencija P = 20 : 4
Valencija P = 5 (V)
U danom oksidu fosfor je peterovalentan.
Kako odrediti valencije atoma u spoju koji ne sadržava vodik?
- Odredimo valencije elemenata u spoju , .
- Treba odrediti valenciju fosfora znajući da je kisik u spojevima dvovalentan.
- Valenciju fosfora u tom spoju odredit ćemo tako da najprije izračunamo zbroj svih atoma kisika u molekuli, , a nakon toga tu vrijednost podijelimo brojem atoma fosfora u molekuli.
- U danom oksidu fosfor je peterovalentan.
| zadana formula spoja | ||
|---|---|---|
| atom elementa čiju valenciju znamo | kisik (II) | II P4O10 |
| broj kisikovih atoma i zbroj valencija svih kisikovih atoma |
II · 10 = 20 | |
| broj fosforovih atoma | ||
| valencija fosforovih atoma u zadanom spoju | 20 : 4 = 5 | V II P4O10 |
| naziv spoja | fosforov(V) oksid | |
Nazivi kemijskih spojeva
Nazivi mnogih spojeva potječu iz vremena prije otkrića sastava tih spojeva.
Takvi su spojevi zadržali svoje nazive.
Na primjer, kuhinjska sol, amonijak, soda i sl.
Nazivi ostalih spojeva sustavno se izvode na temelju njihova kemijskog sastava.
Tako se primjerice spojevi elementa s kisikom nazivaju oksidi,
a spojevi metala s klorom kloridi.
| elementi koji grade spoj | opći naziv spoja | valencija nemetala u spoju |
|---|---|---|
| metal + klor | klorid | I |
| metal + brom | bromid | I |
| metal + jod | jodid | I |
| metal +kisik | oksid | II |
| metal + sumpor | sulfid | II |
| metal + dušik | nitrid | III |
Ako neki element tvori spojeve u kojima ima različitu valenciju,
tada se u nazivu tih spojeva mora naznačiti i njihova valencija.
U nazivu spoja valenciju označujemo rimskim brojem u zagradi
koji se piše iza posvojnog pridjeva imena tog elementa.
Nazivi kemijskih spojeva
Nazivi mnogih spojeva potječu iz vremena prije otkrića sastava tih spojeva. Takvi su spojevi zadržali svoje nazive, npr. kuhinjska sol, amonijak, soda i sl.
Nazivih ostalih spojeva sustavno se izvode na temelju njihova kemijskog sastava. Tako se primjerice spojevi elementa s kisikom nazivaju oksidi, a spojevi metala s klorom kloridi.
| elementi koji grade spoj | opći naziv spoja | valencija nemetala u spoju |
|---|---|---|
| metal + klor | klorid | I |
| metal + brom | bromid | I |
| metal + jod | jodid | I |
| metal + kisik | oksid | II |
| metal + sumpor | sulfid | II |
| metal + dušik | nitrid | III |
Ako neki element tvori spojeve u kojima ima različitu valenciju, tada se u nazivu tih spojeva mora naznačiti i njihova valencija. U nazivu spoja valenciju označujemo rimskim brojem u zagradi koji se piše iza posvojnog pridjeva imena tog elementa.
| formula spoja | valencija elementa | naziv spoja |
|---|---|---|
| dušik (III) kisik (II) | dušikov(III) oksid | |
| dušik (V) kisik (II) | dušikov(V) oksid | |
| ugljik (II) kisik (II) | ugljikov(II) oksid ili ugljikov monoksid | |
| ugljik (IV) kisik (II) | ugljikov(IV) oksid ili ugljikov dioksid | |
| sumpor (IV) kisik (II) | sumporov(IV) oksid ili sumporov dioksid | |
| sumpor (VI) kisik (II) | sumporov (VI) oksid ili sumporov trioksid |
Na kraju…
U tablicu upišite kemijske formule spojeva.
Kod sastavljanja formule koristite metodu najmanjeg zajedničkog višekratnika.
Elementi u spoju:
ugljik () valencija IV
kisik () valencija II
Najmanji zajednički višekratinik za II i IV jest 4.
.
Kemijska formula spoja je CO2.
Elementi u spoju:
srebro (Ag) valencija I
klor (Cl) valencija I
Najmanji zajednički višekratnik za I jest 1.
Broj atoma srebra (Ag) i klora (Cl ) isti je (1).
Kemijska formula spoja glasi AgCl.
Na isti način nađite najmanje zajedničke višekratnike valencija elemenata
i izračunajte broj atoma elemenata u spoju.
Zatim zapišite kemijsku formulu spoja.
Simbole elemenata pronađite u PSE-u (periodnom sustavu elemenata).