Molekulski i atomski kristali
- povezati strukturu molekulskih i atomskih kristala sa svojstvima tvari
Uvod
Snježne pahulje imaju kristalnu strukturu heksagonske prizme.
Specifičan su oblik leda koji nastaje u oblacima.
Kada je temperatura 0°C ili niža, voda prelazi iz tekuće faze u čvrstu.
Na stvaranje pahulja utječu i vlažnost, zračne struje,zrnca prašine
koja mogu utjecati na povećanje mase pahuljica.
Oblik kristalića je različit pri različitim temperaturama.
Na temperaturama od 0 °C do –4 °C pahuljice
imaju oblik šesterokutnih plošnih kristalića.
Na temperaturi od –4 °C do –6 °C, kristalići su igličasti.
Uvod
Snježne pahulje imaju kristalnu strukturu uvijek u obliku heksagonske prizme.
Specifičan su oblik leda koji nastaje u oblacima. Kada je temperatura 0 °C ili niža, voda prelazi iz tekuće faze u čvrstu. Na stvaranje pahulja osim temperature utječu i vlažnost, zračne struje, ali i zrnca prašine koja mogu utjecati na povećanje mase pahuljica.
Oblik kristalića je različit pri različitim temperaturama. Na temperaturama od 0 °C do –4 °C pahuljice imaju oblik šesterokutnih plošnih kristalića, a od –4 °C do –6 °C kristalići su igličasti.
Zašto snijeg pucketa (škripi) kad hodamo po njemu?
Između kristalića nalaze se praznine ispunjene zrakom.
Prilikom padanja snijega zrak ostaje zarobljen unutar kristalića.
Hodamo li po netaknutom snijegu njegov se sloj stanji.
Tada se čuje pucketanje (škripa) jer dolazi do loma
ledenih kristalića kroz koje izlazi zrak.
Molekulski kristali
Molekulski su kristali građeni od molekula.
Između molekula djeluju različite međumolekulske reakcije.
Djeluju van der Waalsove i Londonove sile te vodikove veze.
Zašto snijeg pucketa (škripi) kad hodamo po njemu?
Između kristalića leda nalaze se praznine ispunjene zrakom. Prilikom padanja snijega zrak ostaje zarobljen unutar kristalića. Hodamo li po netaknutom snijegu njegov se sloj stanji, pri tome se čuje pucketanje (škripa) jer dolazi do loma ledenih kristalića kroz koje izlazi zrak.
Molekulski kristali
Molekulski su kristali građeni od molekula između kojih djeluju različite međumolekulske interakcije. Primjerice, van der Waalsove i Londonove sile te vodikove veze.
Svojstva molekulskih kristala:
- nisko talište i vrelište zbog slabih van der Waalsovih sila između molekula
- dobro topljivi u organskim otapalima, a netopljivi ili slabo topljivi u vodi
- ne provode električnu struju budući da nemaju ni slobodnih iona, ni slobodnih elektrona.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Atomski kristali
Atomski su kristali građeni od atoma međusobno povezanih jakim kovalentnim vezama.
Svojstva atomskih kristala:
● visoko talište i vrelište
● netopljivi u vodi
● velika tvrdoća
Najpoznatiji atomski kristali su dijamant i grafit, alotropske modifikacije ugljika. Različita svojstva dijamanta i grafita su posljedica različitog prostornog rasporeda atoma ugljika.
| DIJAMANT | GRAFIT |
|---|---|
 |
 |
| U kristalnoj strukturi dijamanta svaki atom ugljika povezan je s još četiri atoma, gradeći tetraedar u čijem je središtu taj atom.
Tetraedarski raspored atoma ugljika se ponavlja veliki broj puta u prostoru tako da se dobije ogromna molekula izgrađena od velikog broja atoma ugljika. |
Kristalna struktura grafita sastoji se od slojeva šesteročlanih prstenova koje čine atomi ugljika.
Unutar šesteročlanih prstenova atomi su povezani jakim kovalentnim vezama, dok su između paralelnih slojeva te veze mnogo slabije, tako da, pod djelovanjem sile, slojevi mogu klizati jedan preko drugog. Između slojeva nalaze se slobodni elektroni. |
| Veze između atoma su kovalentne i izuzetno jake. | |
Zbog jakih kovalentnih veza između atoma ugljika dijamant ima:
|
Zbog slabih veza između paralelnih slojeva atoma ugljika povezanih u šesteročlane prstenove i mogućnosti da klize jedan preko drugog, grafit ima svojstvo da:
|

Fuleren
Fuleren je tvar sastavljena
od molekula, , građenih od po 60 atoma ugljika.
Svaka molekula fulerena podsjeća na
poznatu nogometnu loptu „buba maru“.
Ta nogometna lopta je sastavljena od 12 peterokuta i 20 šesterokuta.
Prvi se puta pojavila na
Europskom nogometnom prvenstvu 1968. godine.

Fuleren
Fuleren je tvar sastavljena od molekula, . Svaka molekula fulerena ima 60 atoma ugljika. Molekula fulerena podsjeća na poznatu nogometnu loptu „buba maru“ sastavljenu od 12 peterokuta i 20 šesterokuta, koja se prvi puta pojavila na Europskom nogometnom prvenstvu 1968. godine.
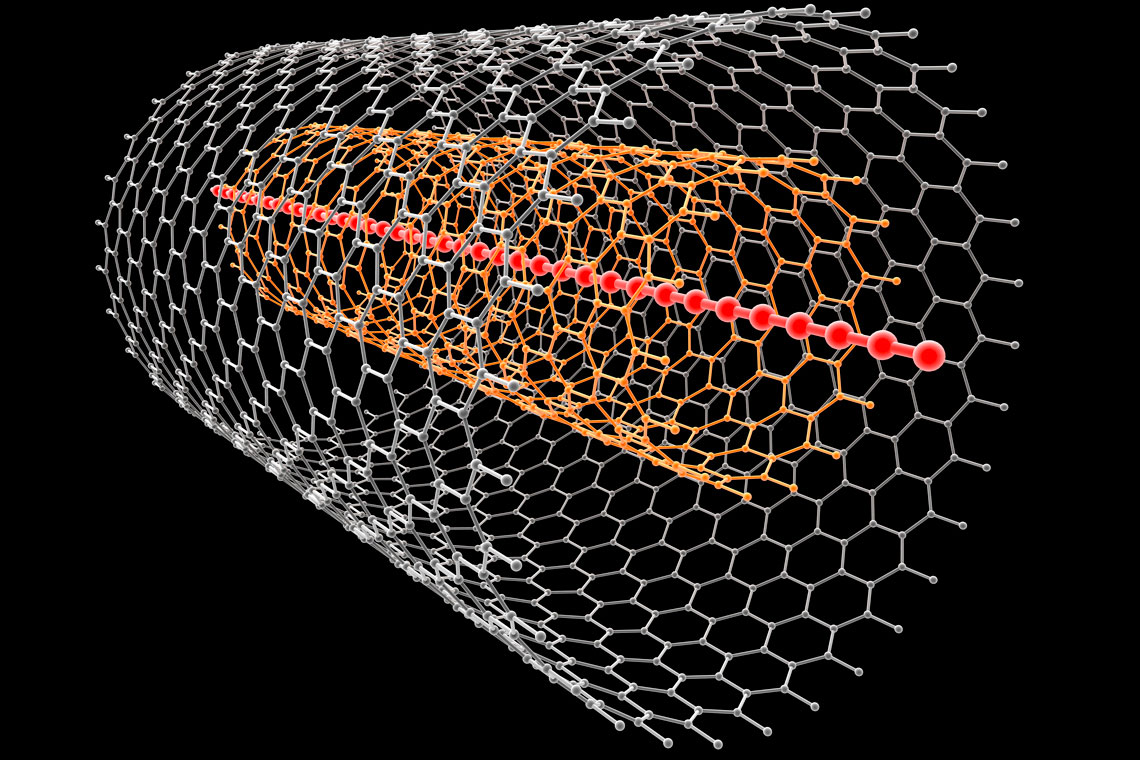
Jesu li ugljikove nanocijevčice materijali budućnosti?
Atomi ugljika imaju mogućnost
međusobnog povezivanja na različite načine.
To rezultira različitim oblicima elementarnih tvari.
Neke od tih tvari su grafit, dijamant i fuleren.
Navedenim alotropskim modifikacijama pridružena je
1991. godine još jedna.
To su ugljikove nanocijevi.
Japanski je znanstvenik Sumio Iijima je istraživao uzorak čađe elektronskim mikroskopom.
Tom prilikom je uočio nove strukture
povezanih ugljikovih atoma, slične grafenu.
Imale su oblik cijevi promjera od nekoliko nanometara.
Nazvao ih je ugljikovim nanocijevima (UNC).
Atomi ugljika imaju mogućnost međusobnog povezivanja na različite načine što rezultira različitim oblicima elementarnih tvari, kao što su grafit, dijamant i fuleren. Navedenim alotropskim modifikacijama pridružena je 1991. godine još jedna. To su ugljikove nanocijevi.
Istražujući uzorak čađe elektronskim mikroskopom, japanski je znanstvenik Sumio Iijima, uočio nove strukture povezanih ugljikovih atoma, slične grafenu. S obzirom da su imale oblik cijevi, promjera od nekoliko nanometara, nazvao ih je ugljikovim nanocijevima (UNC).
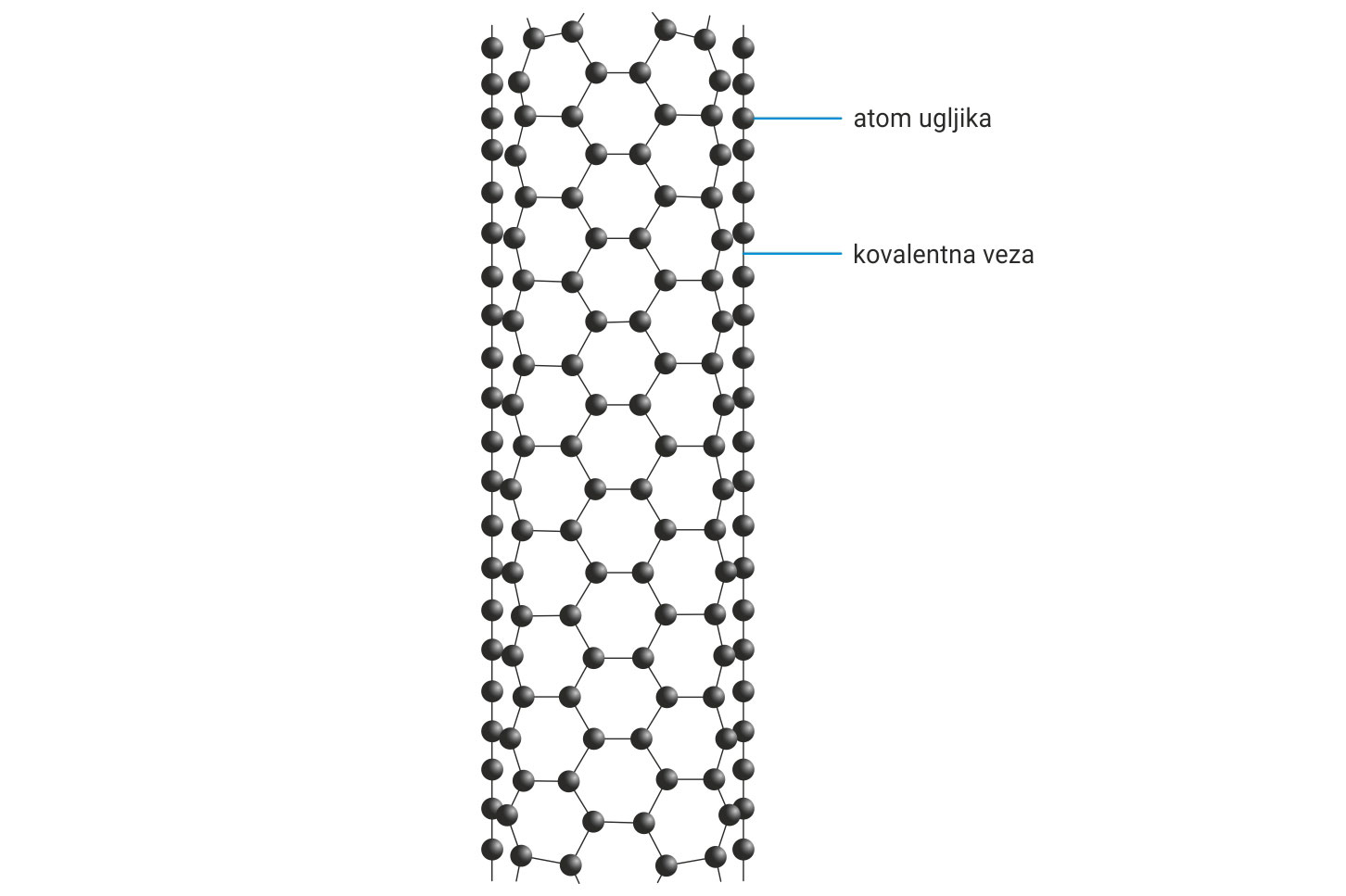
Grafen ima dvodimenzionalnu kristalnu strukturu.
U toj strukturi su atomi ugljika položeni u ravninu.
Svaki sloj izgrađen je od heksagonalnih prstenova.
Nanocjevi se mogu zamisliti kao
sloj grafena oblikovan kao cijev ili cilindar.
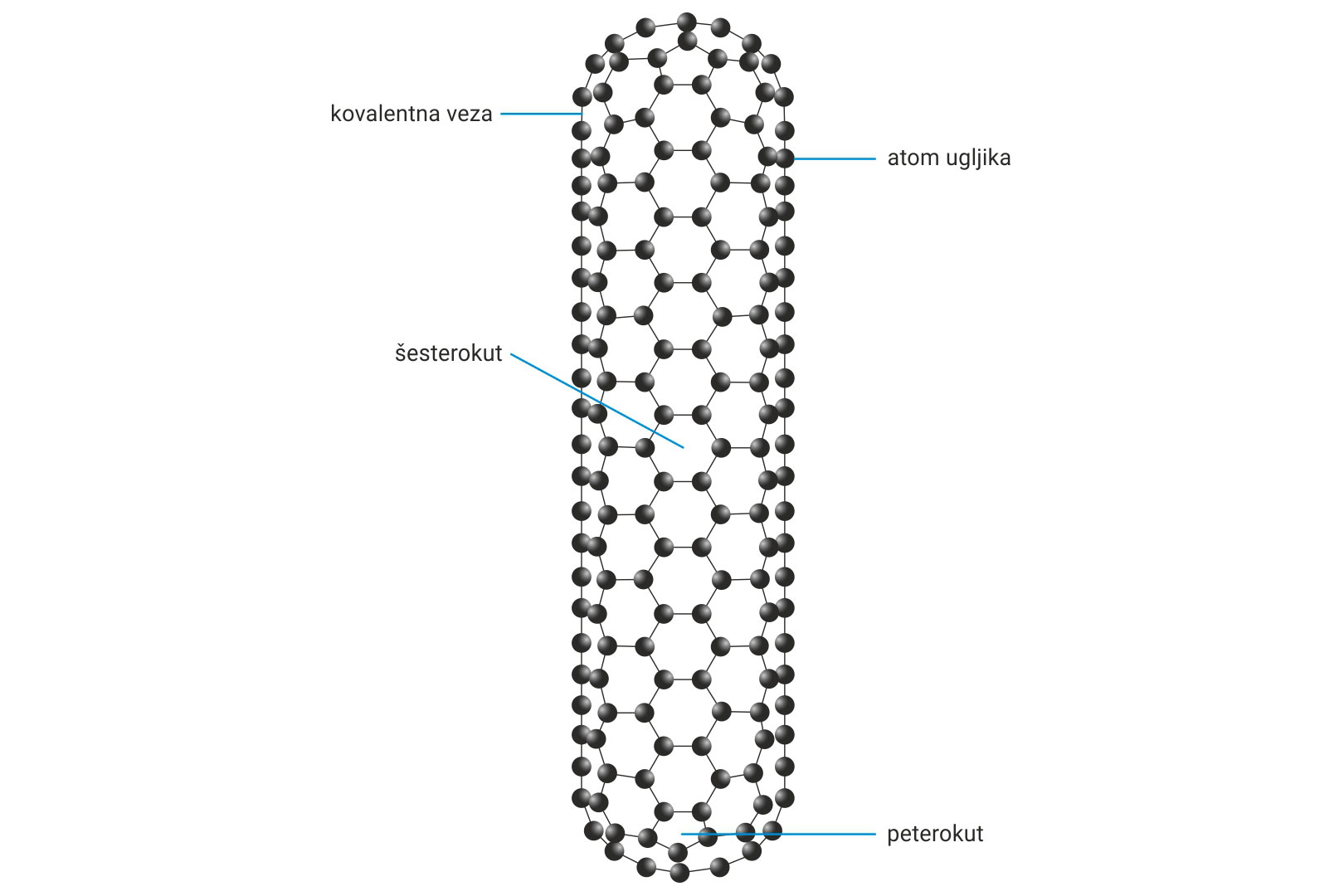
Krajevi cijevi mogu biti pentagonskim prstenovima
zatvoreni ili zaobljeni, slično fulerenu.
Dobivaju se u laboratorijima
isparavanjem ugljikovodika (metana ili etana)uz visoku temperaturu.
Za dobivanje nanocijevi potrebni su različiti katalizatori poput
željeza, nikla, kobalta ili volframovog () i molidbenog () karbida.
Katalizator razgrađuje ugljikovodične molekule do ugljikovih atoma.
On olakšava umetanje atoma u rastuću nanocijev ili cilindar.
Katalizatori različito utječu na nastajanje
specifičnih struktura i brzinu rasta nanocijevi.
Predmet su stalnog proučavanja.
Za zagrijavanje i isparavanje ugljika koriste se laseri.
Ti laseri su usmjereni i omogućavaju kontrolu temperature
i vremena rasta nanocijevi te pretvorbu i do 70 % ugljika u ugljikove nanocijevi.
Grafen ima dvodimenzionalnu kristalnu strukturu u kojoj su atomi ugljika položeni u ravninu. Svaki sloj izgrađen je od heksagonalnih prstenova. Nanocjevi se mogu zamisliti kao sloj grafena oblikovan kao cijev ili cilindar. Krajevi cijevi mogu biti pentagonskim prstenovima zatvoreni ili zaobljeni, slično fulerenu. Dobivaju se u laboratorijima isparavanjem ugljikovodika (metana ili etana) uz visoku temperaturu i različite katalizatore poput željeza, nikla, kobalta ili volframovog () i molidbenog () karbida.
Katalizator razgrađuje ugljikovodične molekule do ugljikovih atoma i olakšava umetanje atoma u rastuću nanocijev ili cilindar. Katalizatori različito utječu na nastajanje specifičnih struktura i brzinu rasta nanocijevi i predmet su stalnog proučavanja. Za zagrijavanje i isparavanje ugljika koriste se i moćni, usmjereni laseri koji omogućavaju kontrolu temperature i vremena rasta nanocijevi te pretvorbu i do 70 % ugljika u ugljikove nanocijevi.
Ugljikove nanocijevi se razlikuju po dužini, debljini i broju slojeva.
Razlikujemo cilindre koji se mogu sastojati od
jednog sloja ili više slojeva grafena.
Duljina višeslojnih cilindara je nekoliko stotina nanometara,
a promjer oko 1 nm.
Kada bi stavili duljinu cilindara u omjer prema vašoj kosi,
jedna vlas imala bi duljinu od 40 metara.
Ugljikove nanocijevi su vrlo lagane i pripadaju svijetu nanočestica.
Ipak, odlikuju se velikom čvrstoćom.
Prema znanstvenim istraživanjima,
ugljikove nanocijevi će uskoro istisnuti silicij.
Silicij je danas osnova računalnog čipa.
Prijenosna računala i pametni telefoni bit će
sve jači, brži, tanji i lakši.
Baterije će duže trajati, bežična komunikacija će bit sve brža.
Bit će brža i obrada podataka.
Ugljikove nanocijevi koriste se za izradu odjeće i sportske opreme.
Jedna od najčešćih uporaba je u strukturnom pojačanju različitih materijala.
Visoka čvrstoća, mala težina, izvanredna toplinska vodljivost,
mehanička i električna svojstva čine ga
pogodnim dodatkom raznim materijalima.
Zbog problema nedovoljnih rezervi pitke vode,
sve više znanstvenika pokušava pronaći
efikasnu metodu pročišćavanja voda.
Prema njihovim istraživanjima kroz filtere od ugljikovih cijevi
pronazila bi samo voda, a na filteru bi ostajale nećistoće.
Ugljikove nanocijevi se razlikuju po duljini, debljini i broju slojeva. Razlikujemo cilindre koji se mogu sastojati od jednog sloja ili više slojeva grafena. Duljina višeslojnih cilindara je nekoliko stotina nanometara, a promjer oko 1 nm. Kada bi stavili duljinu cilindara u omjer prema vašoj kosi, jedna vlas imala bi duljinu od 40 metara.
Ugljikove nanocijevi, iako su vrlo lagane i pripadaju svijetu nanočestica, odlikuju se velikom čvrstoćom. Prema znanstvenim istraživanjima, ugljikove nanocijevi će uskoro istisnuti silicij, koji je danas osnova računalnog čipa. Prijenosna računala i pametni telefoni bit će sve jači, brži, tanji i lakši. Baterije će duže trajati, bežična komunikacija će bit sve brža, kao i brzina obrade podataka. Ugljikove nanocijevi koriste se za izradu odjeće i sportske opreme. Jedna od najčešćih uporaba je u strukturnom pojačanju različitih materijala. Visoka čvrstoća, mala težina, izvanredna toplinska vodljivost, mehanička i električna svojstva čine ga pogodnim dodatkom raznim materijalima. Zbog problema nedovoljnih rezervi pitke vode, sve više znanstvenika pokušava pronaći efikasnu metodu pročišćavanja voda. Prema njihovim istraživanjima kroz filtere od ugljikovih cijevi prolazila bi samo voda, a na filteru bi ostajale nećistoće.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Atomi plemenitih plinova se međusobno ne spajaju u molekule. Pri vrlo niskim temperaturama, zbog nastajanja induciranih dipola, plemeniti plinovi prelaze u čvrsto stanje. Plemeniti plinovi kristaliziraju u kubičnom sustavu, a jedinična ćelija im je plošno centrirana kocka.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Argon je bezbojan plemeniti plin bez mirisa, gustoće veće od gustoće zraka, nije otrovan. Dobiva se frakcijskom destilacijom tekućeg zraka. Čvrsti argon kristalizira u kubičnom sustavu, a jedinična ćelija je plošno centrirana kocka. Izračunajte gustoću argona ako je duljina brida jedinične ćelije 531,1 pm.
Gustoća argona je:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Jedinična ćelija kristala ugljikova dioksida je plošno centrirana kocka. Koliko iznosi masa jedinične ćelije ugljikova dioksida?
Želite li pokušati ponovo?
Na kraju…
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Koje od navedenih svojstava opisuje molekulske kristale?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja od navedenih tvari ima najviše talište?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliki je broj atoma u jediničnoj ćeliji volumno centrirane kocke?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja od navedenih elementarnih ćelija kristalnih slagalina metala sadrži četiri atoma?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Molekule joda u kristalu povezane su:
Želite li pokušati ponovo?