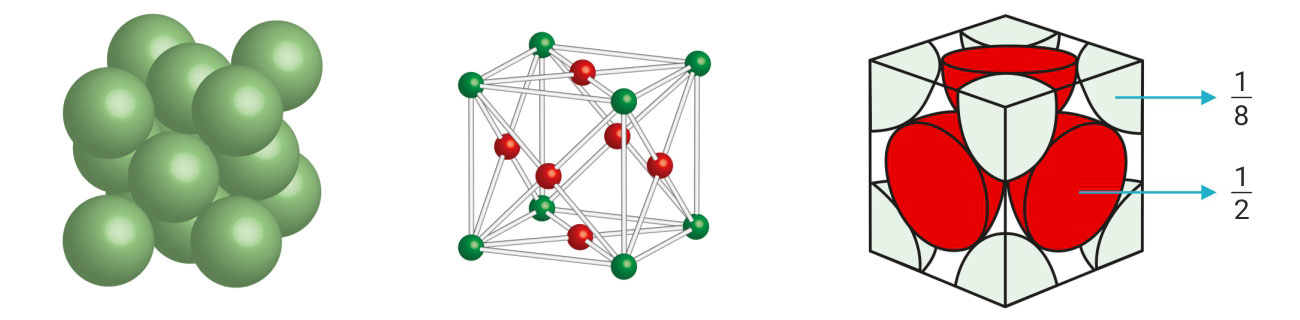
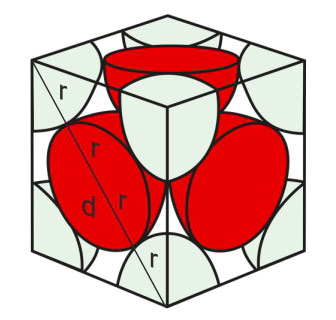
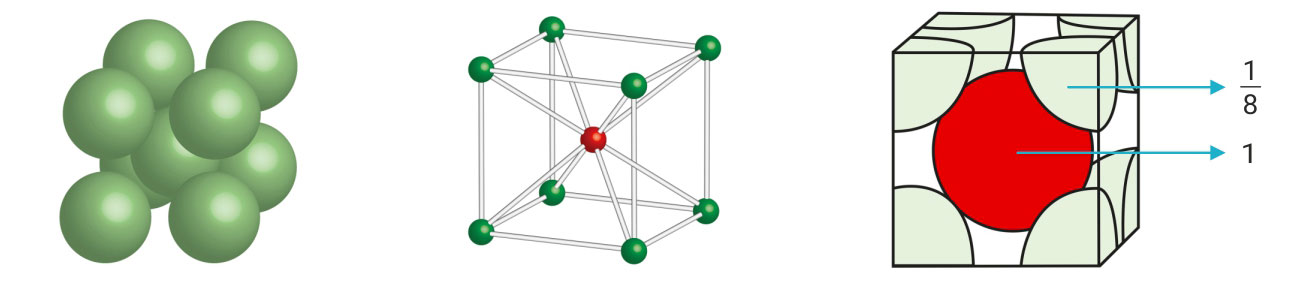
Kemijsko vezivanje
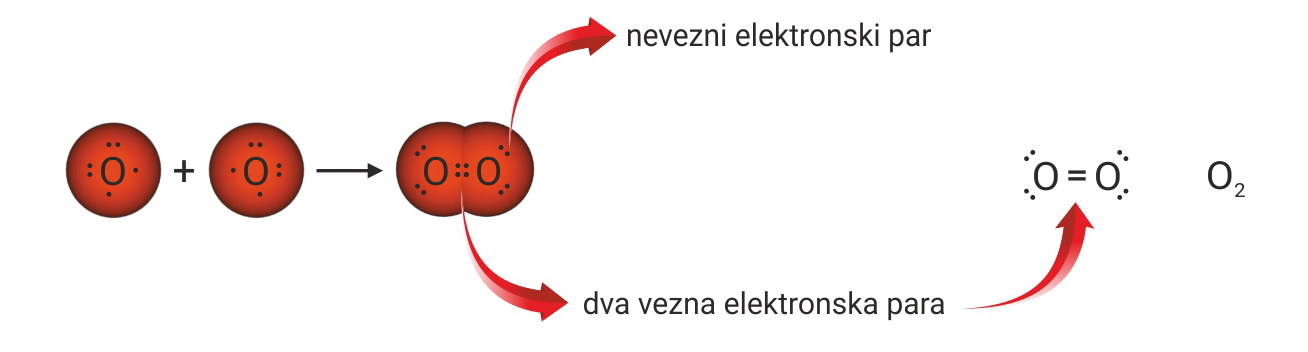
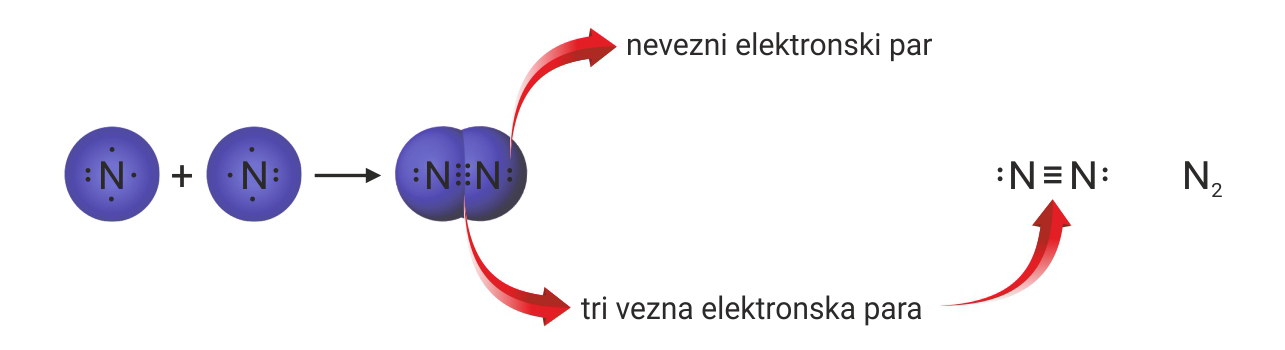
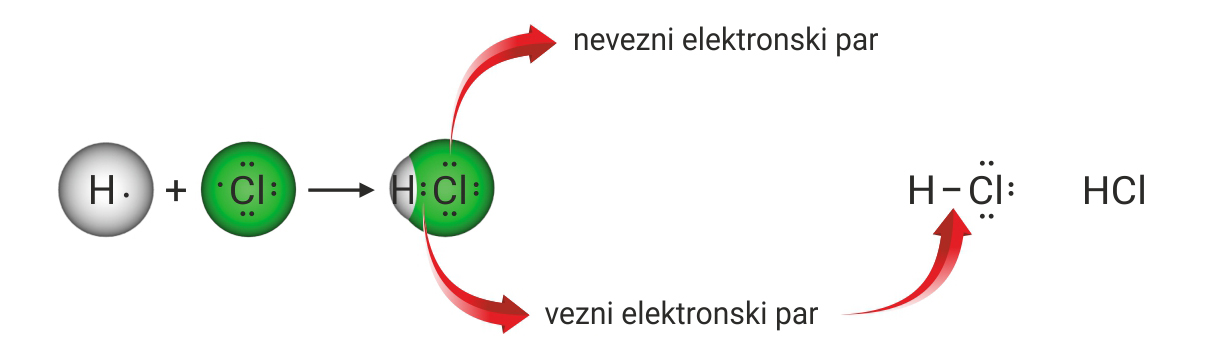
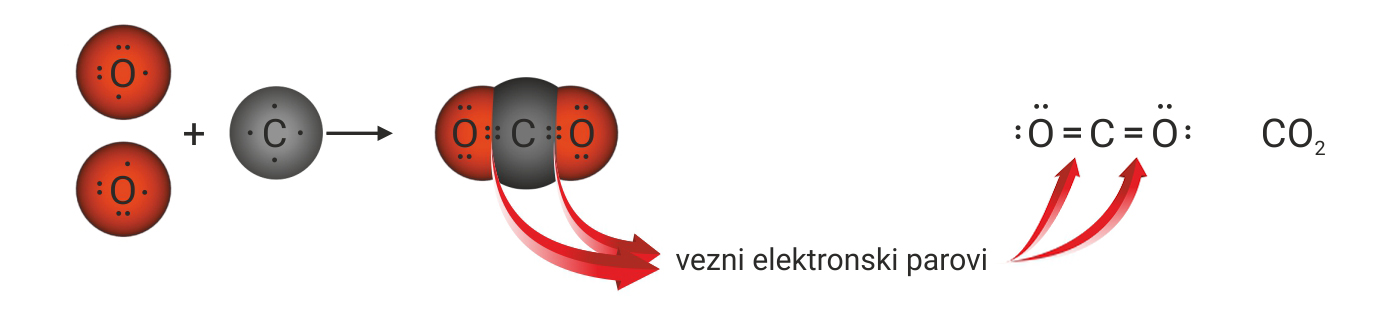
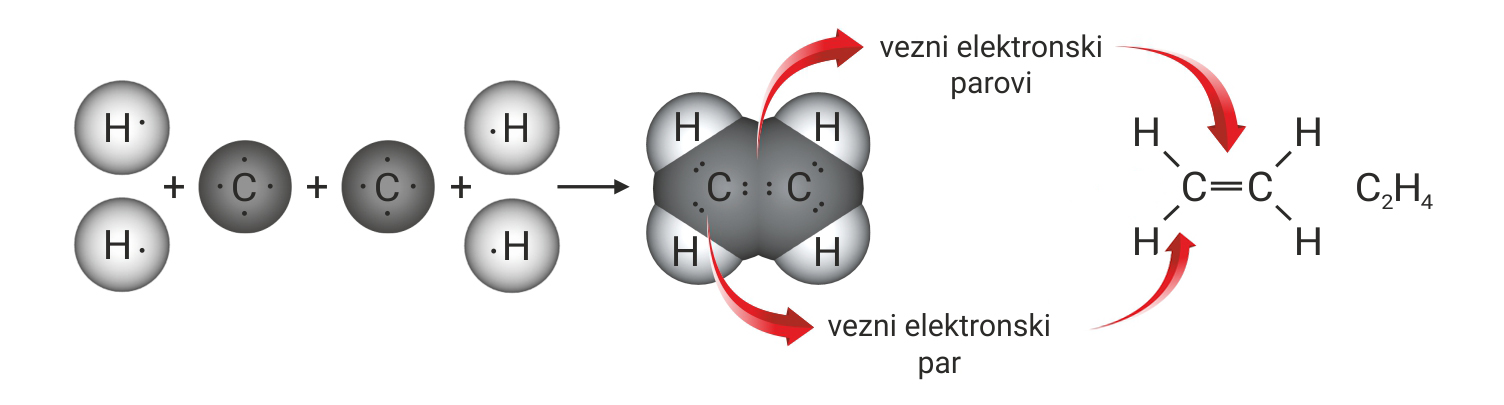
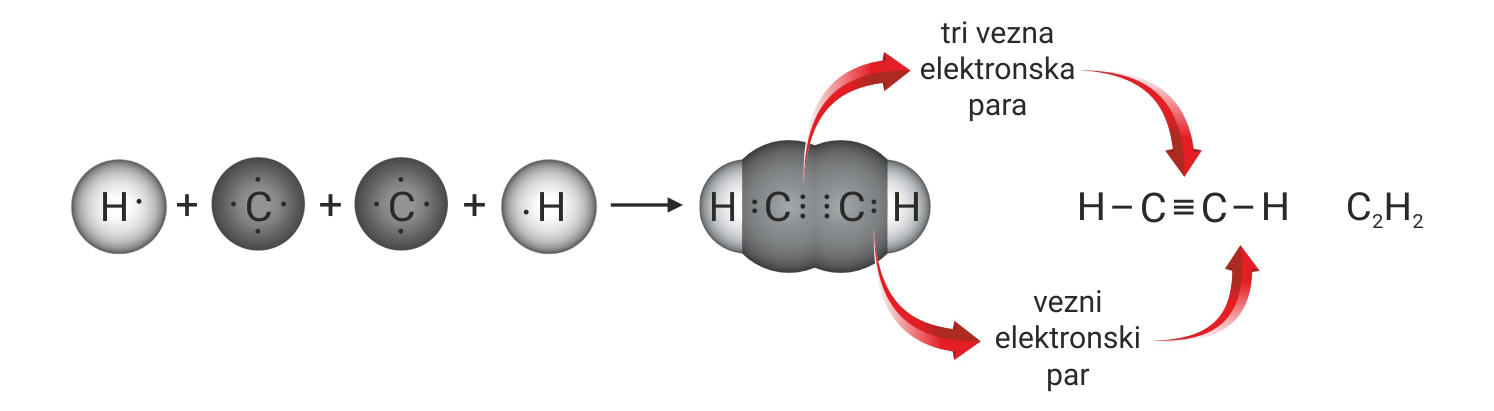
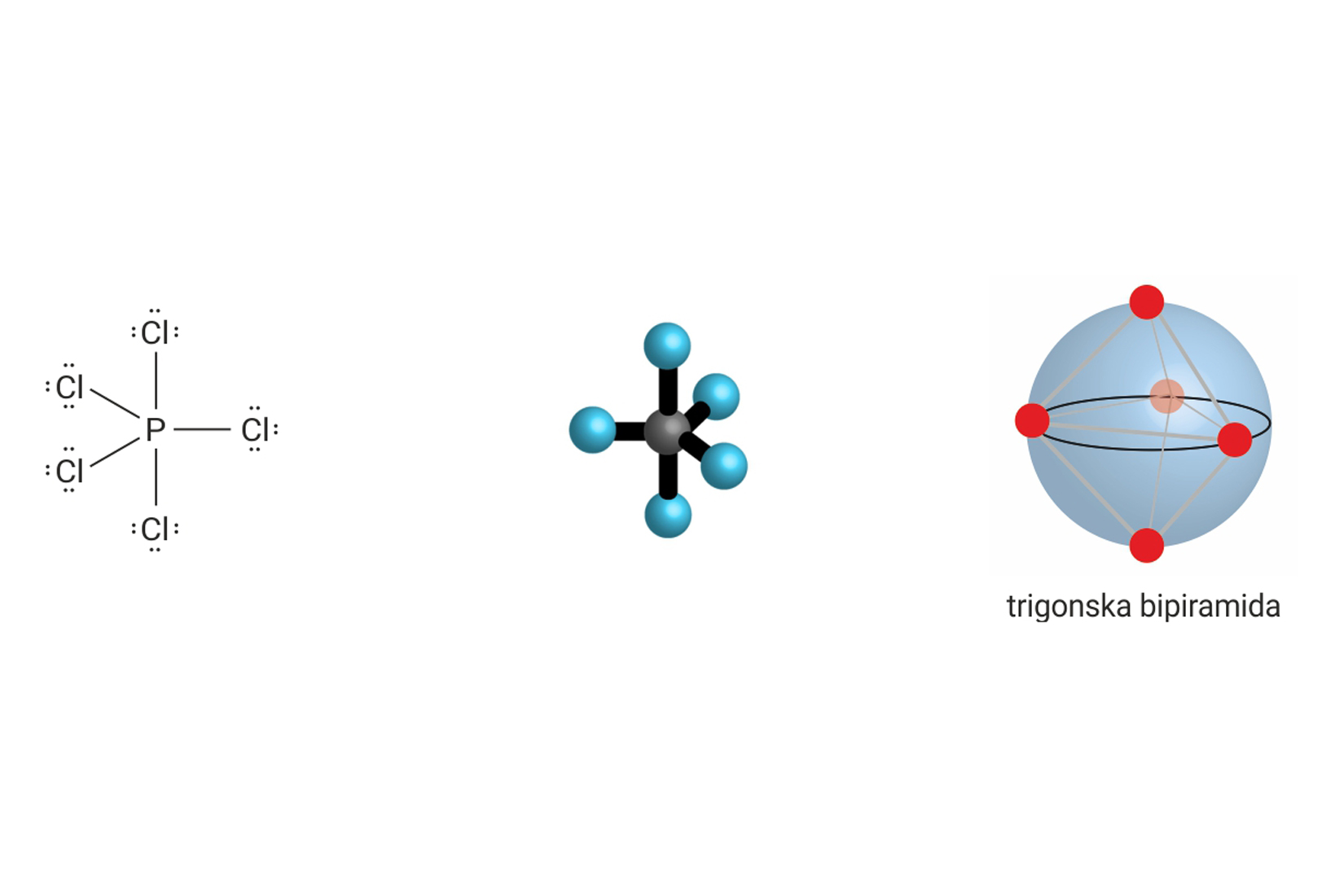
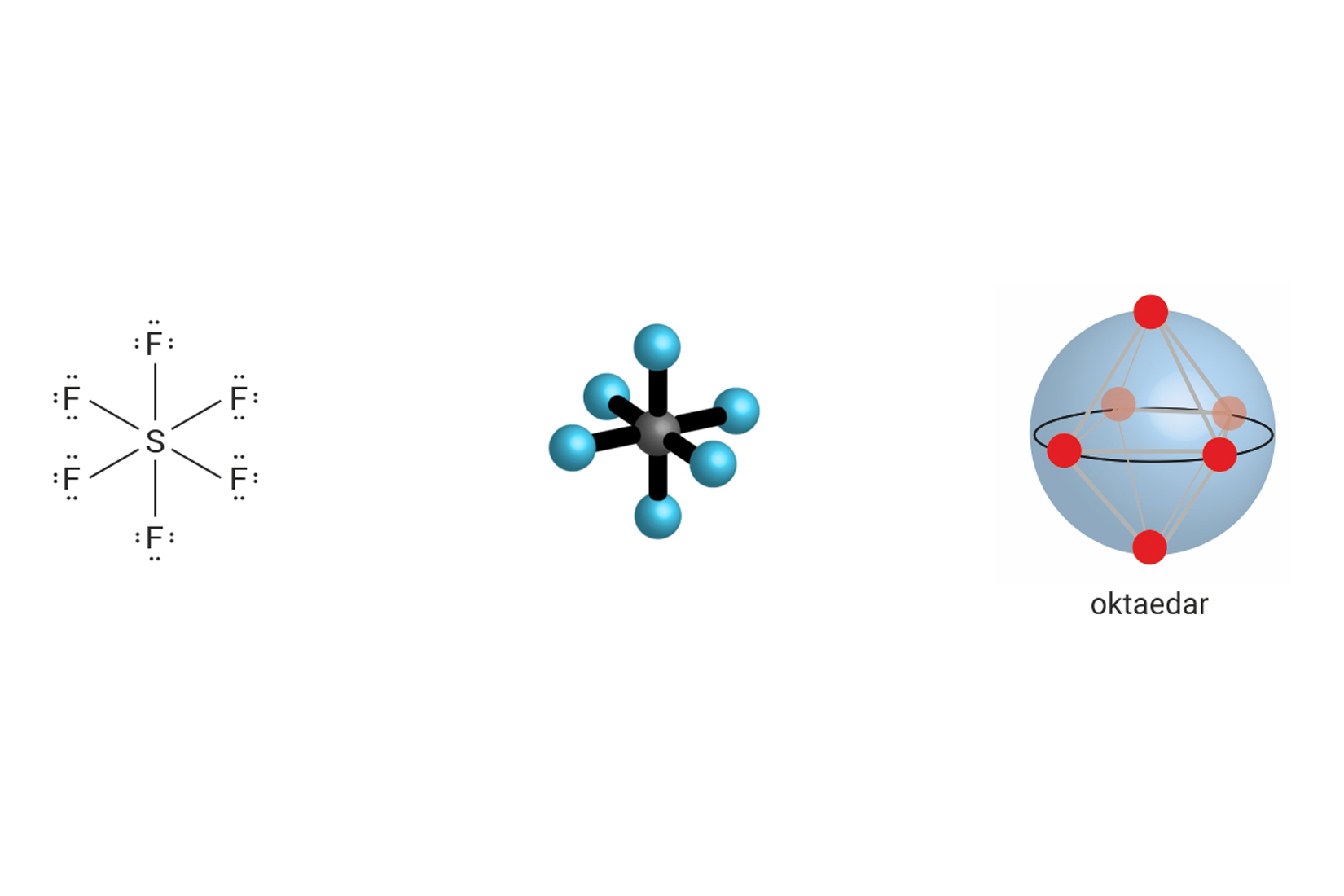
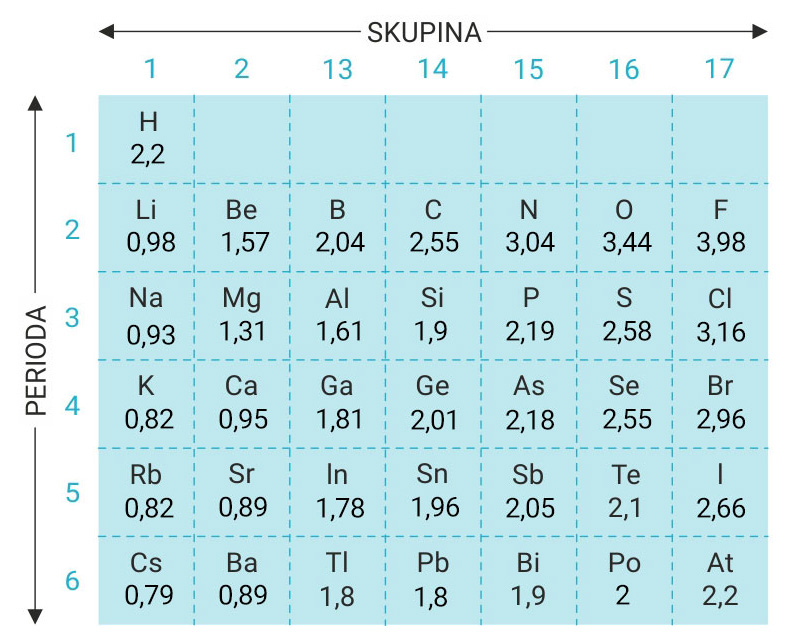
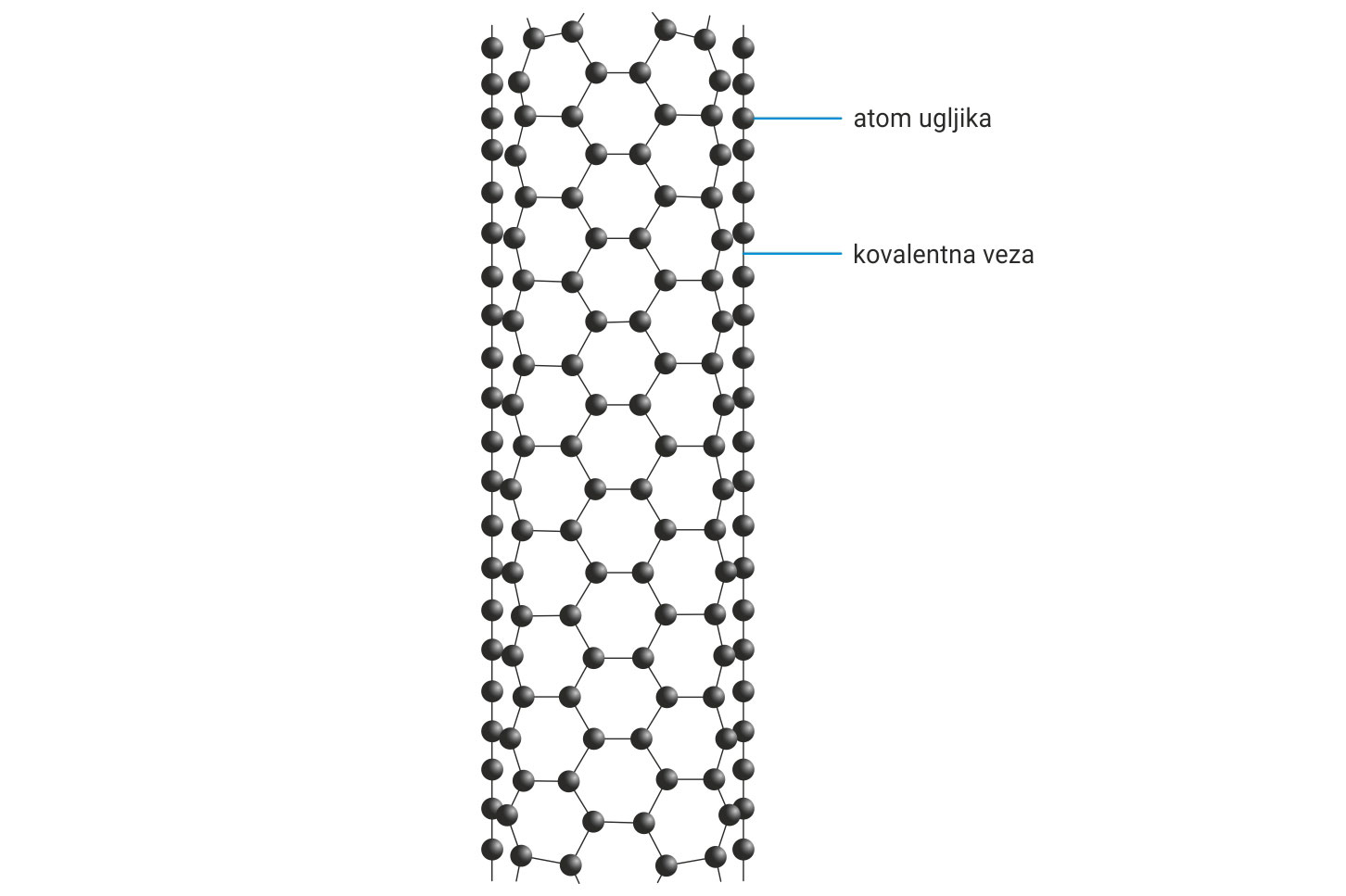
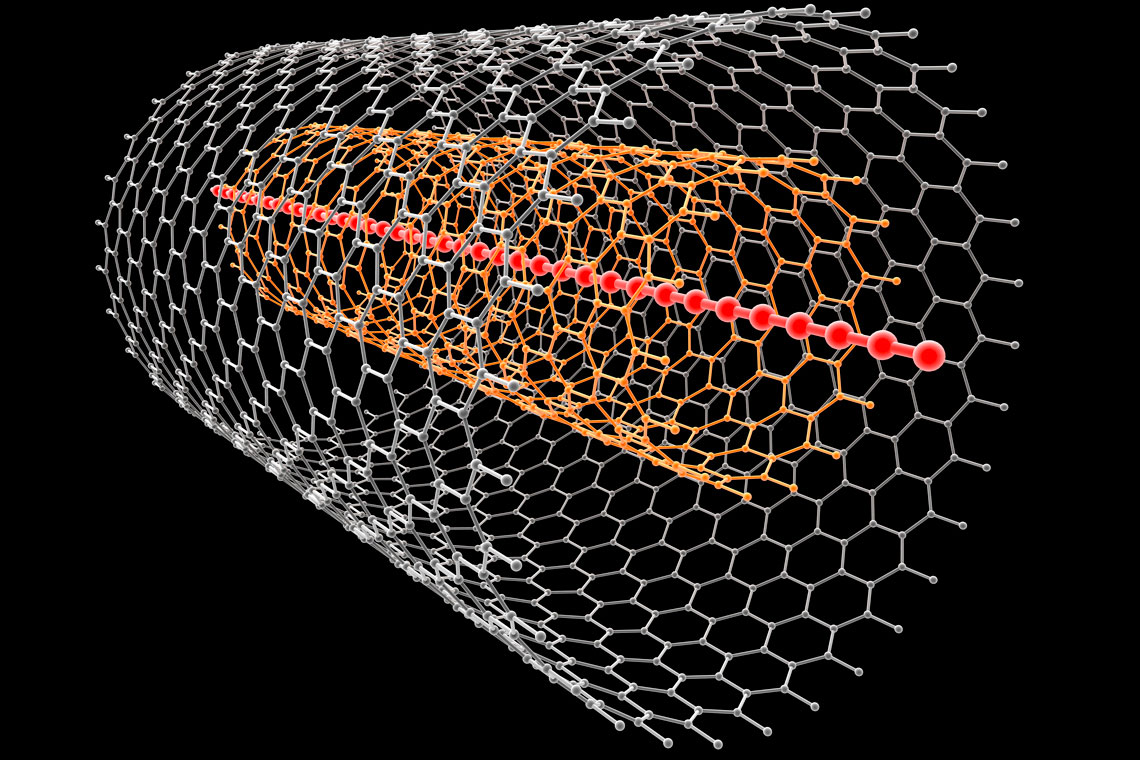
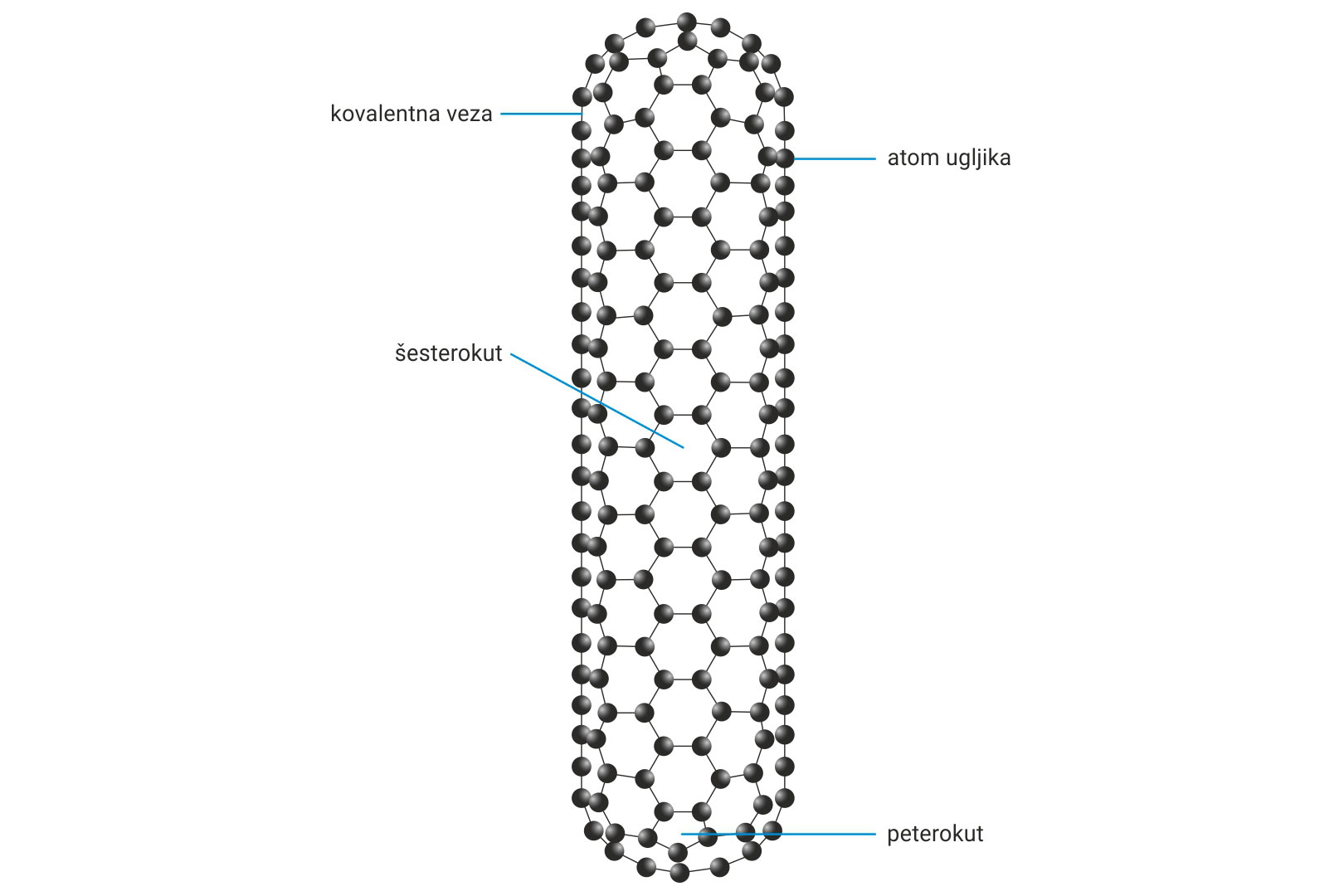
3.1.Kovalentno vezivanje
Shematski prikaz povezivanja atoma u molekulama vode, amonijaka i metana
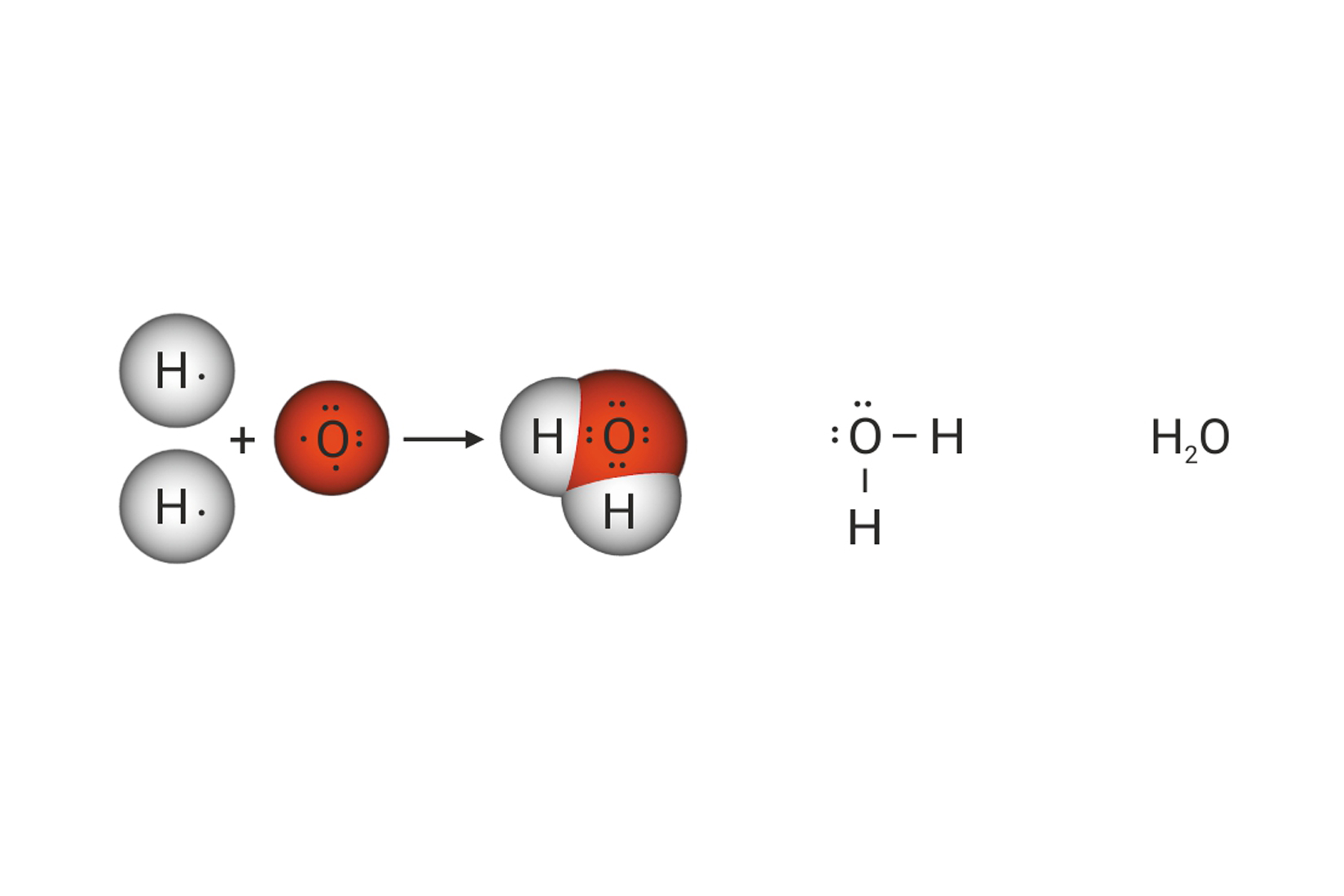
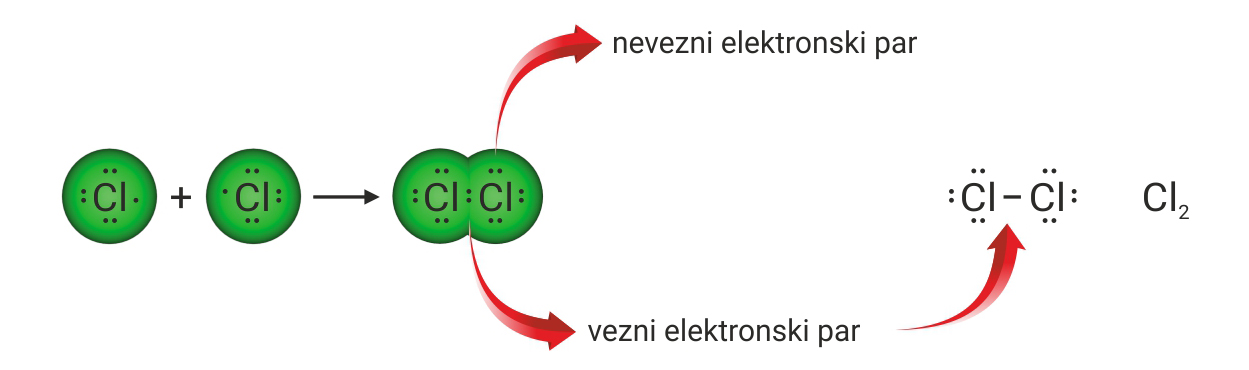
Koliko je veznih, a koliko neveznih parova u molekuli vode, ?
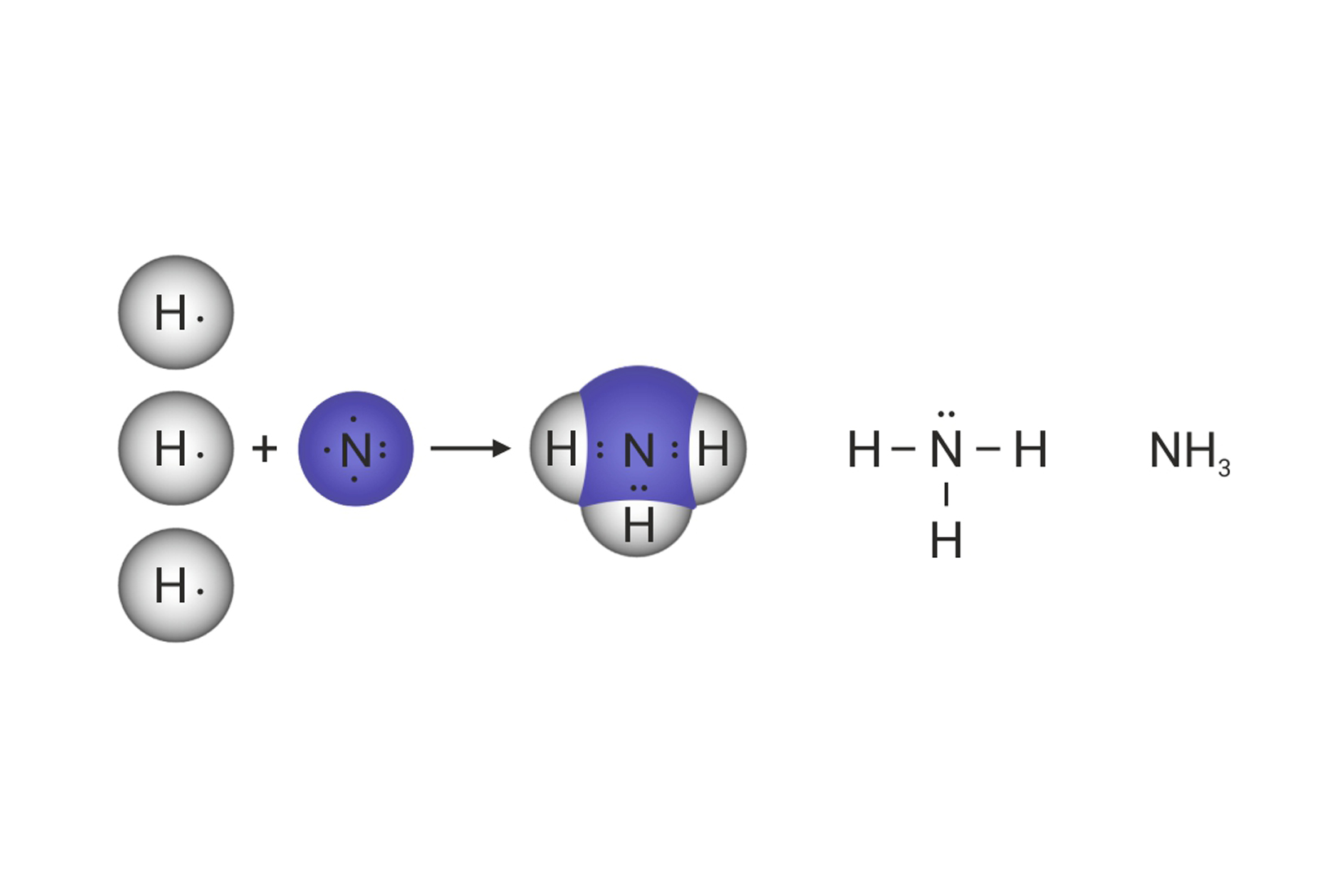
Koliko je veznih, a koliko neveznih parova u molekuli amonijaka, ?
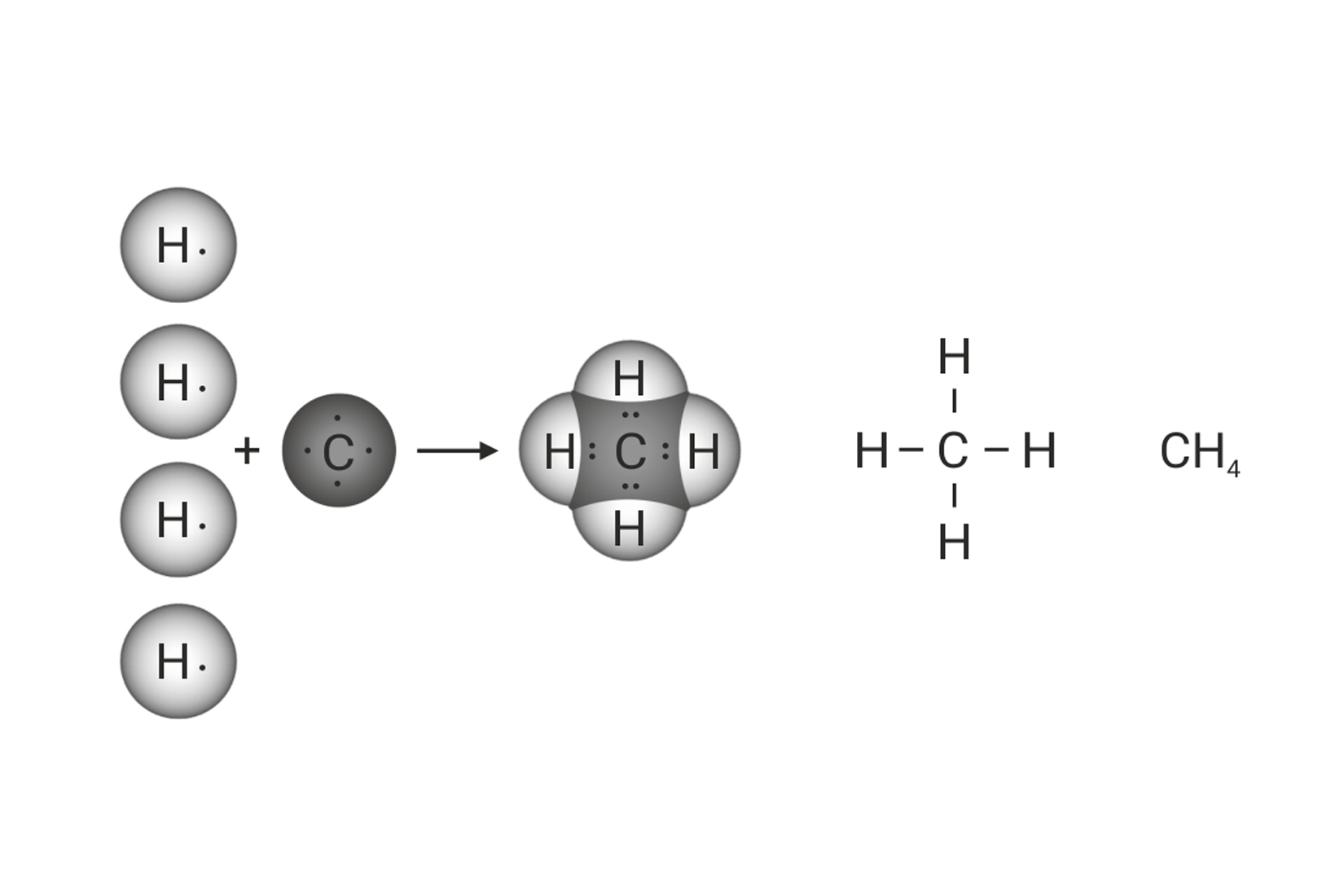
Koliko je veznih, a koliko neveznih parova u molekuli metana, ?
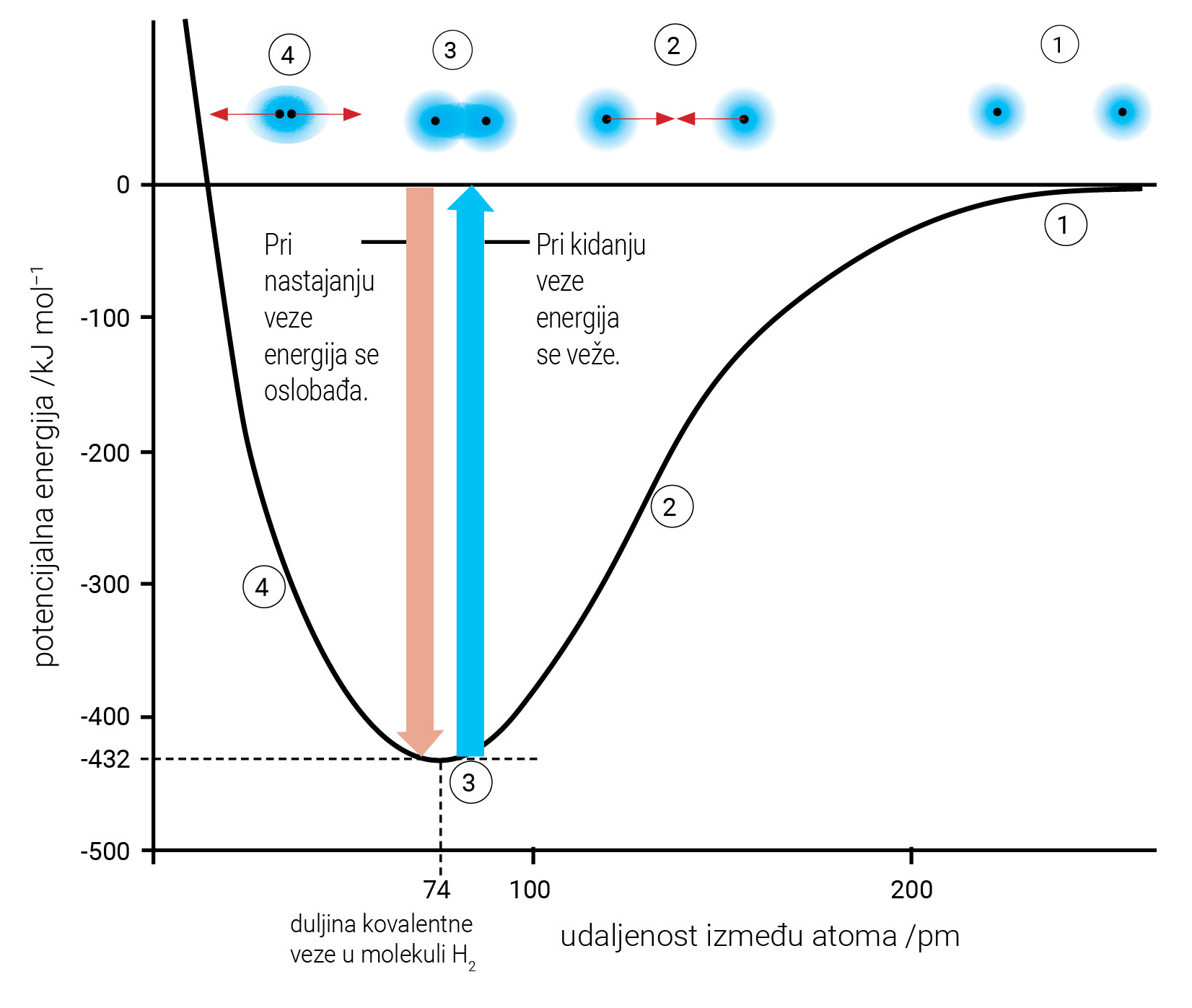
Ovisnost potencijalne energije sustava o međusobnoj udaljenosti atoma.
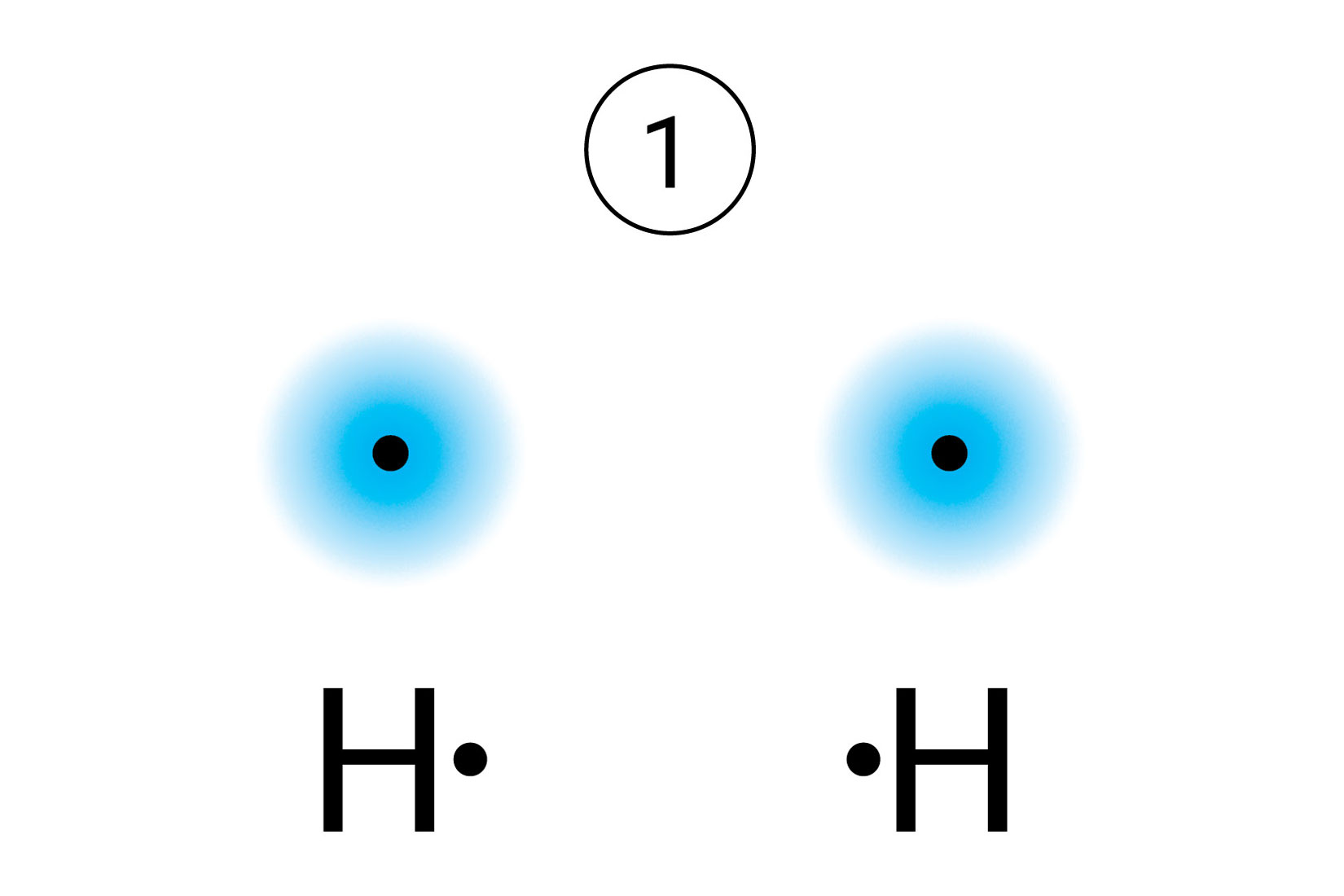
Kada su dva atoma vodika dovoljno udaljena između njih nema interakcija. Potencijalna energija sustava je nula.
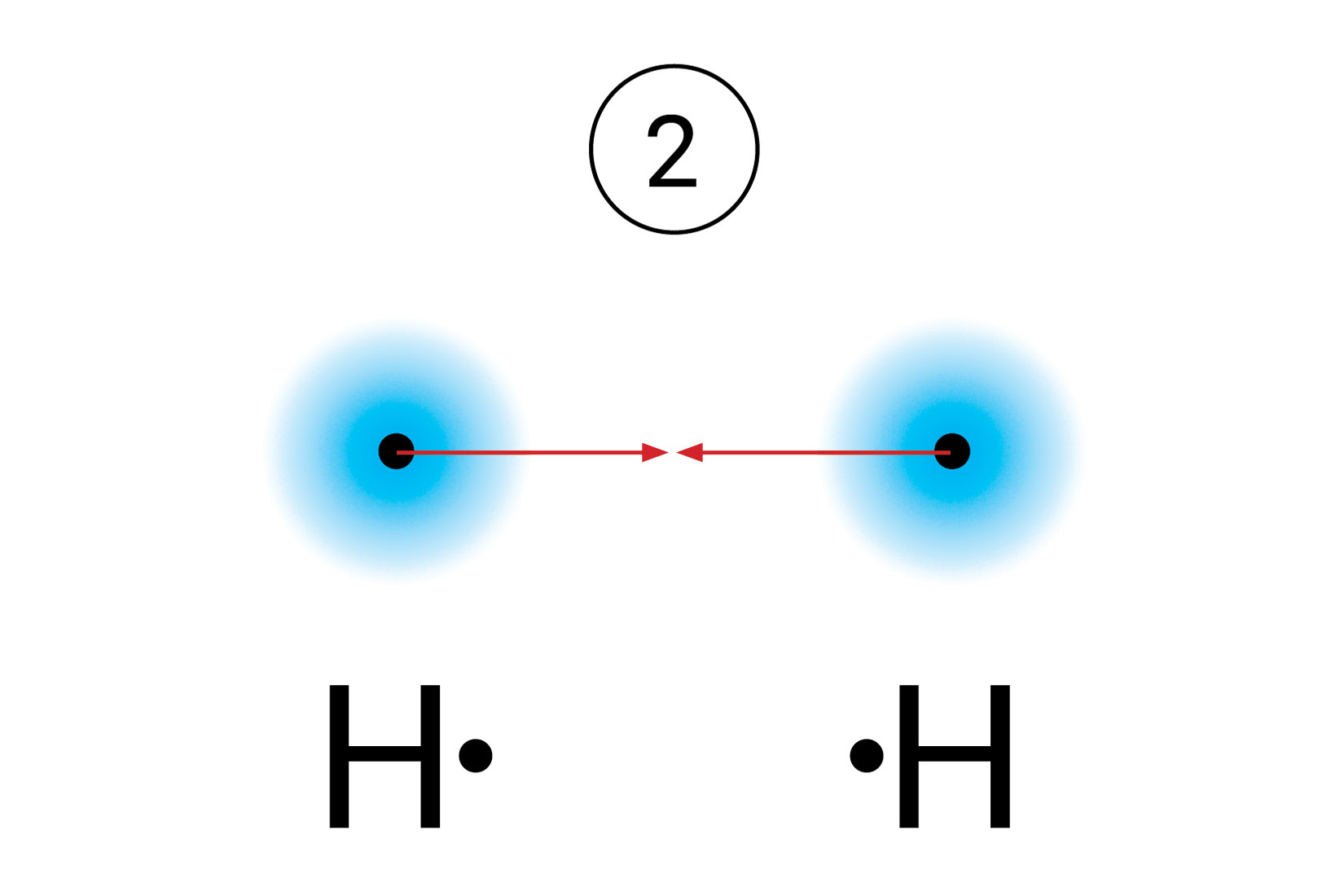
Kada se atomi približe jedan drugom između njih dolazi do interakcije (međudjelovanja). Potencijalna energija sustava pri tome se snizi.
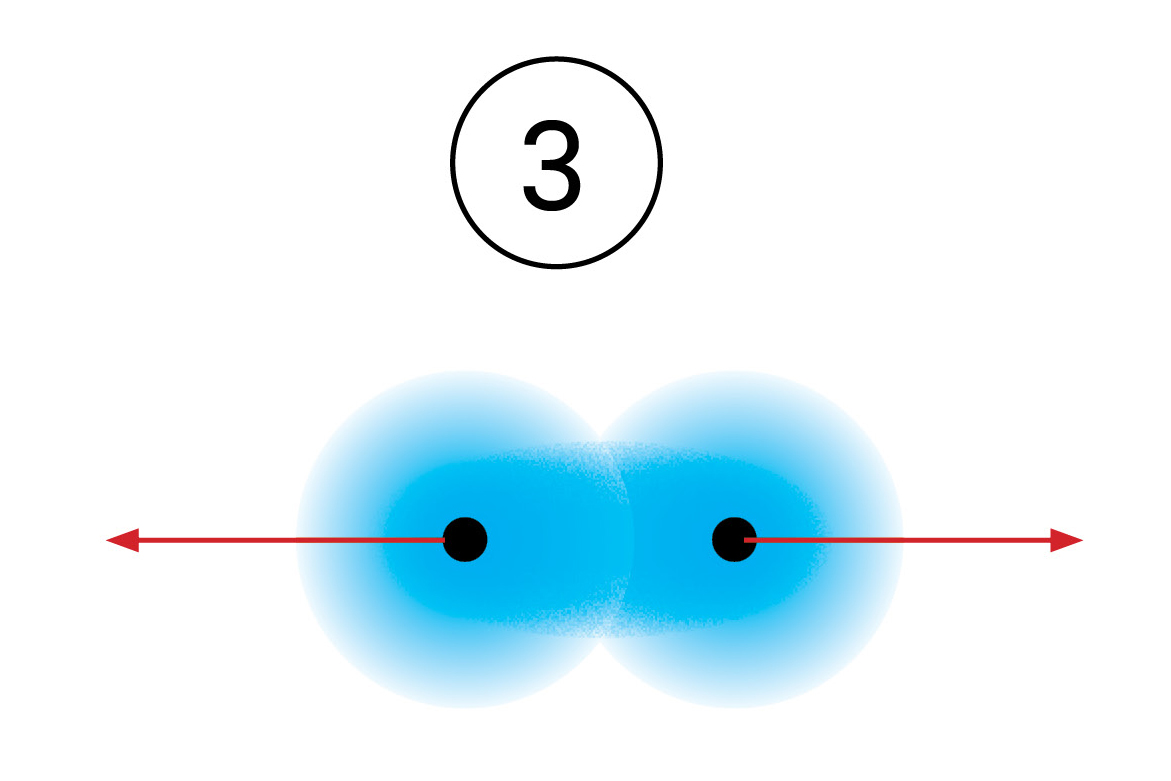
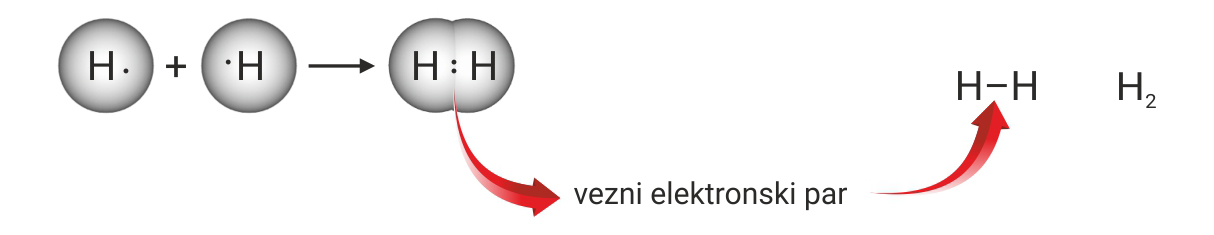
Kad se atomi vodika dovoljno približe jedan drugome jezgre obaju atoma istodobno privlače njihove elektrone. Jezgra jednog atoma vodika privlači elektron drugog atoma vodika i obrnuto. Kovalentna veza nastaje kada je udaljenost između jezgara dva atoma vodika najmanja, a pri tom i potencijalna energija sustava najniža.
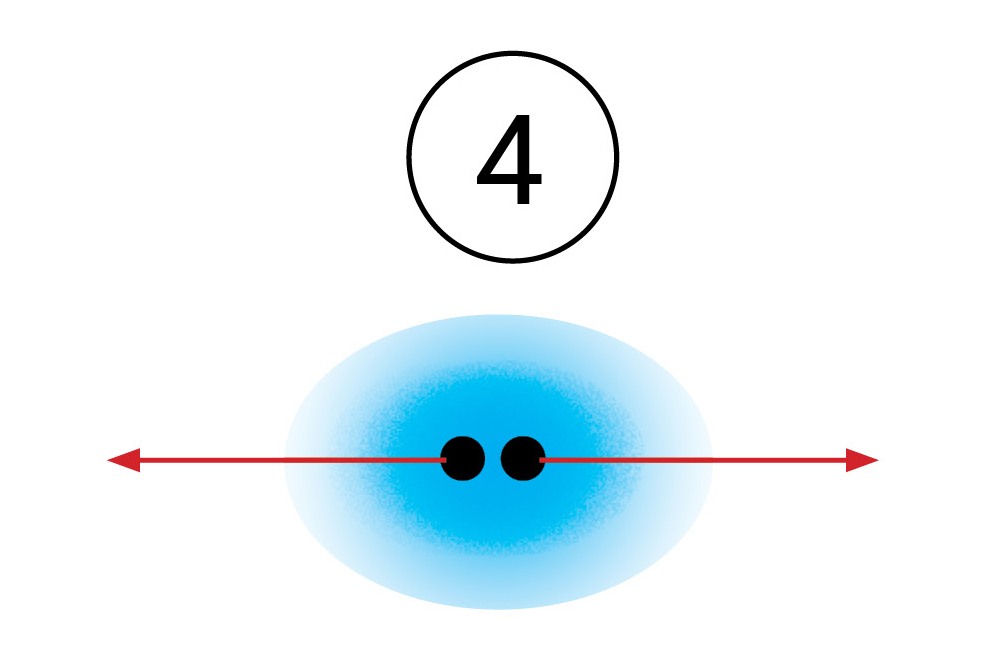
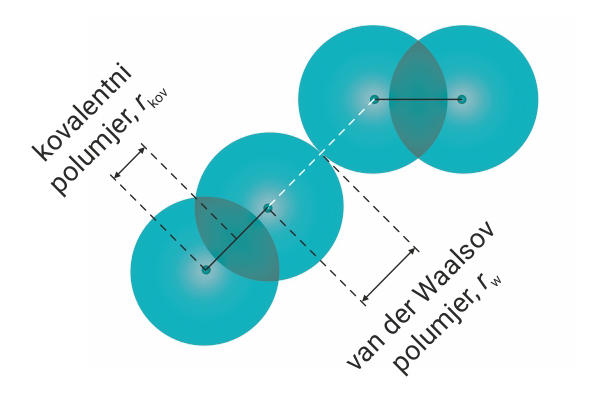
Smanjivanjem udaljenosti između atoma povećavaju se odbojne sile. One su posljedica elektrostatskog odbijanja elektronskih omotača atoma. Negativne vrijednosti potencijalne energije odgovaraju međuatomskom privlačenju, a pozitivne vrijednosti međuatomskom odbijanju.
3.2.Međumolekulske interakcije
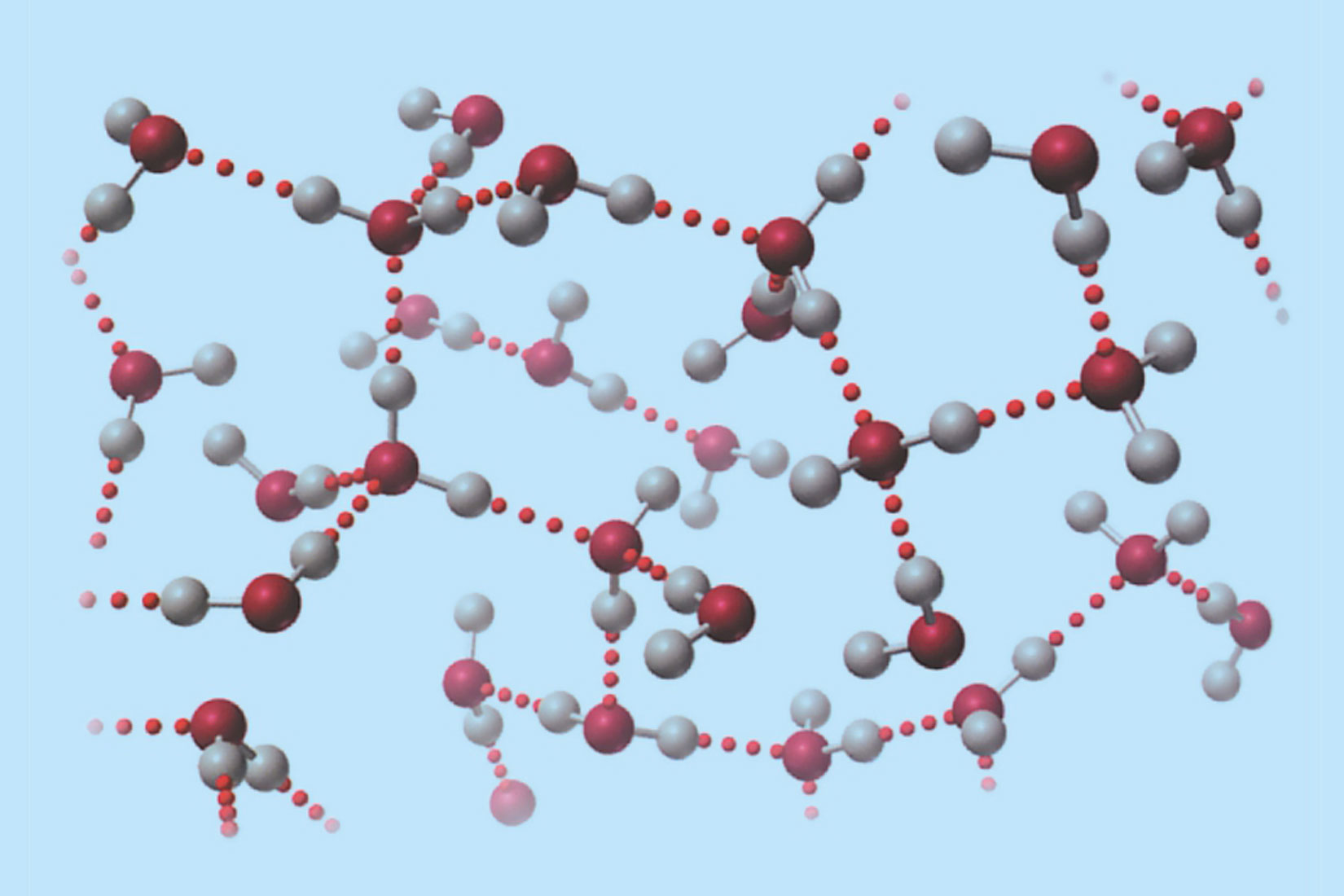
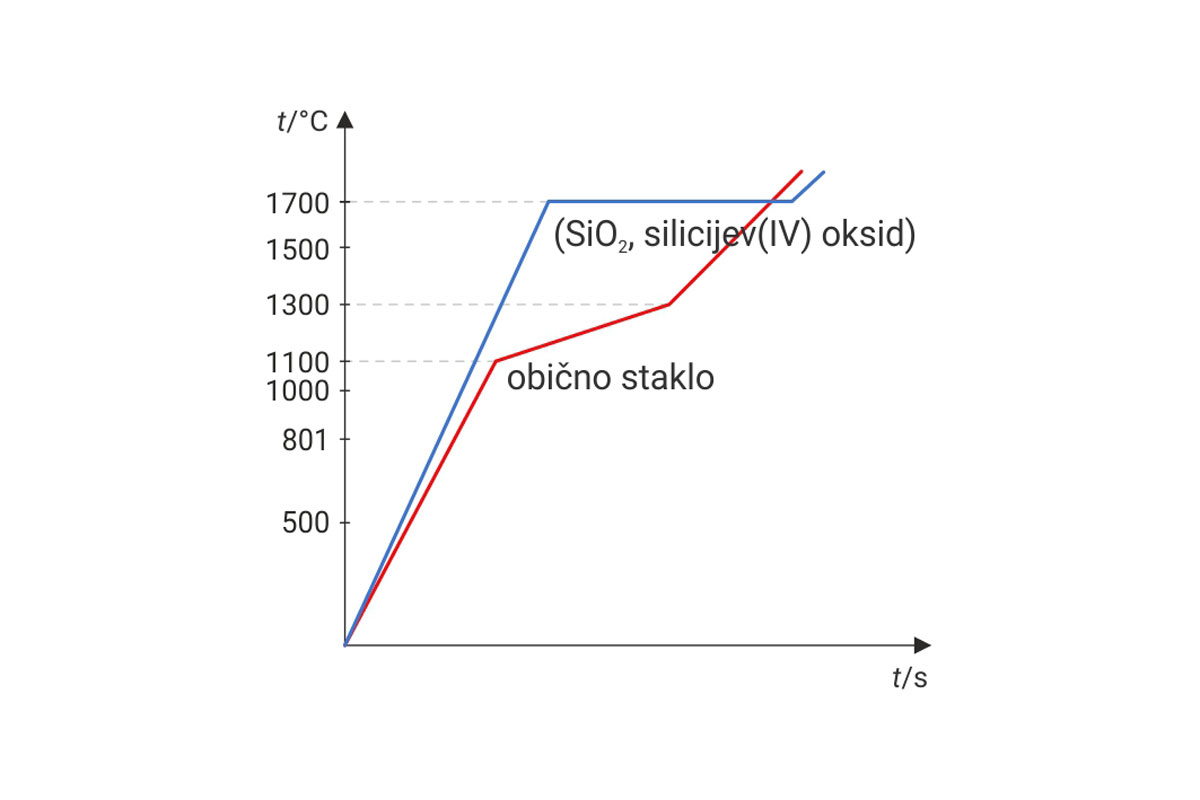
Kad ne bi bilo vodikovih veza između molekula vode, voda bi bila u plinovitom agregacijskom stanju s vrelištem oko –100 °C.
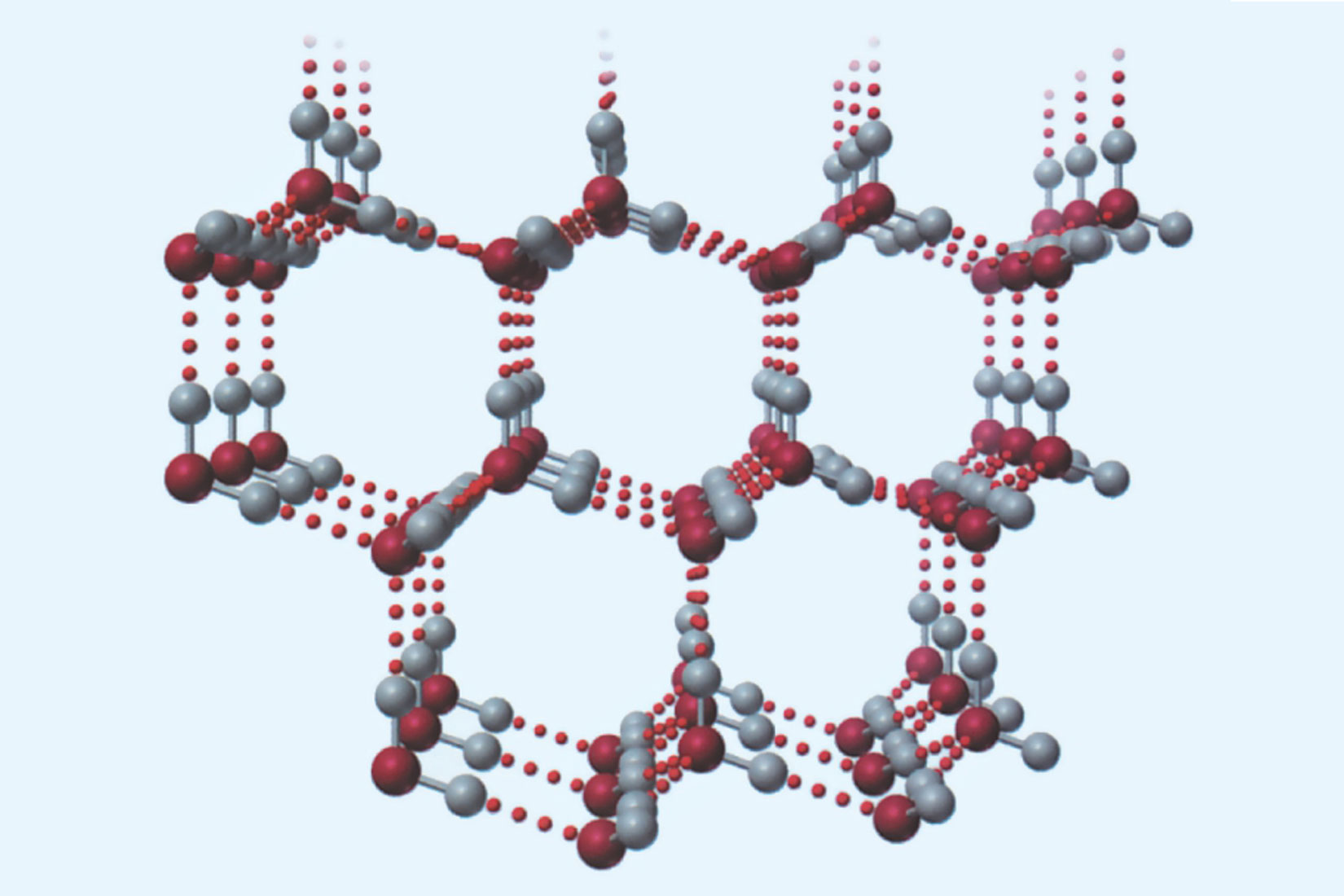
Pri temperaturama od 0 °C (i nižim) molekule vode se vodikovim vezama povezuju u pravilne kristalne strukture. Gustoća tako organizirane čvrste tvari je manja od gustoće tekuće vode. U tekućoj se vodi, naime, molekule vode gibaju i nadvladavaju pojedine vodikove veze. Uslijed “pucanja” vodikovih veza smanjuje se udaljenost između pojedinih molekula vode. Stoga je tekuća voda gušća od leda.
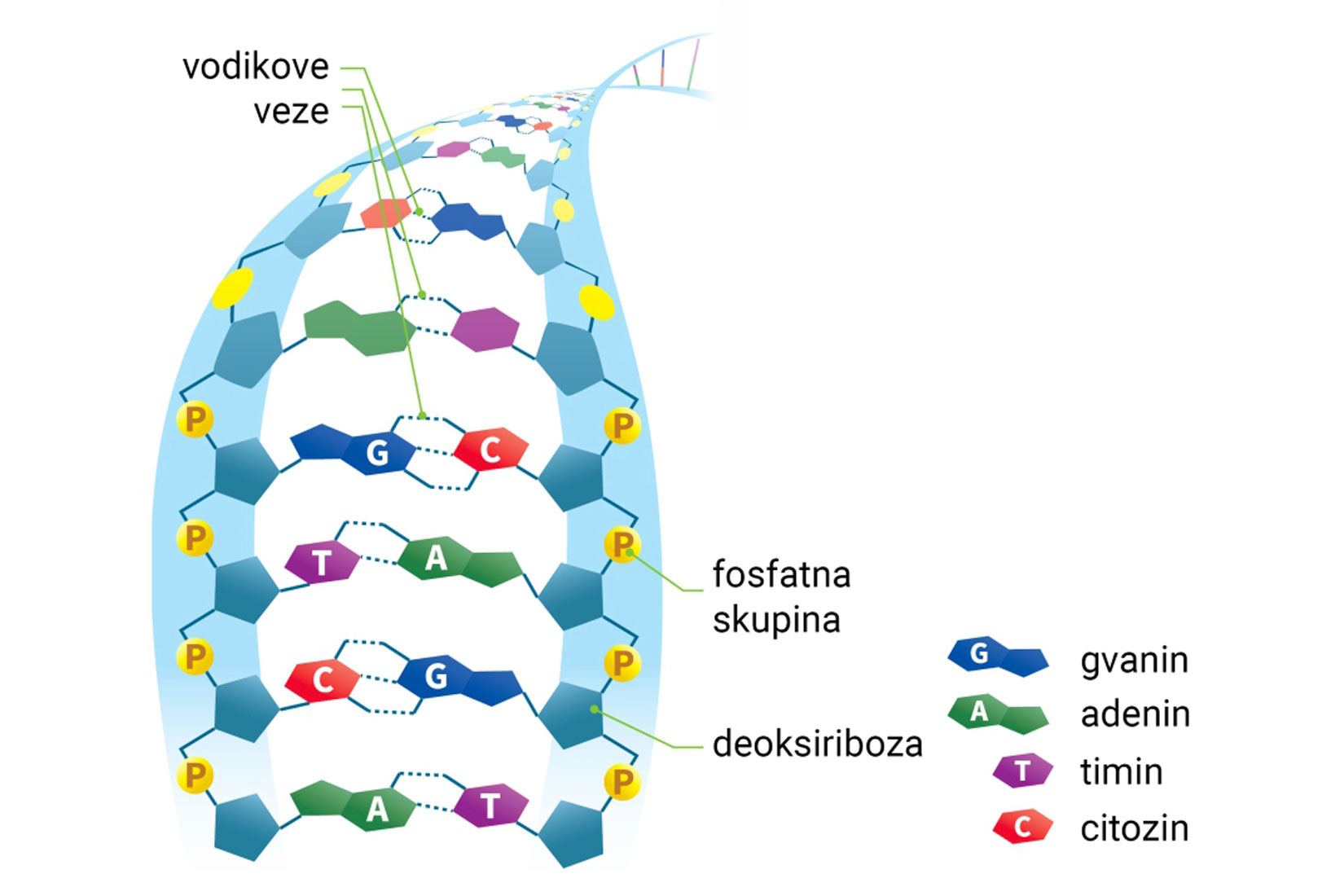
Vodikove veze povezuju lance molekule DNA.
Više informacija o ovoj temi možete pronaći u jedinici 2.4 Nukleinske kiseline u DOS-u Biologija 1.
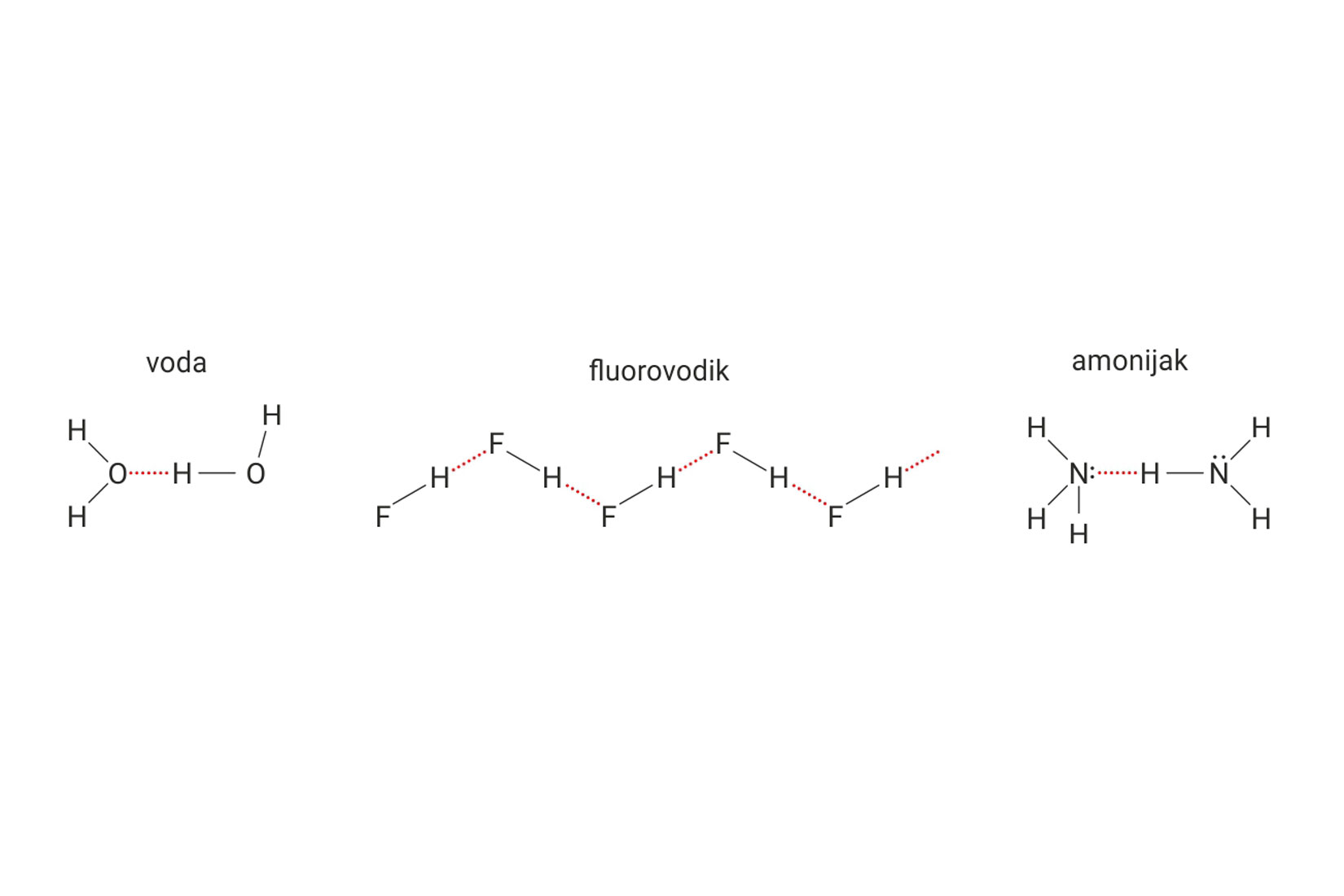
Vodikove veze uzrok su visokog vrelišta vode, , fluorovodika, , i amonijaka, .
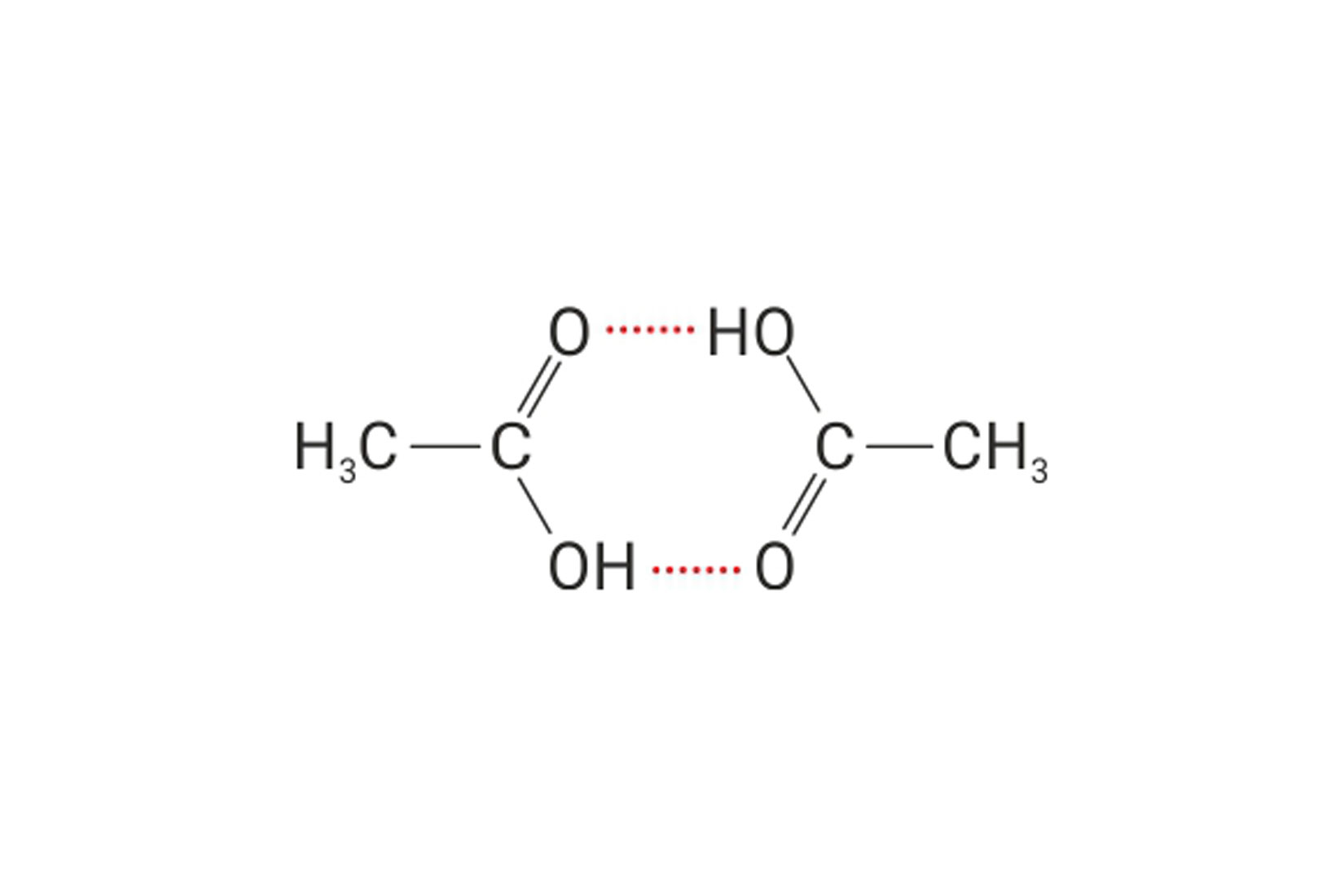
Između dviju molekula octene kiseline (DIMER) nastaju dvije vodikove veze koje su uzrok visokog vrelišta octene kiseline.
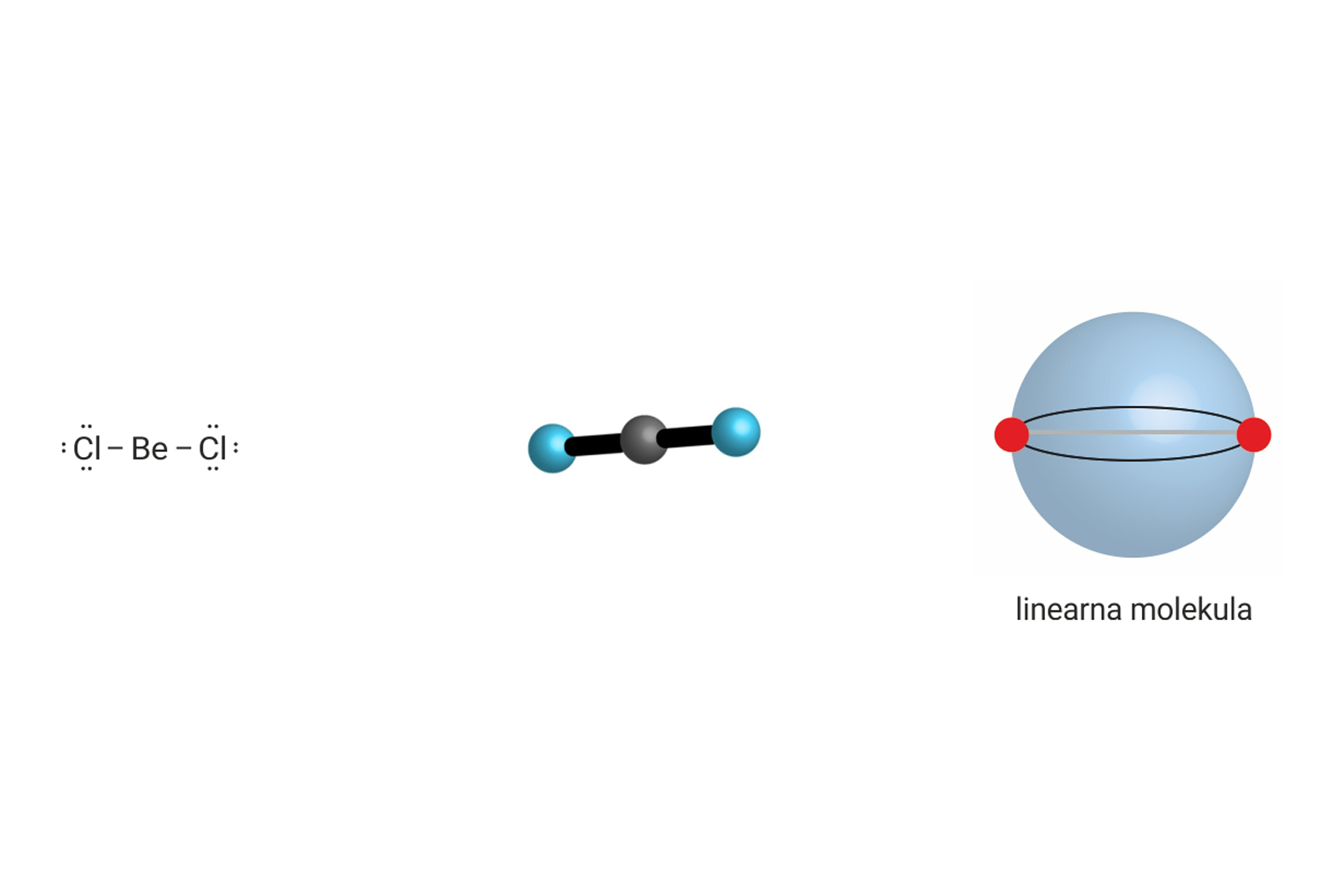
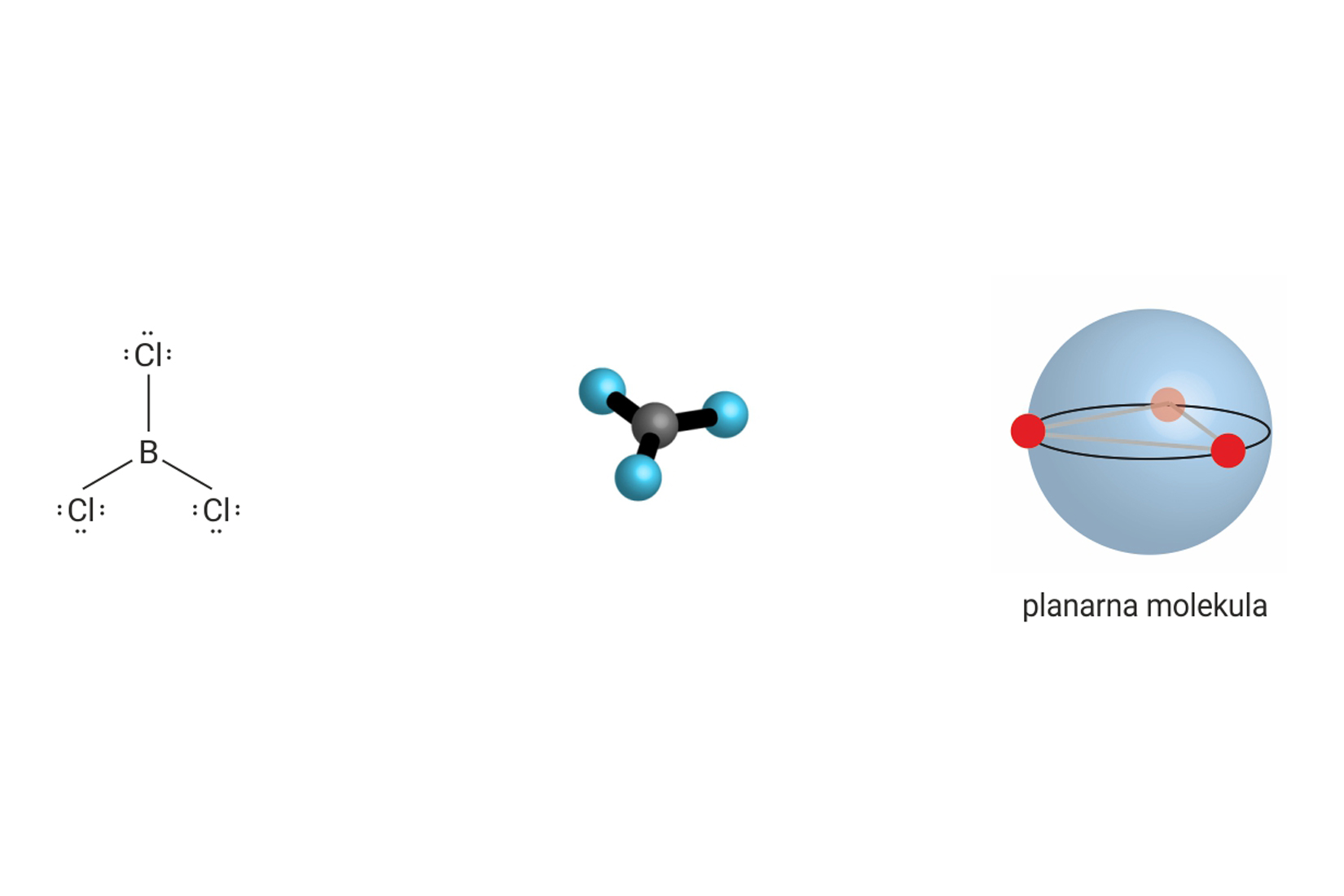
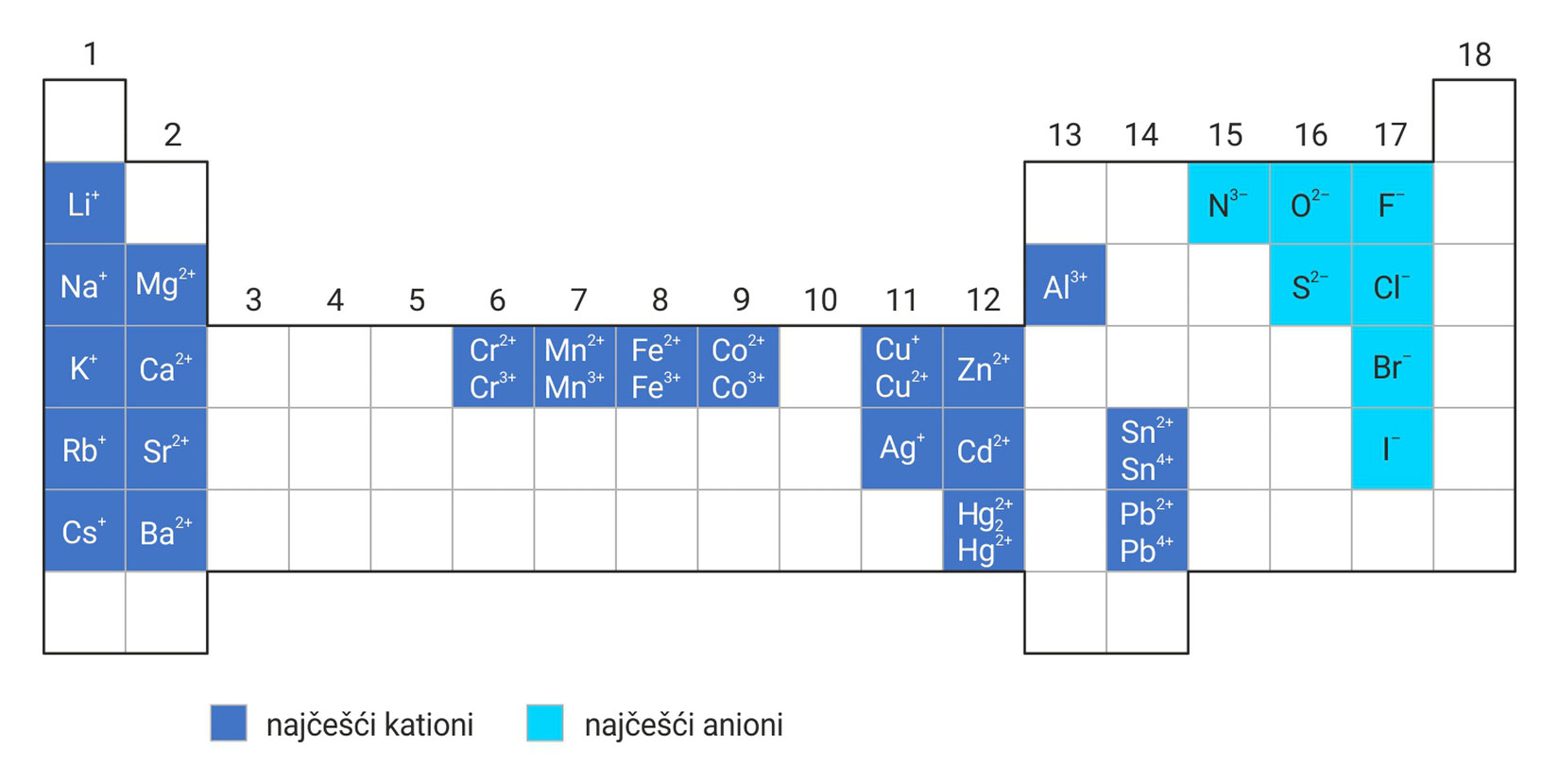
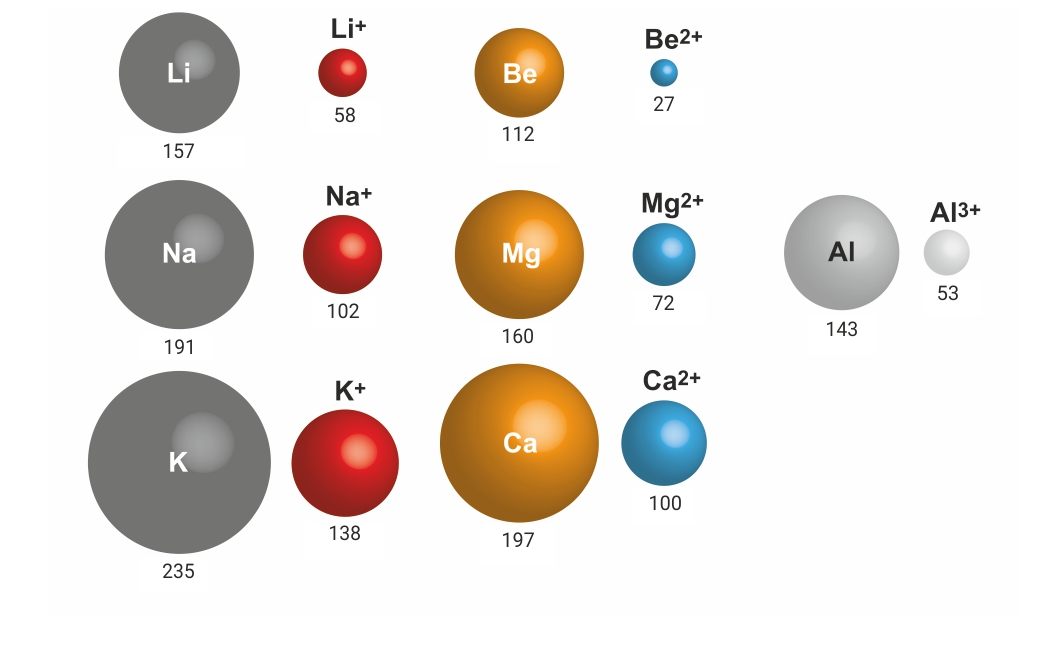
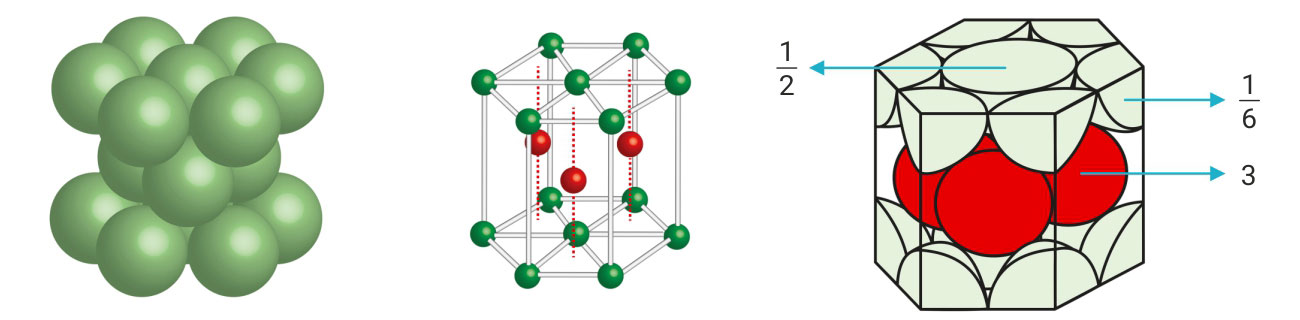
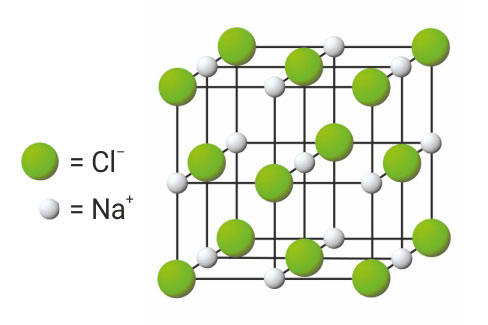
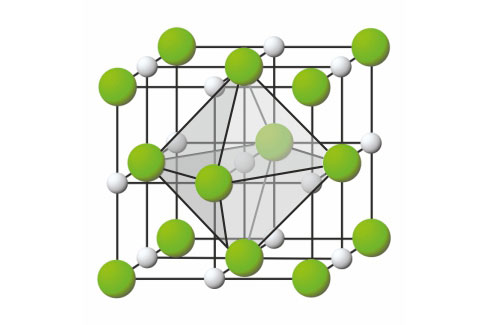
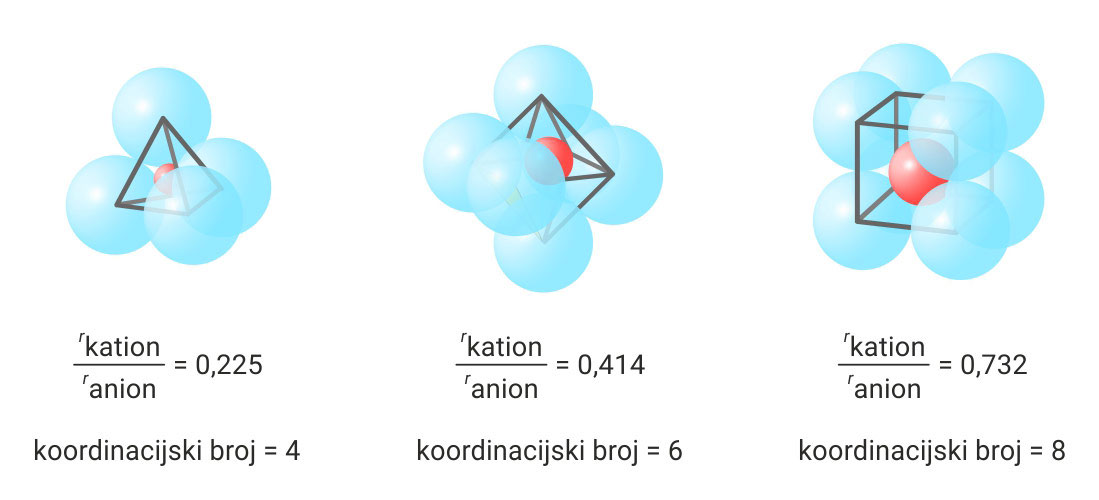
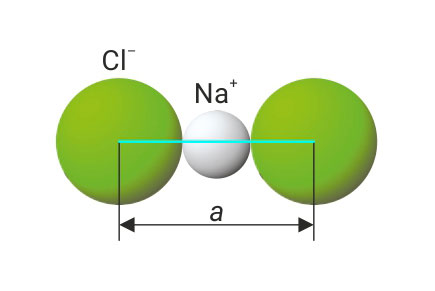
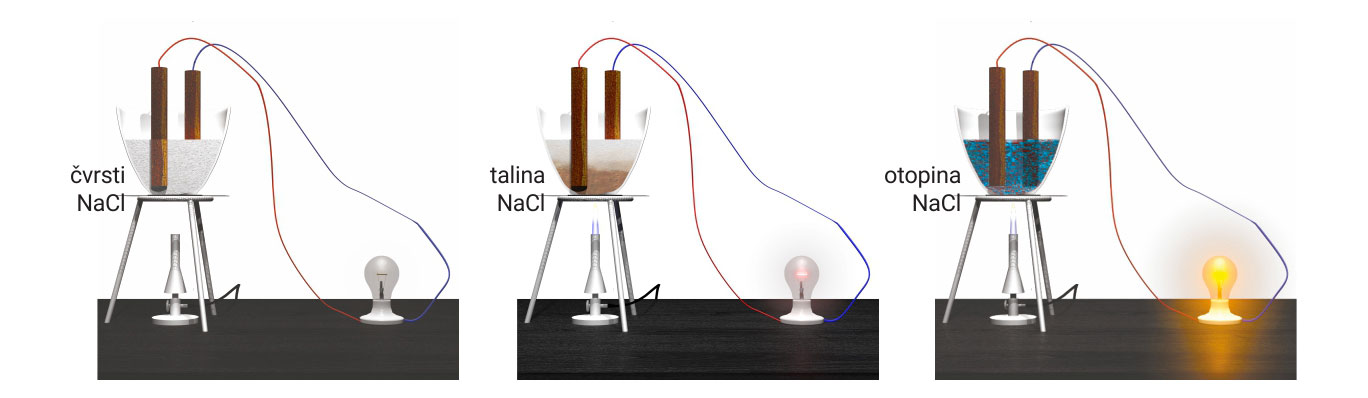
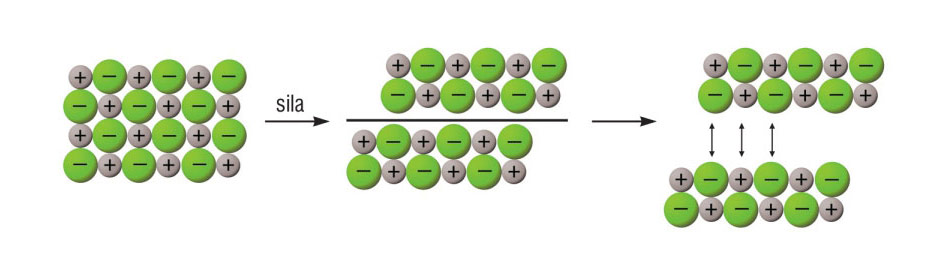
3.3.Ionsko vezivanje
3.4.Oksidi metala i oksidi nemetala

Sumpor je halkogeni element koji u reakciji s kisikom daje
sumporov(IV) oksid.
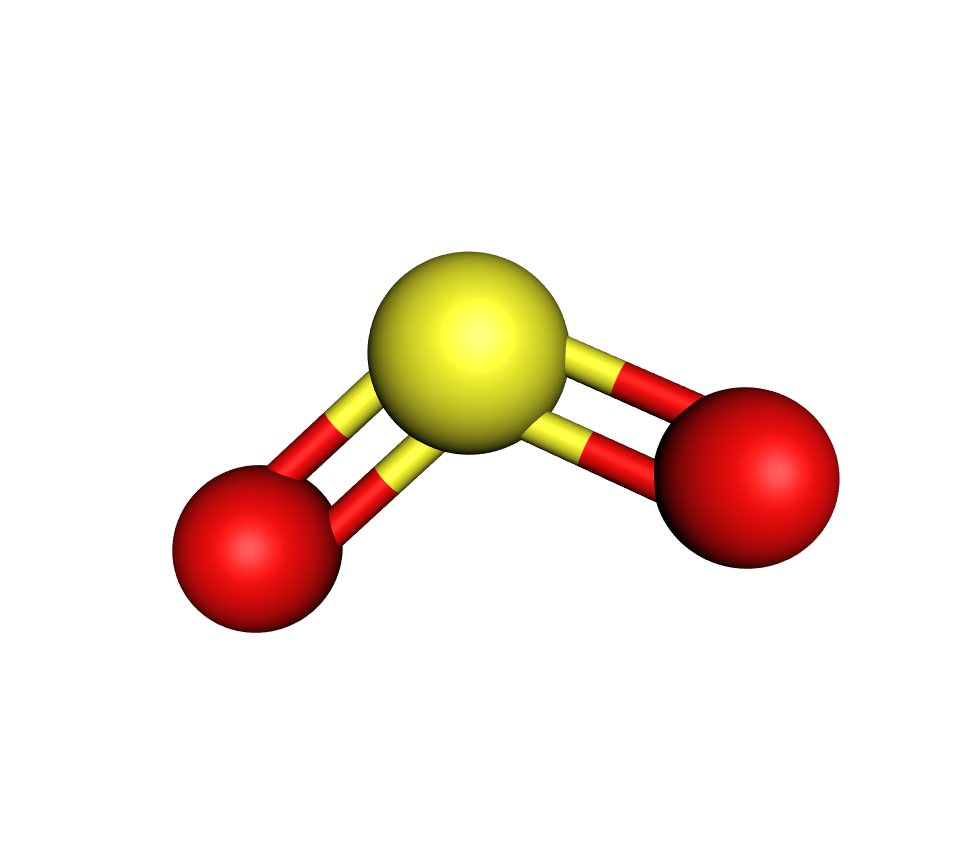
Oksidacijom sumporova(IV) oksida nastaje
sumporov(VI) oksid.
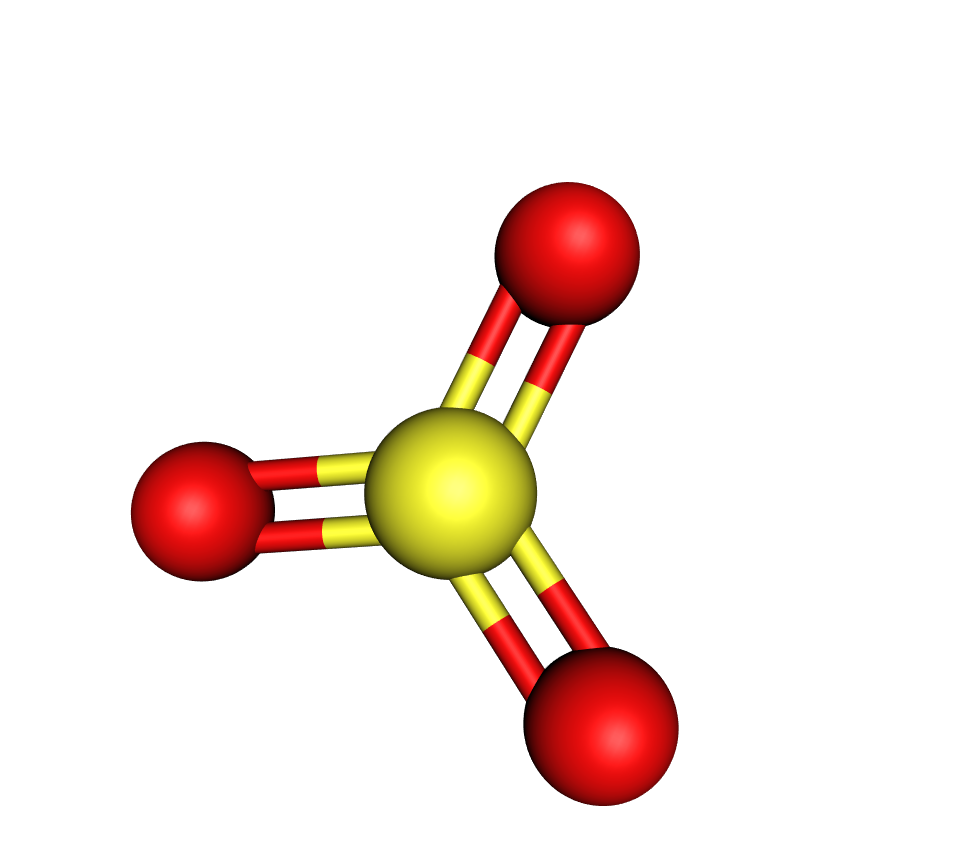
Reakcijom sumporova(VI) oksida s vodom nastaje sumporna kiselina.
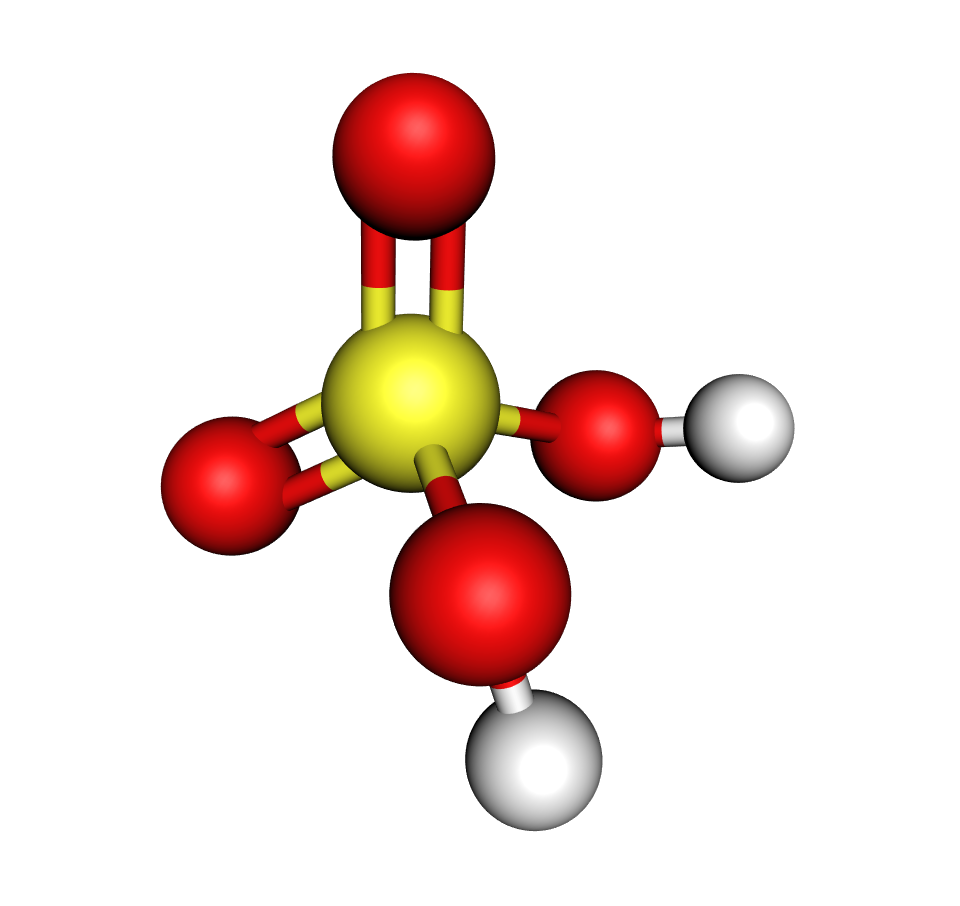
Ionizacijom sumporne kiseline u vodi nastaju oksonijevi ioni i sulfatni ioni.