Kovalentno vezivanje
- povezati model kovalentnog vezivanja s konceptom molekule
- Lewisovom simbolikom prikazati model nastajanja kovalentne veze
- obrazložiti usmjerenost kovalentne veze u prostoru
- prepoznati kada dolazi do odstupanja od pravila okteta za središnji atom u molekuli primjenom VSEPR modela
- predvidjeti prostornu građu molekula
Uvod
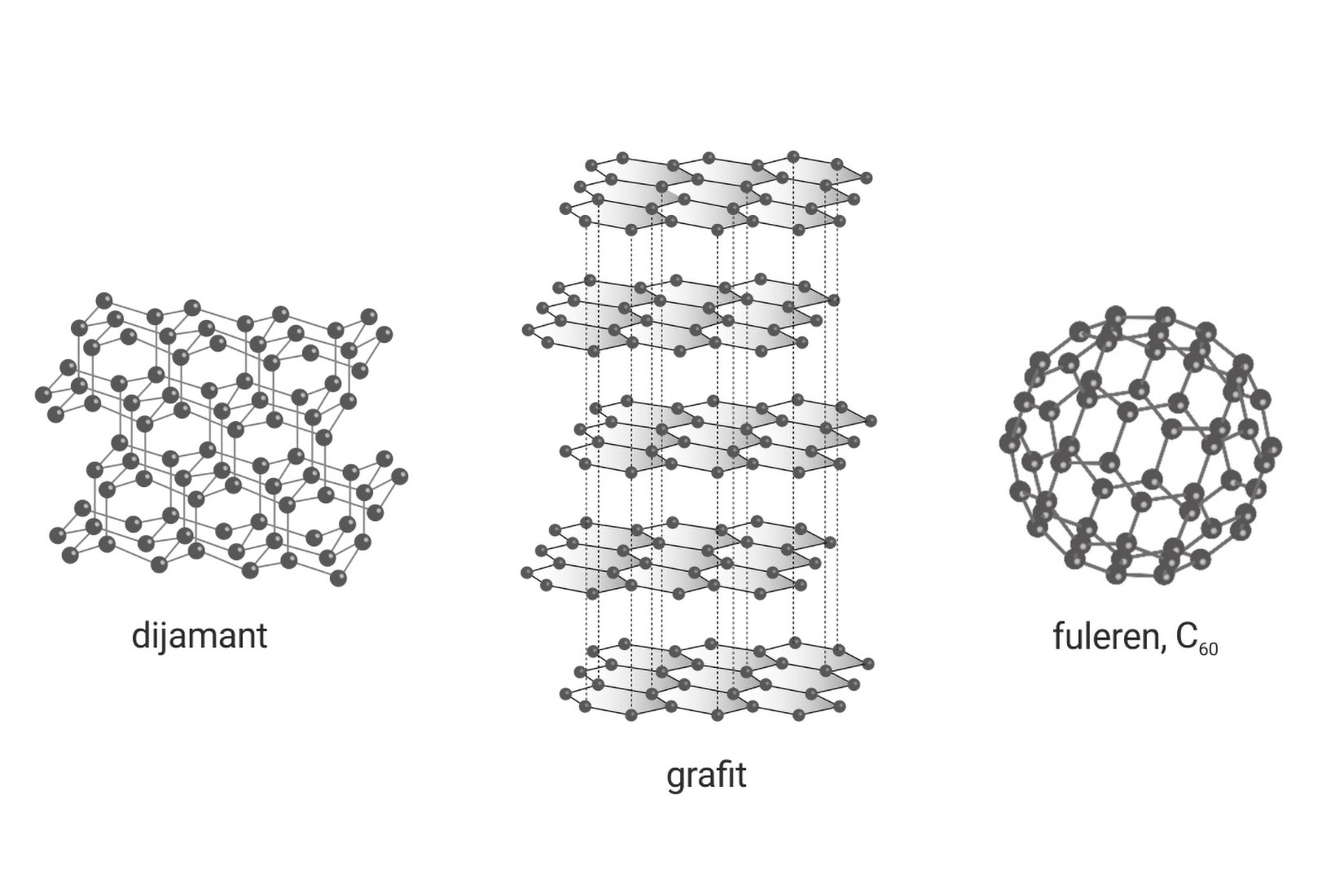
Poznato vam je da su dijamant, grafit i fuleren tri različite tvari građene od istovrsnih atoma, atoma ugljika. Različita svojstva tih tvari posljedica su različitog vezivanja atoma ugljika, odnosno različitog rasporeda atoma ugljika u prostoru.
Zbog čega se atomi povezuju?
Spajanjem devedesetak kemijskih elemenata nastaje neizmjerno mnogo različitih kemijskih spojeva.
Prilikom povezivanja atoma u molekulu
nastaju kemijske veze i oslobađa se energija.
Energija nastale molekule niža je od energije atoma od kojih je nastala.
Manji sadržaj energije znači veću stabilnost.
Prvu ideju o razlozima nastajanja kemijskih veza dao je Gilbert Lewis.
Nastajanje stabilnije elektronske konfiguracije
smatrao je razlogom kemijskog vezivanja atoma.
Danas znamo da to objašnjenje nije dobro jer ne uzima u obzir energiju.
Kemijska veza između atoma nastaje onda
kada vanjski rubovi atoma dođu u kontakt.
Zbog toga se u poučavanju kemijskog vezivanja
najveća pozornost poklanja valentnim elektronima.
Lewis je predložio simbolički sustav koji omogućuje
prikaz kemijskih reakcijai uvid ubroj valentnih elektrona.
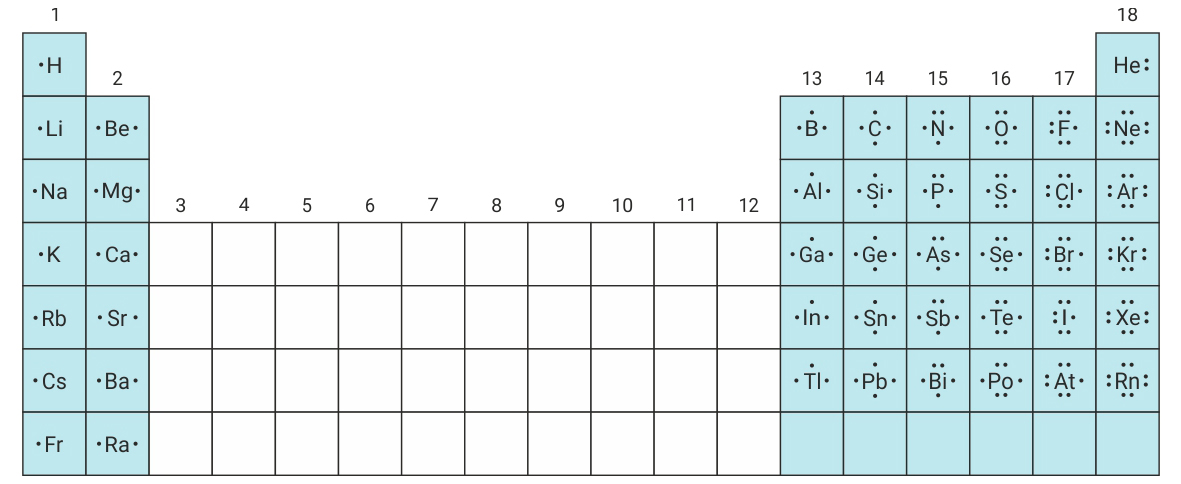
Lewisov simbol sastavljen je od simbola kemijskog elementa i točkica.
Tako atom klora ima sedam valentnih elektorna.
Oko simbola atoma klora crtamo sedam točkica.
Zbog čega se atomi povezuju?
Spajanjem devedesetak kemijskih elemenata nastaje neizmjerno mnogo različitih kemijskih spojeva. Prilikom povezivanja atoma u molekulu, odnosno nastajanja kemijske veze, oslobađa se energija. Stoga je energija nastale molekule niža od energije atoma od kojih je nastala. Manji sadržaj energije znači veću stabilnost.
Prvu ideju o razlozima nastajanja kemijskih veza dao je Gilbert Lewis. Nastajanje stabilnije elektronske konfiguracije vidio je razlogom kemijskog vezivanja atoma. Danas znamo da to objašnjenje nije dobro jer ne uzima u obzir energiju.
Kemijska veza između atoma nastaje onda kada vanjski rubovi atoma dođu u kontakt. Zbog toga se u proučavanju kemijskog vezivanja najveća pozornost poklanja valentnim elektronima.
Lewis je predložio simbolički sustav koji omogućuje prikaz kemijskih reakcija i uvid u broj valentnih elektrona. Lewisov simbol sastavljen je od simbola kemijskog elementa i točkica.
Primjerice, atom klora, tako ima sedam valetnih elektrona pa oko simbola atoma klora crtamo sedam točkica.
Simbol kemijskog elementa označava jezgru i unutarnje elektrone atoma tog elementa. Točkice, raspoređene oko simbola kemijskog elementa, predstavljaju valentne elektrone.
Nastajanje kovalentne veze između dva atoma nemetala
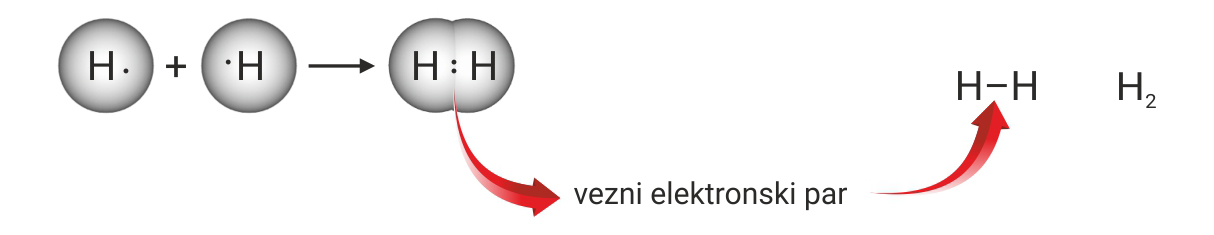
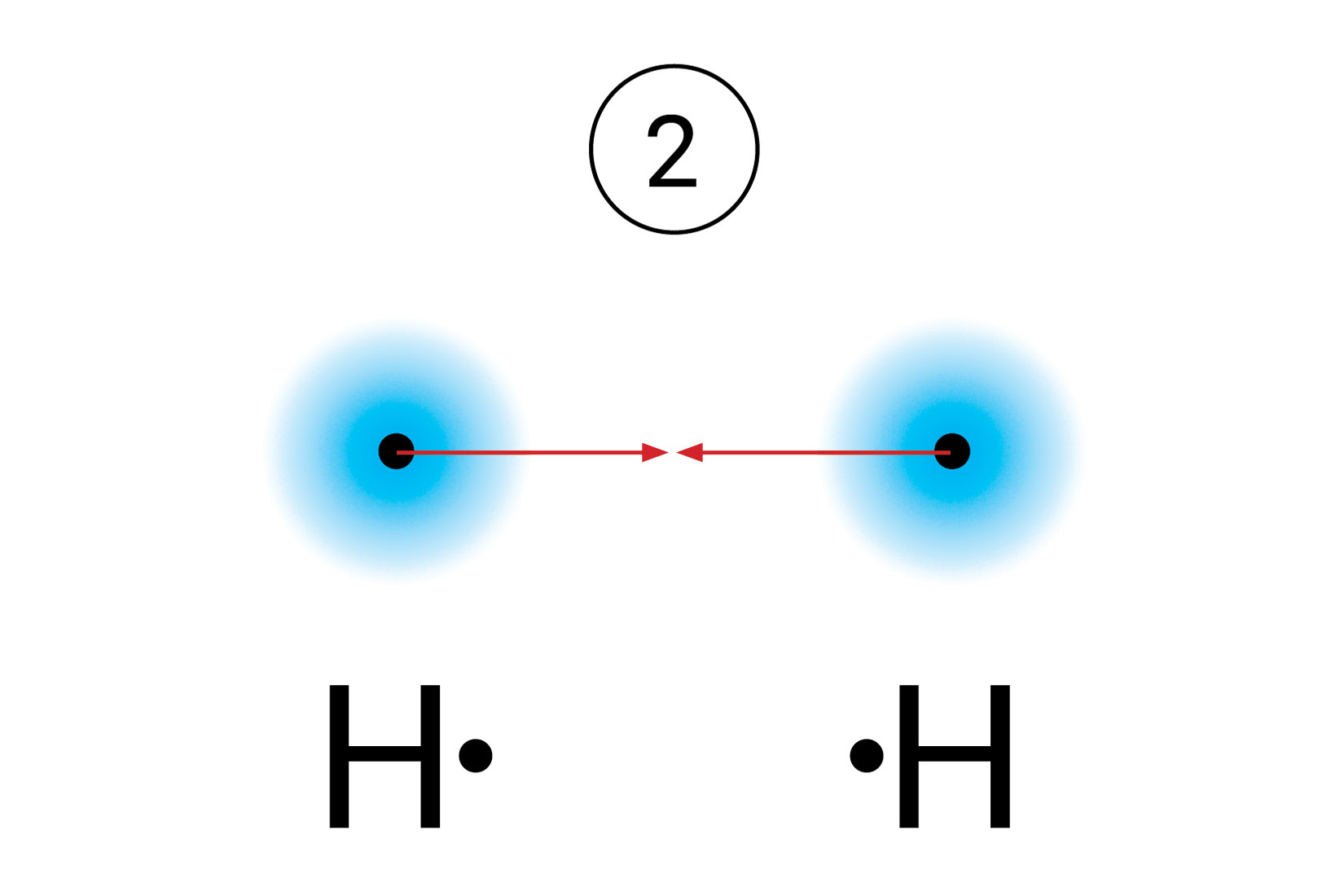
Kada se vodikovi atomidovoljno približe,
obje jezgre istovremenoprivlače njihove elektrone.
Najveća je vjerojatnost da će se oba elektrona naći između jezgara.
Zamisli da ti elektroni formiraju par
kojeg podjednako privlače jezgre obaju atoma.
S obzirom da taj par povezuje atome u molekuli, nazivamo ga vezni par.
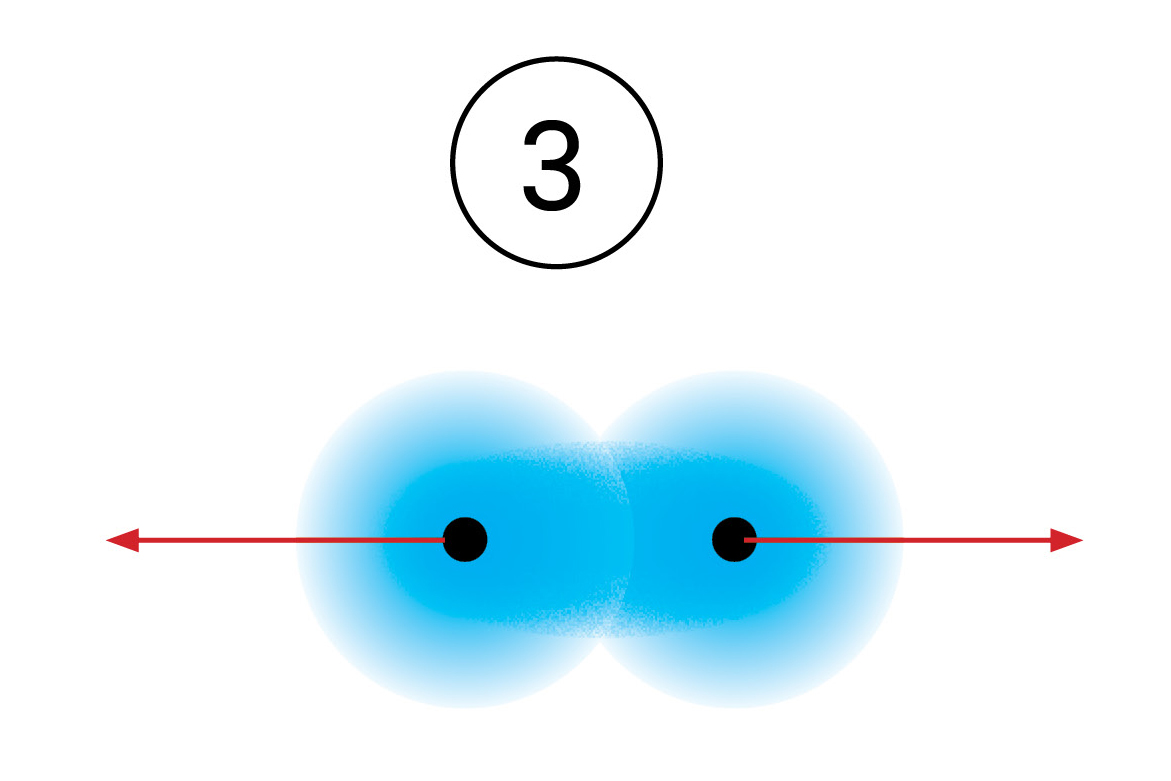
Vezni par simbolizira kemijsku vezu.
Vezni se par Lewisovim oznakama prikazuje dvjema točkicama.
U strukturnim se formulama prikazuje crticom.
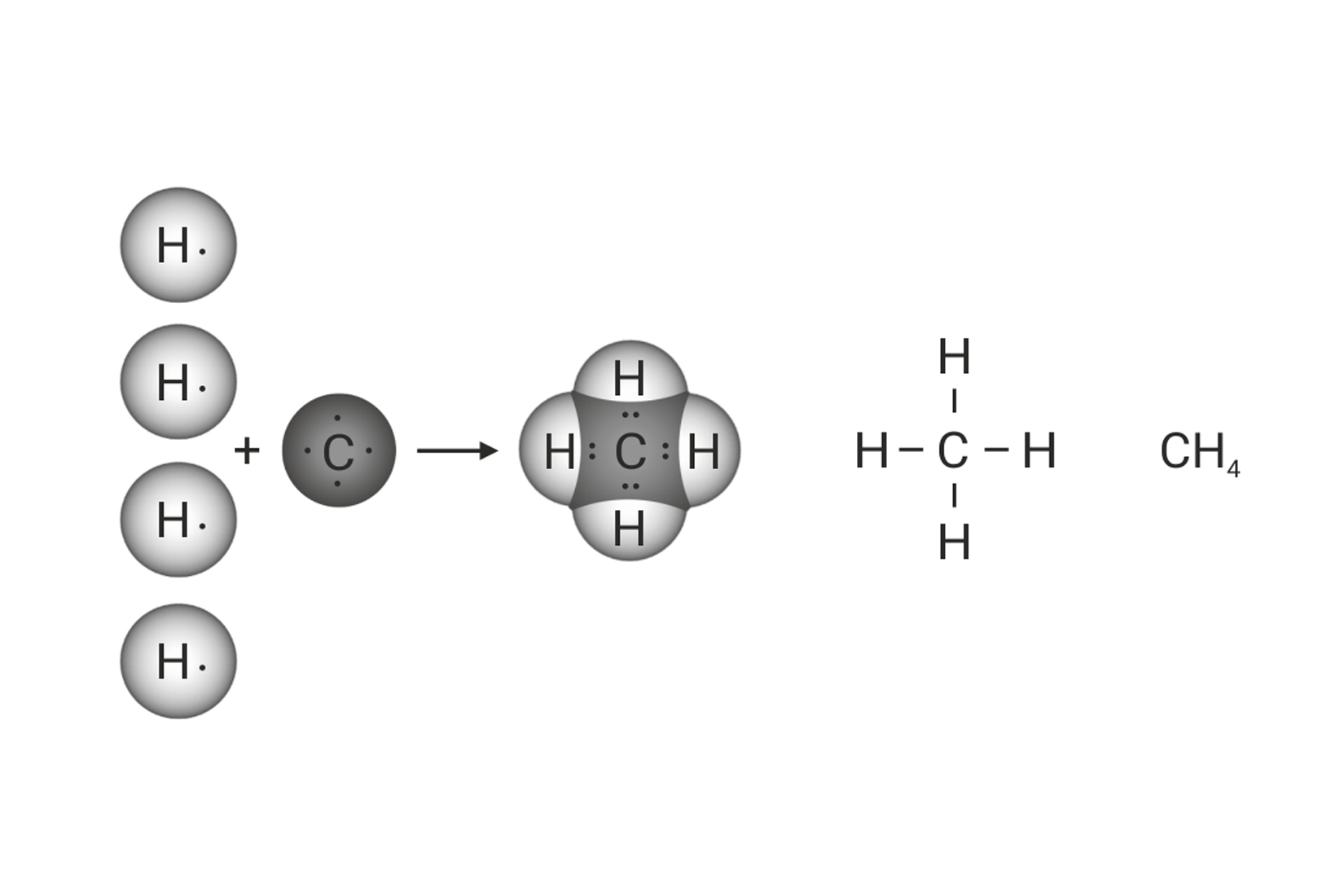
Zamišljeni model kemijske veze prema kojemu atomi dijele
vezni elektronski par, nazvan je kovalentnom vezom.
Ako atomi dijele jedan elektronski par,
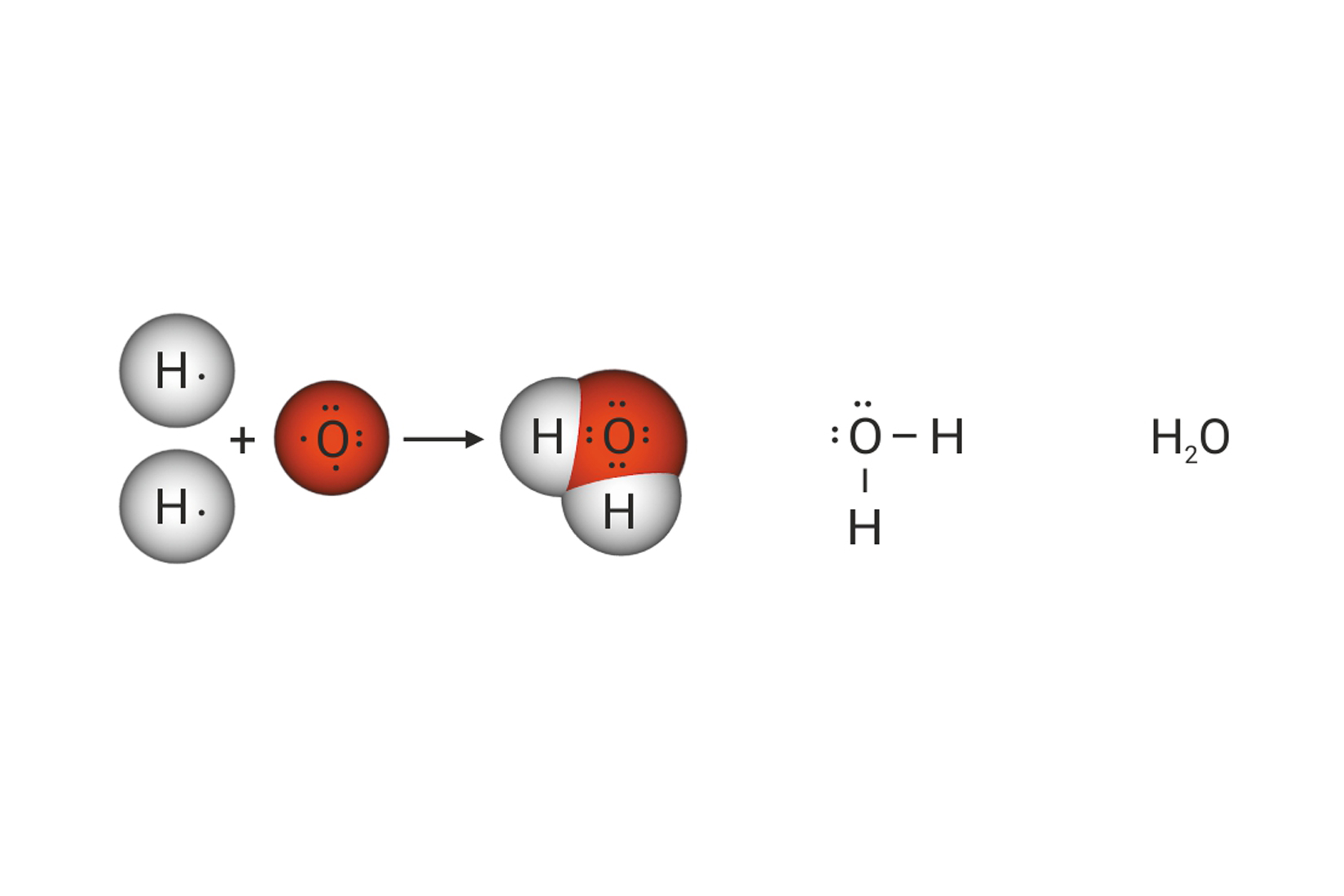
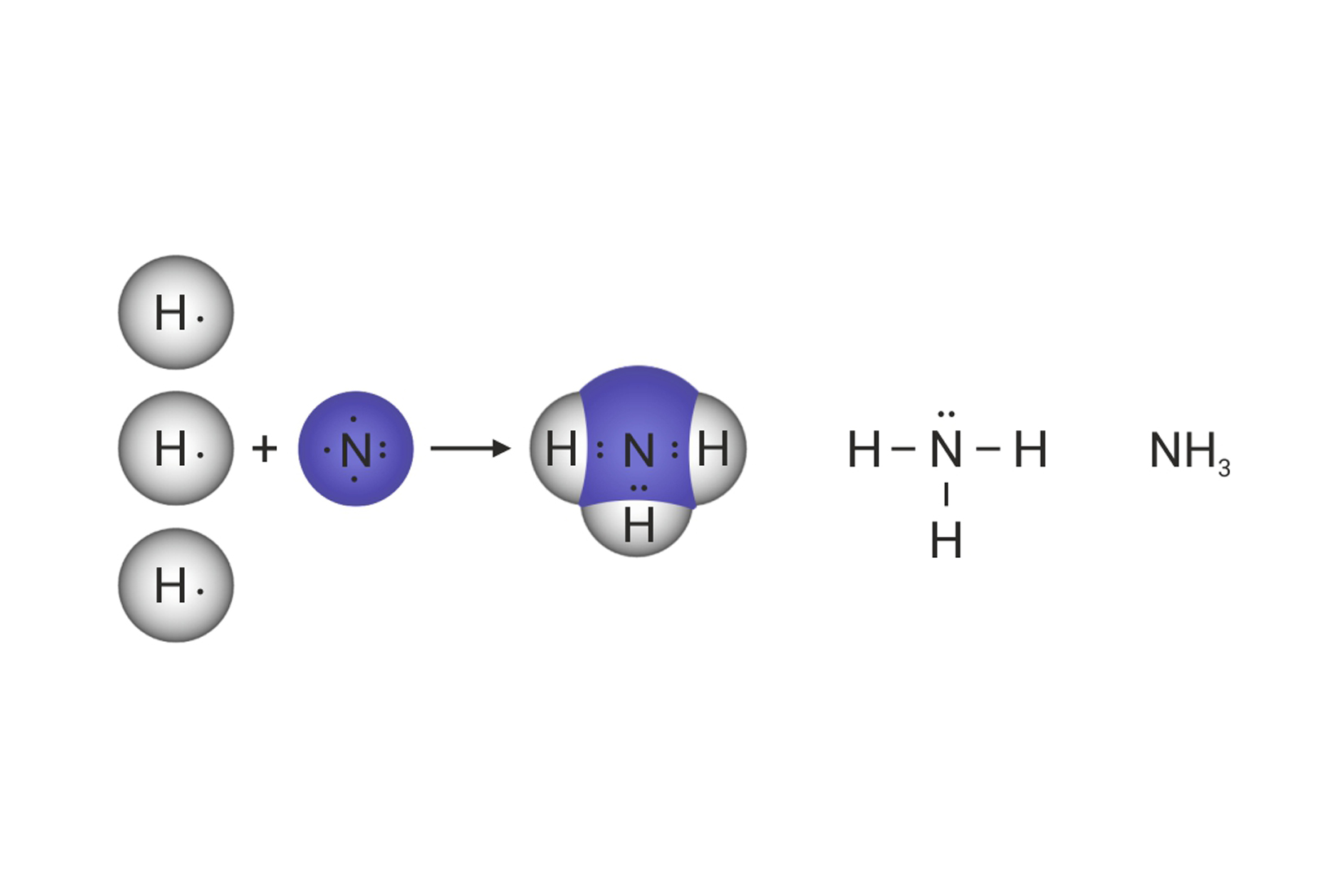
Kada se vodikovi atomi dovoljno približe, obje jezgre istovremeno privlače njihove elektrone. Stoga je najveća vjerojatnost da će se oba elektrona naći između jezgara. Može se zamisliti da te elektrone podjednako privlače jezgre obaju atoma. S obzirom da taj par elektrona povezuje atome u molekuli, nazivamo ga vezni par. On simbolizira kemijsku vezu. Vezni se par Lewisovim oznakama prikazuje dvjema točkicama. U strukturnim se formulama prikazuje crticom.
Zamišljeni model kemijske veze prema kojemu atomi dijele vezni elektronski par, nazvan je kovalentnom vezom. Ako atomi dijele jedan elektronski par,
Kako se međusobno povezuju atomi klora, kisika i dušika?
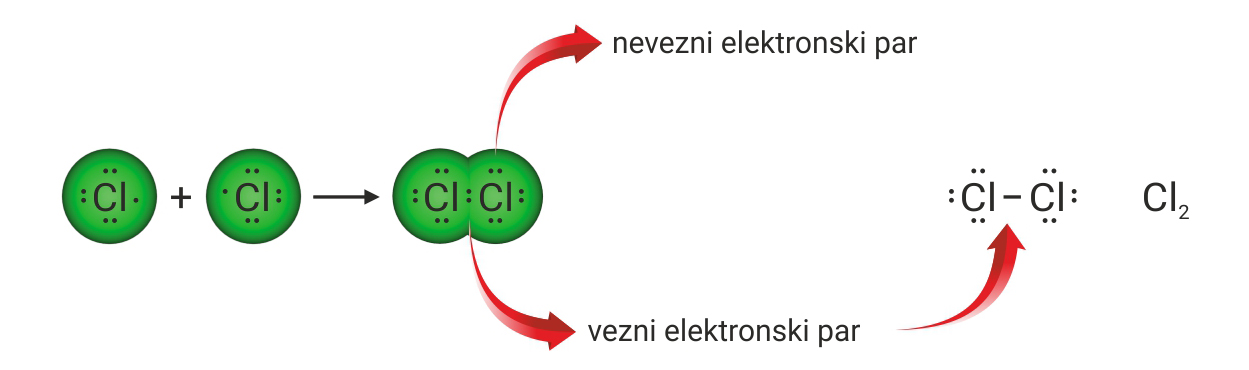
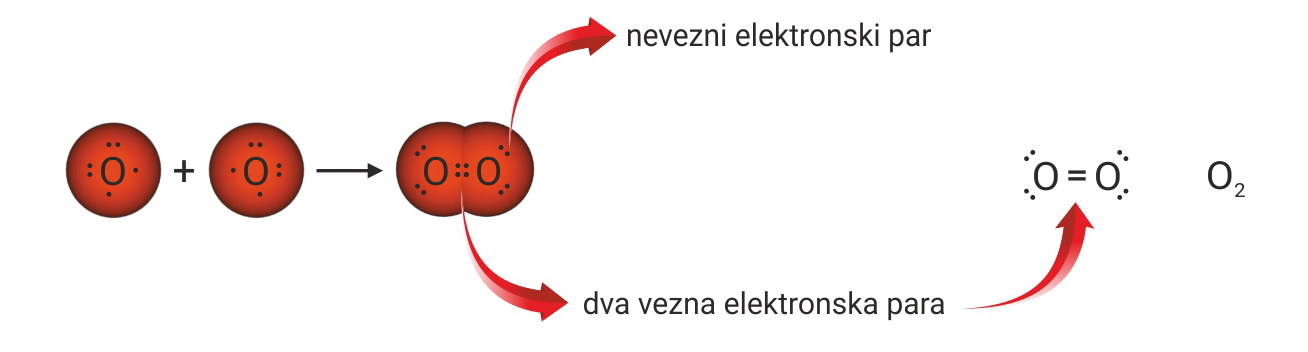
Povezivanjem nesparenih elektrona dvaju atoma klora nastaje molekula klora. S obzirom da atomi klora dijele samo jedan elektronski par, vezu među njima nazivamo jednostrukom kovalentnom vezom.
U strukturnoj formuli molekule klora vezni par prikazuje se crticom, a nevezni parovi točkicama.
Budući da atomi kisika imaju dva nesparena elektrona, u molekuli kisika je dvostruka kovalentna veza.
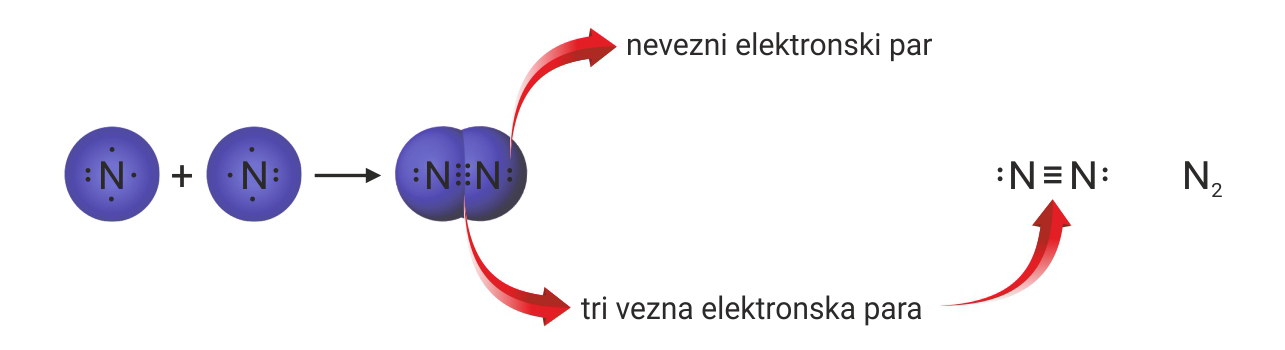
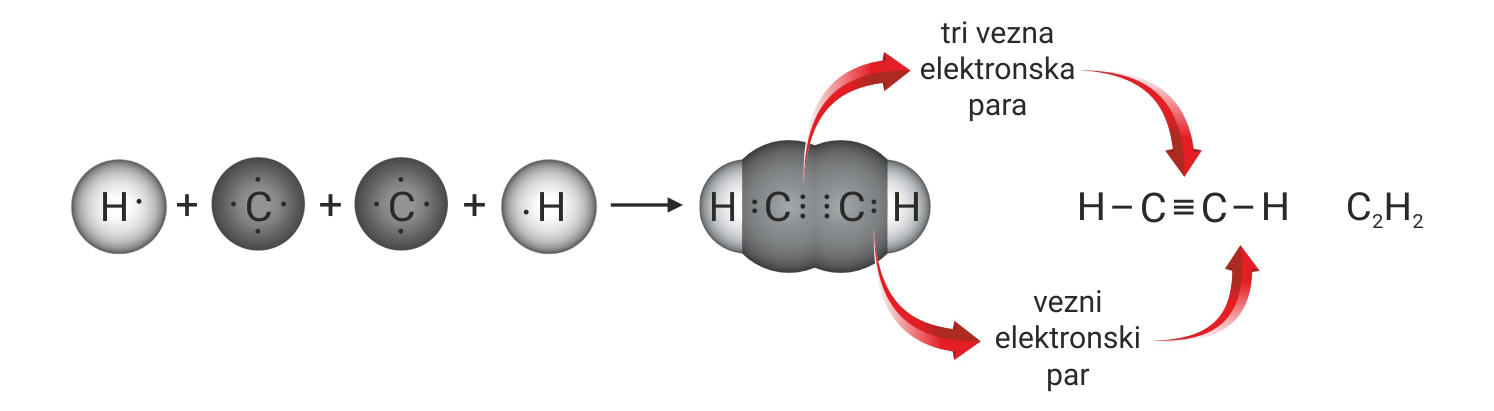
Zbog tri nesparena elektrona atoma dušika, u molekuli dušika je trostruka kovalentna veza.
Kako se međusobno povezuju raznovrsni atomi?
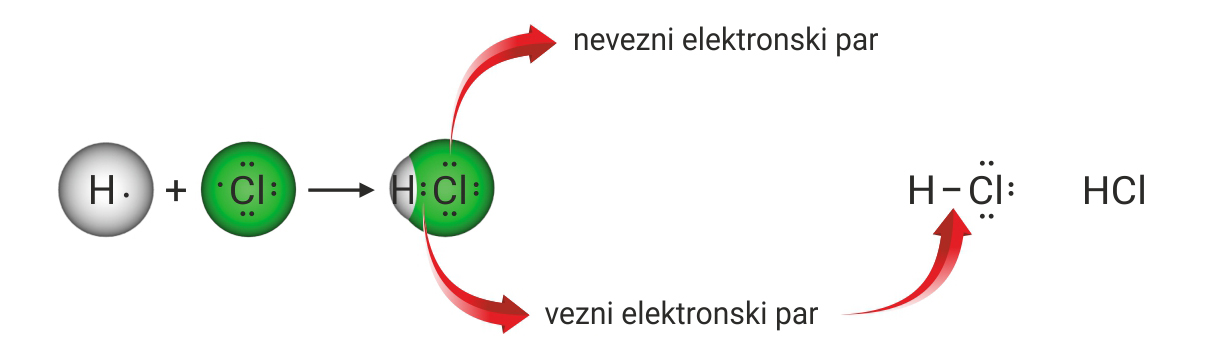
Atomi vodika i klora imaju po jedan nespareni elektron, prema tome veza u molekuli klorovodika je jednostruka kovalentna veza.
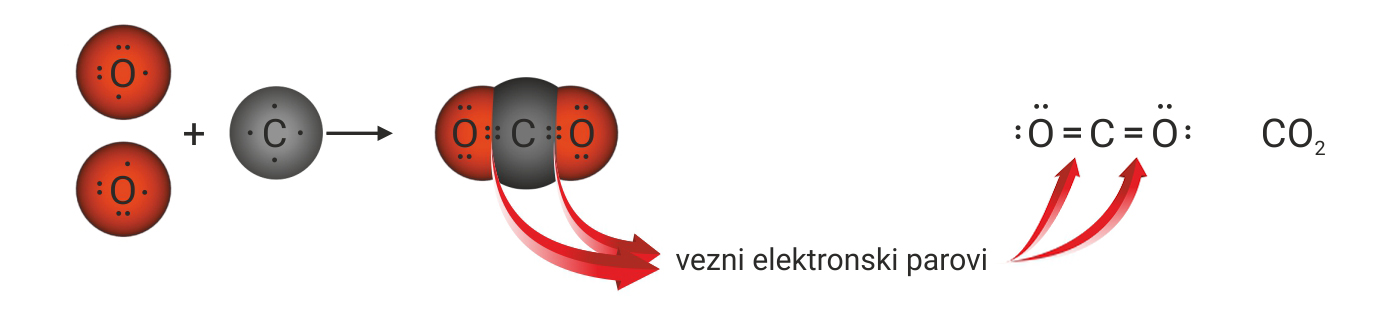
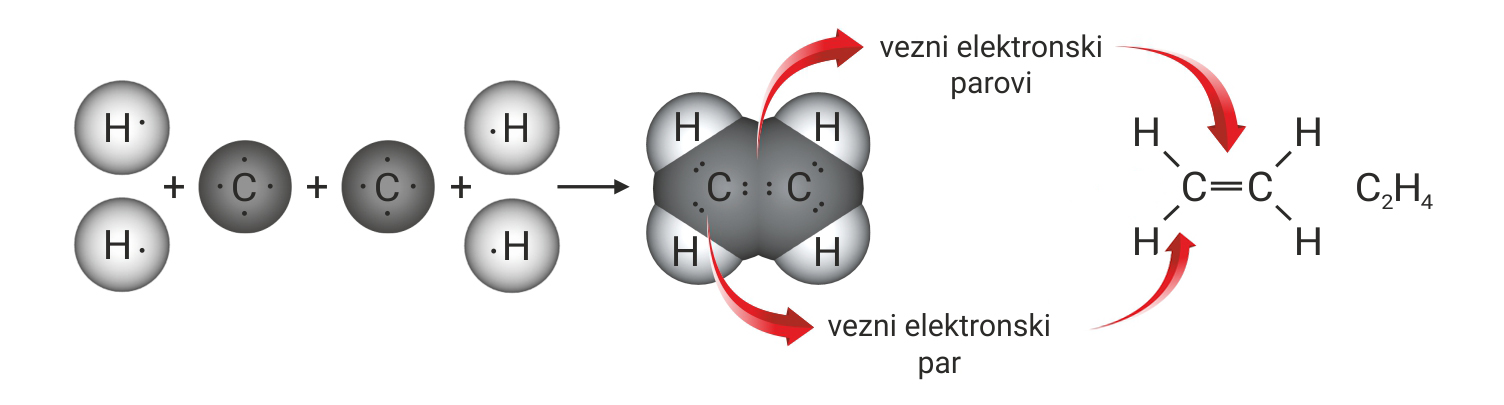
Budući da atom ugljika ima četiri nesparena elektrona u valentnoj ljusci, a atom kisika samo dva, njihovim će povezivanjem nastati dvije dvostruke kovalentne veze između atoma ugljika i kisika.
Atomi ugljika u molekuli etena povezani su dvostrukom kovalentnom vezom.
U molekuli etina, atomi ugljika povezani su trostrukom kovalentnom vezom.
Razmještaj elektronskih parova oko središnjeg atoma
ovisi o broju njegovih veznih i neveznih elektronskih parova.
Istoimeni se električni naboji međusobno odbijaju.
Prostorna građa molekula ovisi o odbojnim silama
između veznih i neveznih elektronskih parova.
Jakost odbojnih sila između veznih elektronskih parova je najslabija.
Između neveznih parova je najjača.
Razmještaj elektronskih parova oko središnjeg atoma ovisi o broju njegovih veznih i neveznih elektronskih parova. Poznato je da se istoimeni električni naboji međusobno odbijaju.
Prostorna građa molekula ovisi o odbojnim silama između veznih i neveznih elektronskih parova. Jakost odbojnih sila između veznih elektronskih parova je najslabija, a između neveznih parova je najjača.
Prostorni raspored veznih i neveznih elektronskih parova u molekulama
Pogledajte animacije koje prikazuju prostorni raspored neveznih i veznih elektronskih parova u molekulama vode, amonijaka i metana. Što možete zaključiti o usmjerenosti kovalentne veze i građi tih molekula?
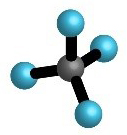
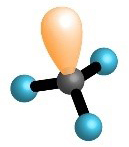
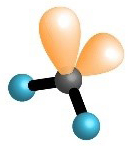
Oko središnjeg atoma ukupan broj veznih i neveznih parova, u molekulama metana, amonijaka i vode je četiri. Na taj su način atomi ugljika, dušika i kisika, u navedenim molekulama, postigli oktetnu konfiguraciju plemenitog plina.
| 14 | 15 | 16 | 17 |
|---|---|---|---|
 |
 |
 |
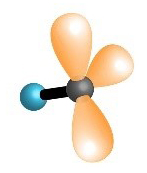 |
| , metan | , amonijak | , voda | , fluorovodik |
| , silan | , fosfin | , sumporovodik | , klorovodik |
| , german | , arsin | , selenovodik | , bromovodik |
| , stanan | , stibin | , telurovodik | , jodovodik |
| , plumban | , bizmutin |
Odstupanje od pravila okteta
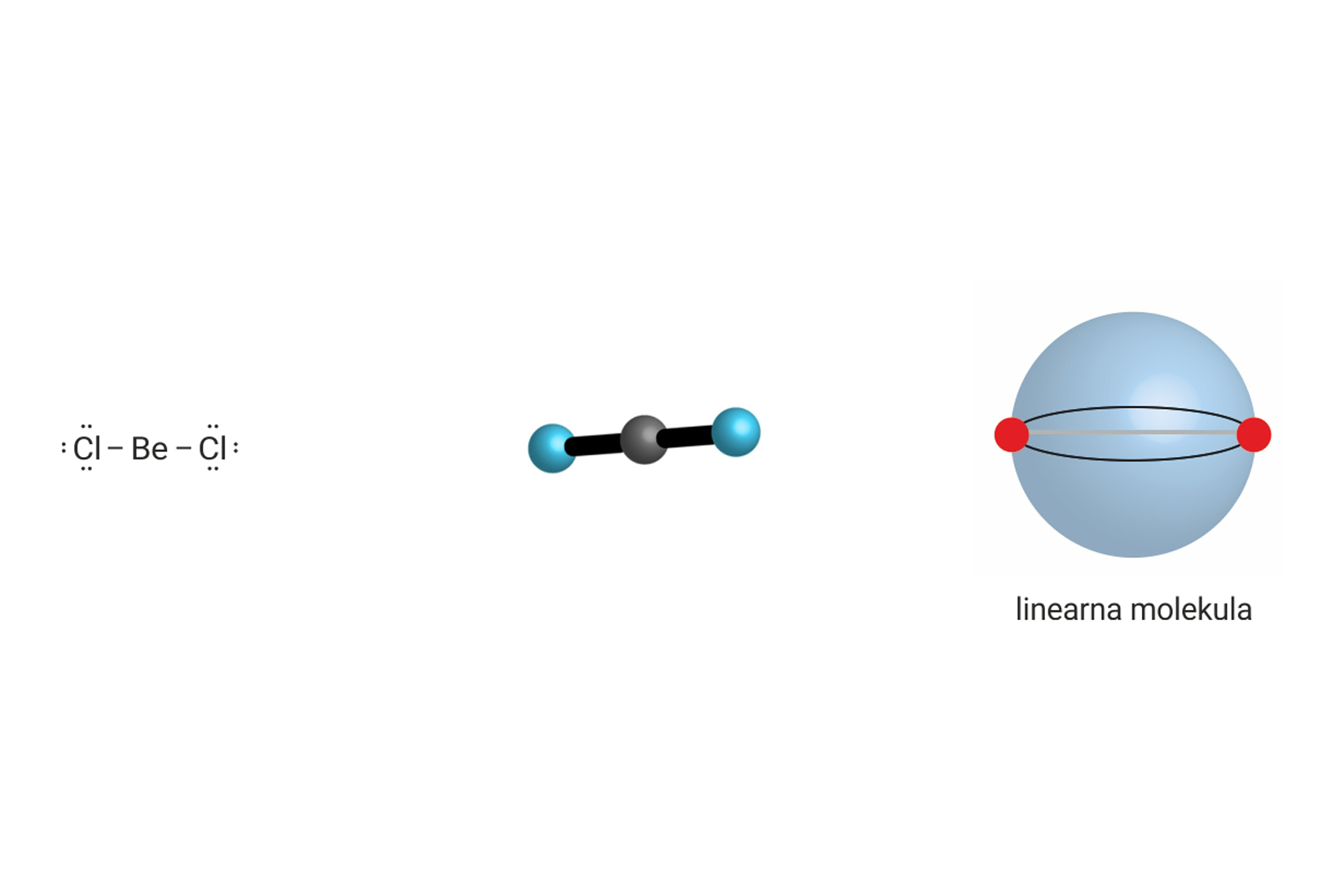
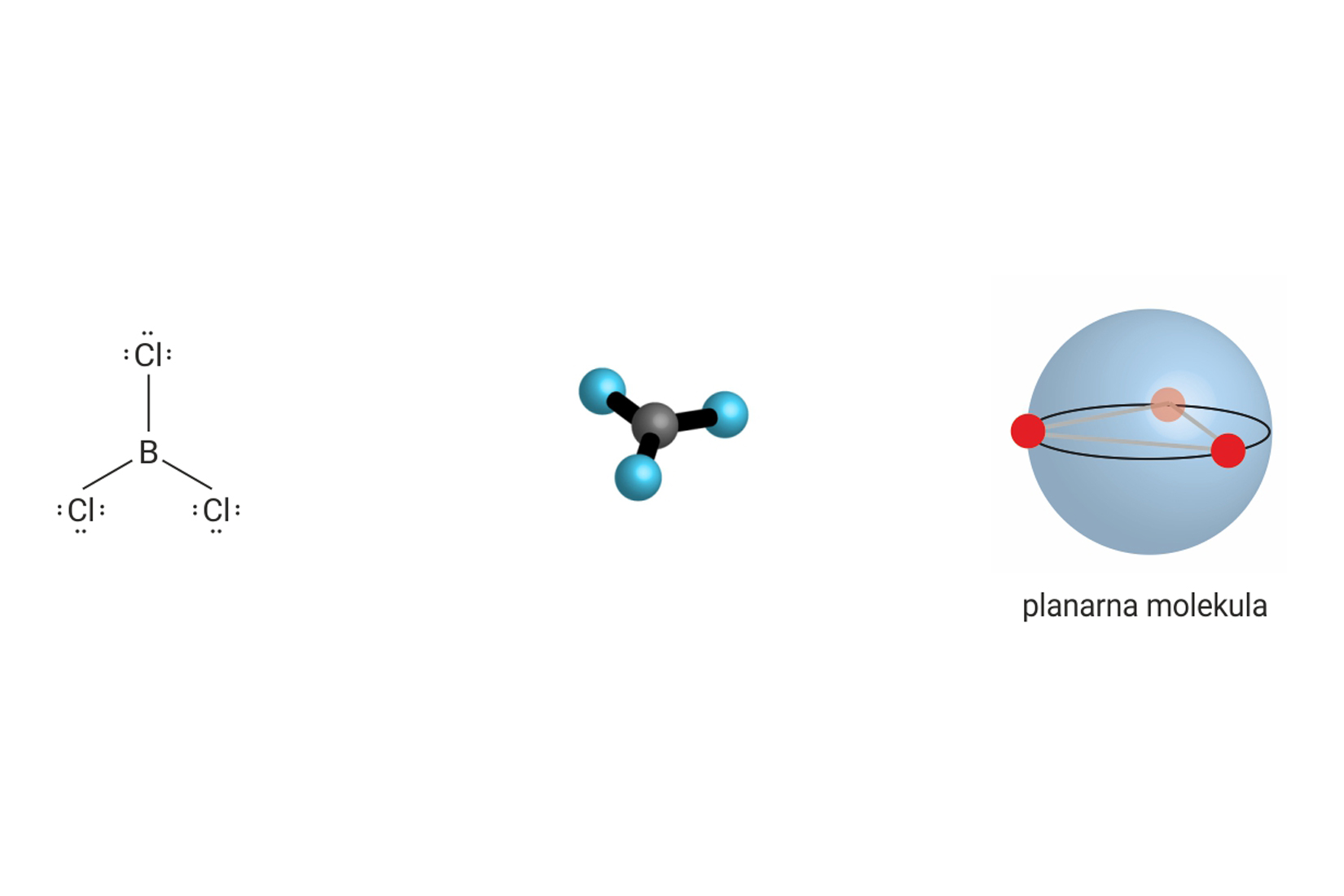
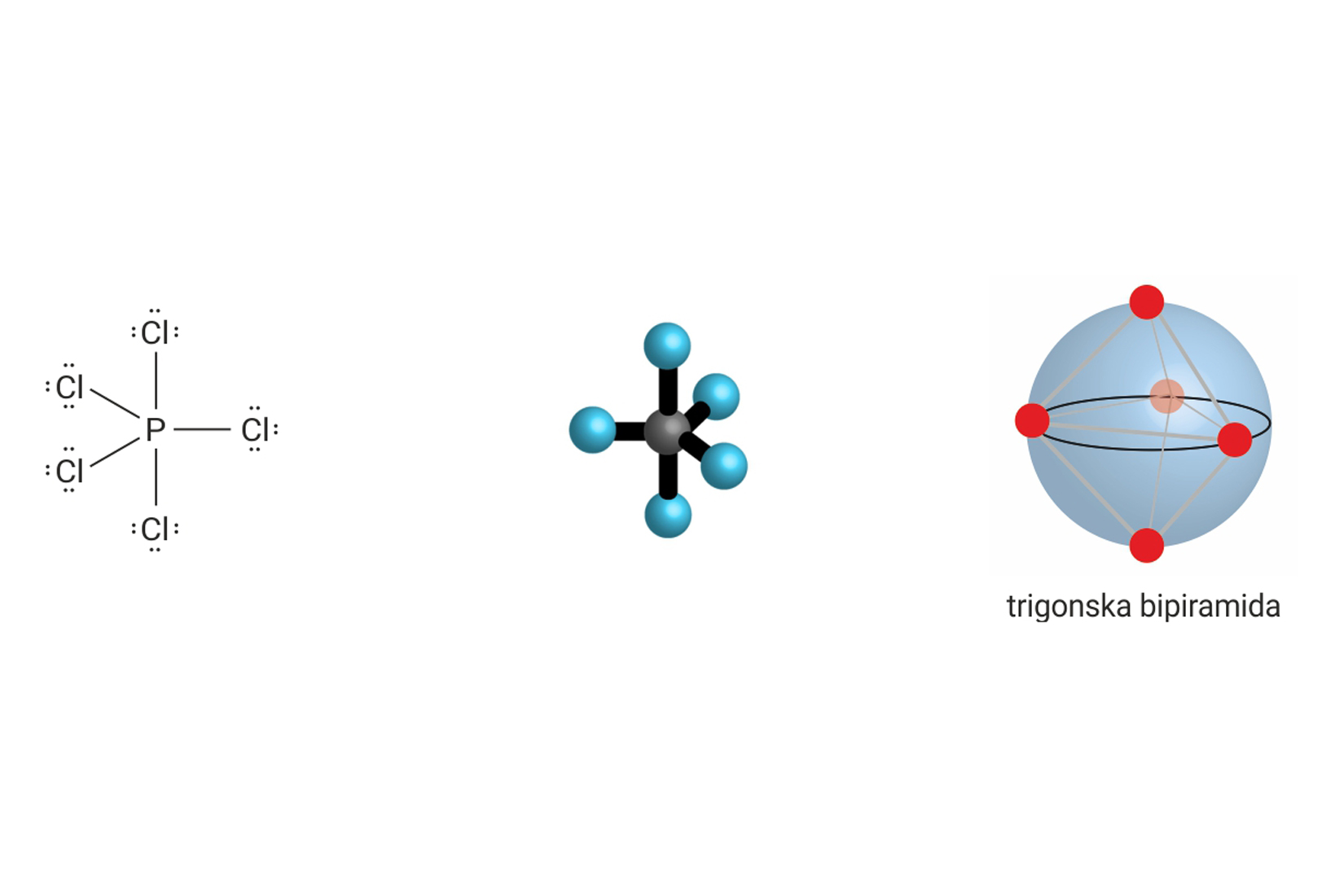
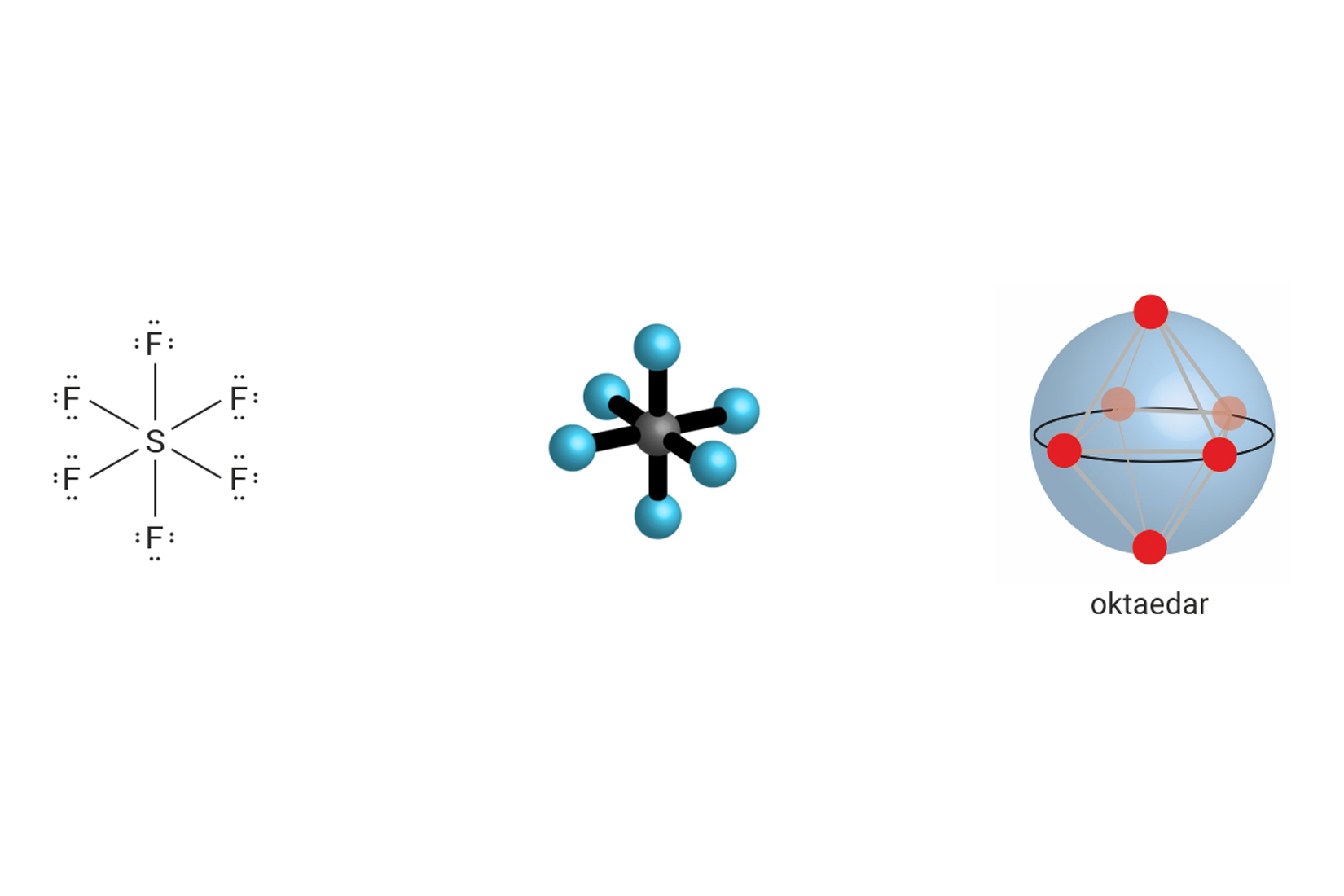
Ukupan broj veznih i neveznih parova oko središnjeg atoma u molekuli, može biti manji ili veći od četiri. Tada središnji atom ne postiže elektronsku konfiguraciju plemenitog plina, te se na njega ne primjenjuje pravilo okteta.
Prostorna građa molekule uvjetovana je odbijanjima elektronskih parova. Ona se određuje uz pomoć VSEPR-modela (valence shell electron pair repulsion ). Prema tom modelu, molekula ima onaj oblik u kojemu su elektrostatska odbijanja elektronskih parova oko središnjeg atoma minimalizirana (najmanja).
| broj elektronskih parova | prostorni raspored atoma u molekuli | oblik molekule i kutovi među vezama | opća formula i primjer | ||
|---|---|---|---|---|---|
| vezni | nevezni | ukupan | |||
| 5 | 0 | 5 | 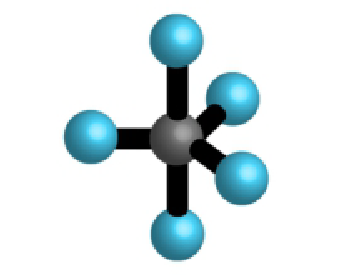 |
trostrana bipiramida 90°, 120°, 180° | , , , |
| 4 | 1 | 5 | 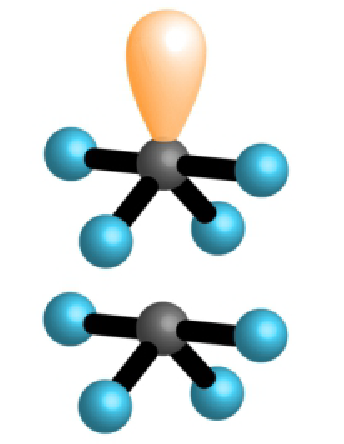 |
poput ljuljačke 90°, 120°, 180° | |
| 3 | 2 | 5 | 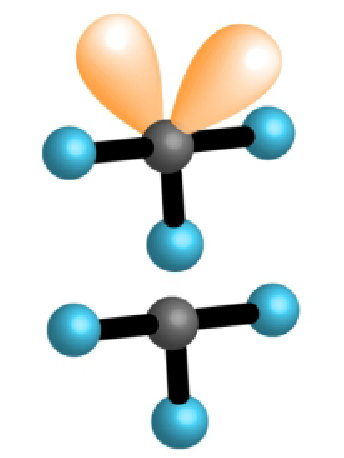 |
T oblik 90°, 180° |
, |
| 2 | 3 | 5 | 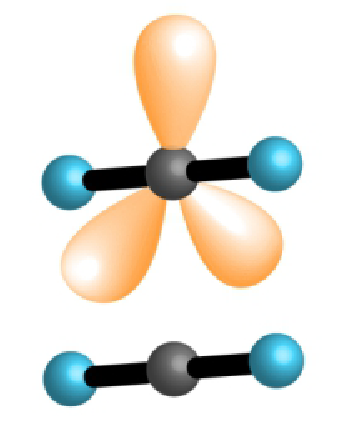 |
linearni 90°, 120°, 180° |
, , |
| 6 | 0 | 6 | 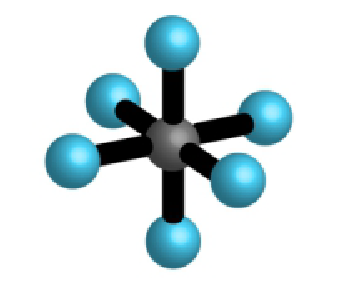 |
oktaedar 90°, 180° |
, , |
| 5 | 1 | 6 | 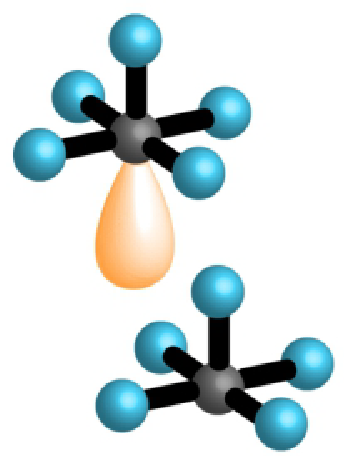 |
kvadratna piramida 90°, 80° | |
| 4 | 2 | 6 | 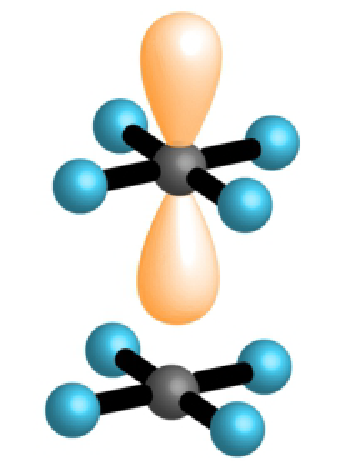 |
kvadratni 90°, 180° |
|
Valencije atoma u molekulama
Valencija atoma je određena brojem elektrona koje atom daje za stvaranje veznih elektronskih parova.
U sljedećim spojevima odredite valenciju atoma.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Kako nacrtati strukturnu formulu molekule sumporne kiseline ?
Za crtanje strukturnih formula složenijih molekula vrijede određena pravila:
1.Odredi ukupan broj valentnih elektrona u molekuli ili ionu.
2.Atome složi u “kostur” molekule:
-atomi vodika uvijek su periferni ili krajni atomi
-oni se mogu vezati samo jednostrukom kovalentnom vezom
-središnji atom od preostalih je onaj čiji je koeficijent elektronegativnosti najmanji
Za to povezivanje utrošio se određeni broj elektrona.
Oduzmi ga od ukupnog broja valentnih elektrona.
3.Preostale valentne elektrone treba povezati jednostrukom kovalentnom vezom.
Za to povezivanje utrošio se određeni broj elektrona.
Taj broj oduzmi od ukupnog broja valentnih elektrona.
Rrasporedi kao nevezne elektronske parove do okteta elektronegativnijim atomima.
4. Provjeri jesu li svi atomi postigli
odgovarajuću konfiguraciju plemenitog plina (dublet, oktet).
Ako središnji atom nije postigao oktet, pomoću neveznih parova
s perifernog/perifernih atoma formiraj višestruke veze do postizanja okteta.
5. Provjeri odgovara li broj veznih parova valenciji središnjeg atoma.
Kako nacrtati strukturnu formulu složenijih molekula?
Za crtanje strukturnih formula složenijih molekula vrijede određena pravila:
1. Potrebno je odrediti ukupan broj valentnih elektrona u molekuli ili ionu.
2. Atome treba složiti u “kostur” molekule:
– atomi vodika uvijek su periferni ili krajni atomi jer se mogu vezati samo jednostrukom kovalentnom vezom
– središnji atom od preostalih je onaj čiji je koeficijent elektronegativnosti najmanji
3. Preostale atome treba povezati jednostrukom kovalentnom vezom sa središnjim atomom. Za to povezivanje utrošio se određeni broj elektrona, koji treba oduzeti od ukupnog broja valentnih elektrona. Preostale valentne elektrone potrebno je rasporediti kao nevezne elektronske parove do okteta elektronegativnijim atomima.
4. Potrebno je provjeriti jesu li svi atomi postigli odgovarajuću konfiguraciju plemenitog plina (dublet, oktet). Ako središnji atom nije postigao oktet, tada je potrebno pomoću neveznih parova s perifernog/perifernih atoma formirati višestruke veze do postizanja okteta.
5. Potrebno je provjeriti odgovara li broj veznih parova valenciji središnjeg atoma. Primjerice, u molekuli sumporne kiseline, temeljem (poznavanja) valencija atoma vodika i kisika, možete zaključiti da je atom sumpora šeseterovalentan.
Kako nacrtati strukturnu formulu molekule sumporne kiseline?
1. Odredi se ukupan broj valentnih elektrona u molekuli sumporne kiseline.
2. Da bi se nacrtao kostur molekule:
- atom sumpora, budući da ima manji koeficijent elektronegativnosti od atoma kisika, crta se kao središnji atom
- na atom sumpora jednostrukim kovalentnim vezama vežu se četiri atoma kisika
- atomi vodika vežu se jednostrukim kovaletnim vezama na atome kisika
- za jednostruke kovalentne veze između atoma utrošilo se 12 elektrona
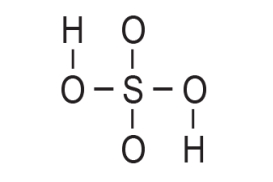
3. Preostalih 20 elektrona rasporedi se kao nevezne elektronske parove elektronegativnijim atomima, atomima kisika, do postizanja okteta.
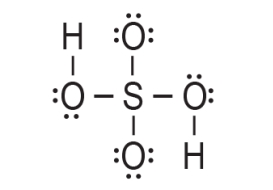
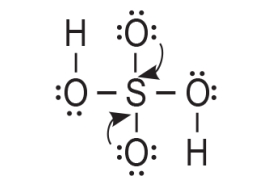
4. Atom sumpora je postigao oktet. Prema prethodnom prikazu on ostvaruje četiri veze. Međutim, valencija atoma sumpora u molekuli sumporne kiseline jest šest. To znači da atomu sumpora nedostaju još dvije veze. Stoga koristimo po jedan nevezni elektronski par s dva kisikova atoma za vezu sa atomom sumpora. Na taj način nastaju dvije dvostruke veze.
Najveći mogući broj veznih elektronskih parova jednak je broju elektrona u valentnoj ljuski središnjeg atoma u molekuli. Prema tome, ukupan broj veznih parova za središnji atom sumpora u molekuli sumporne kiseline je šest.
Šest valentnih elektrona atoma sumpora sudjeluje u stvaranju dvije jednostruke i dvije dvostruke kovalentne veze.
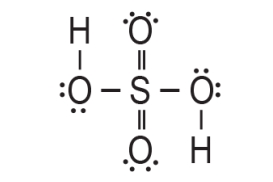
5. Oko središnjeg atoma sumpora nalaze se vezana četiri atoma kisika te su oni usmjereni prema vrhovima tetraedra.
To je samo jedan od načina kojima se može prikazati strukturnu formulu molekule sumporne kiseline.
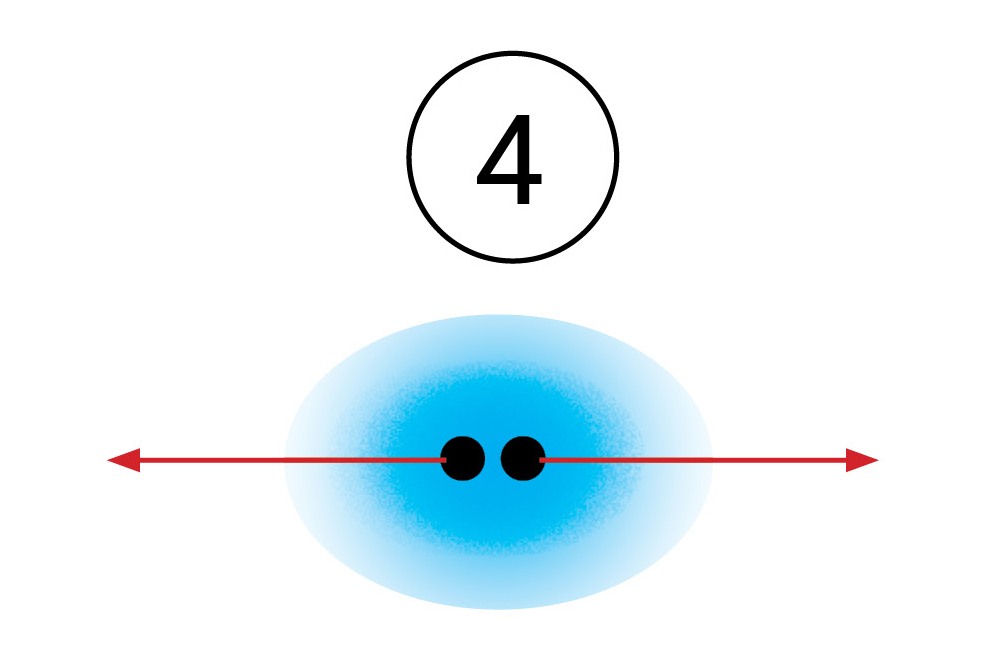
Duljina kovalentne veze i kovalentni polumjer
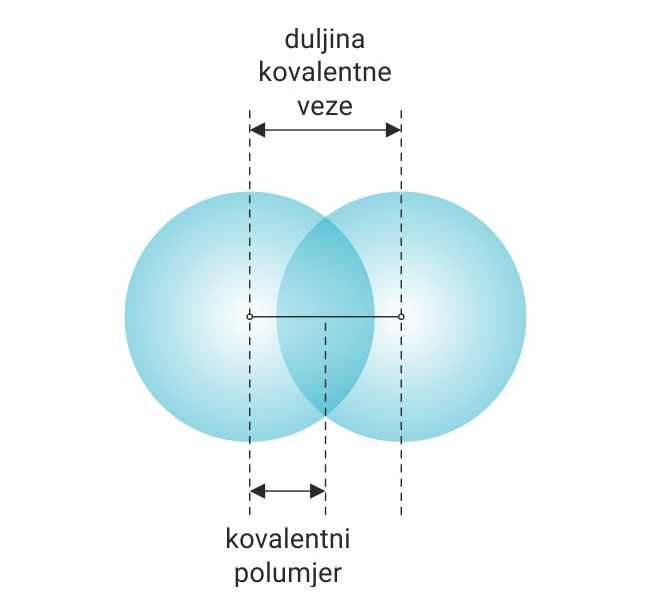
Gustoća elektronskog oblaka u dvoatomnoj molekuli je najveća između jezgara atoma, jer dolazi do djelomičnog preklapanja elektronskih oblaka vezanih atoma. Stoga je udaljenost između jezgara povezanih atoma uvijek manja od zbroja polumjera atoma.
Udaljenost između jezgara atoma povezanih kovalentnom vezom naziva se duljina kovalentne veze.
Ako su kovalentnom vezom povezani istovrsni atomi, onda je polovina udaljenosti između njihovih jezgara kovalentni polumjer.
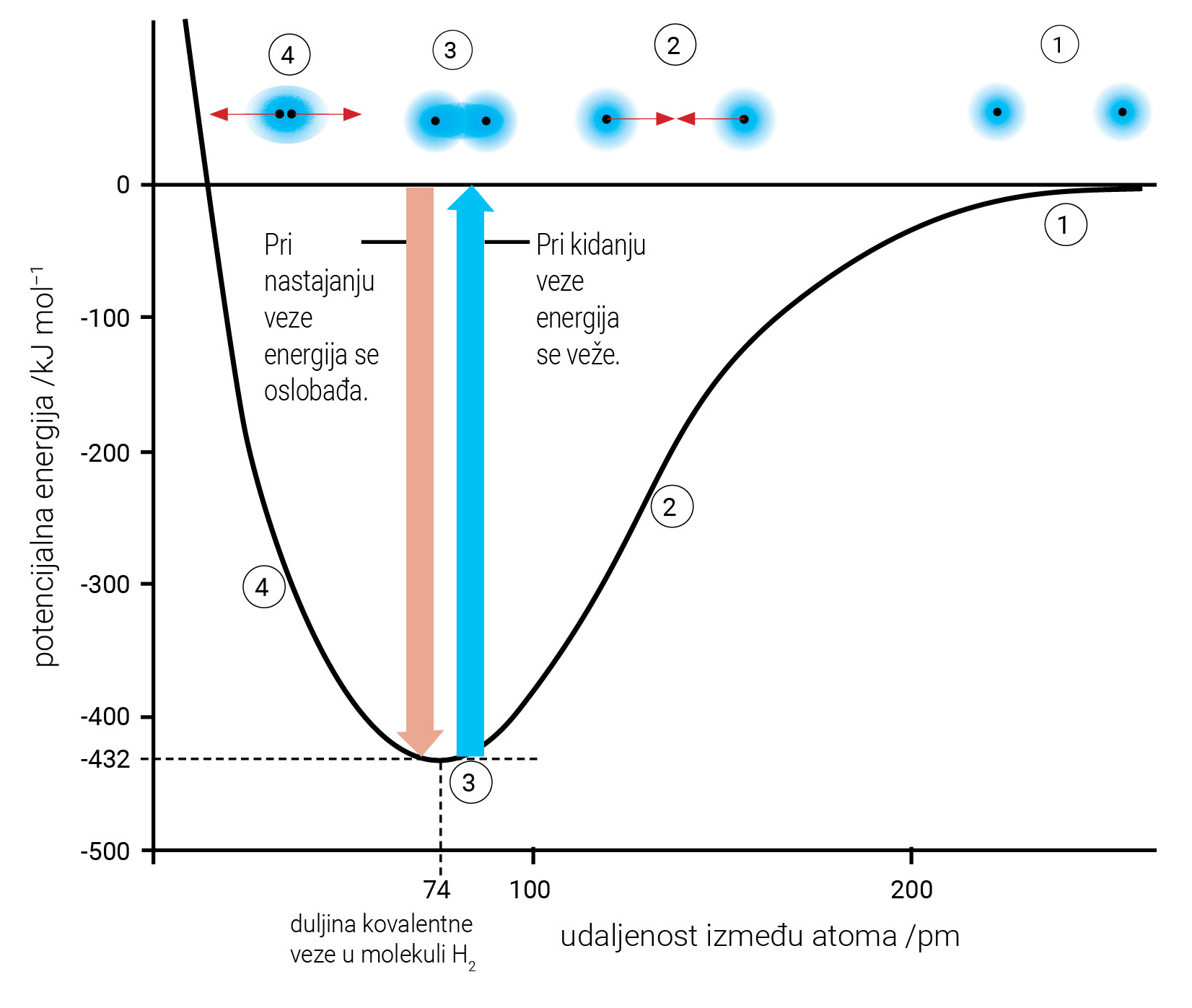
Energija potrebna da se kemijska veza između atoma tvari
u plinovitom stanju raskine, jest energija veze.
Svaka kemijska veza je određena duljinom i energijom veze.
Veza je jača što je duljina veze manja, a energija veze veća.
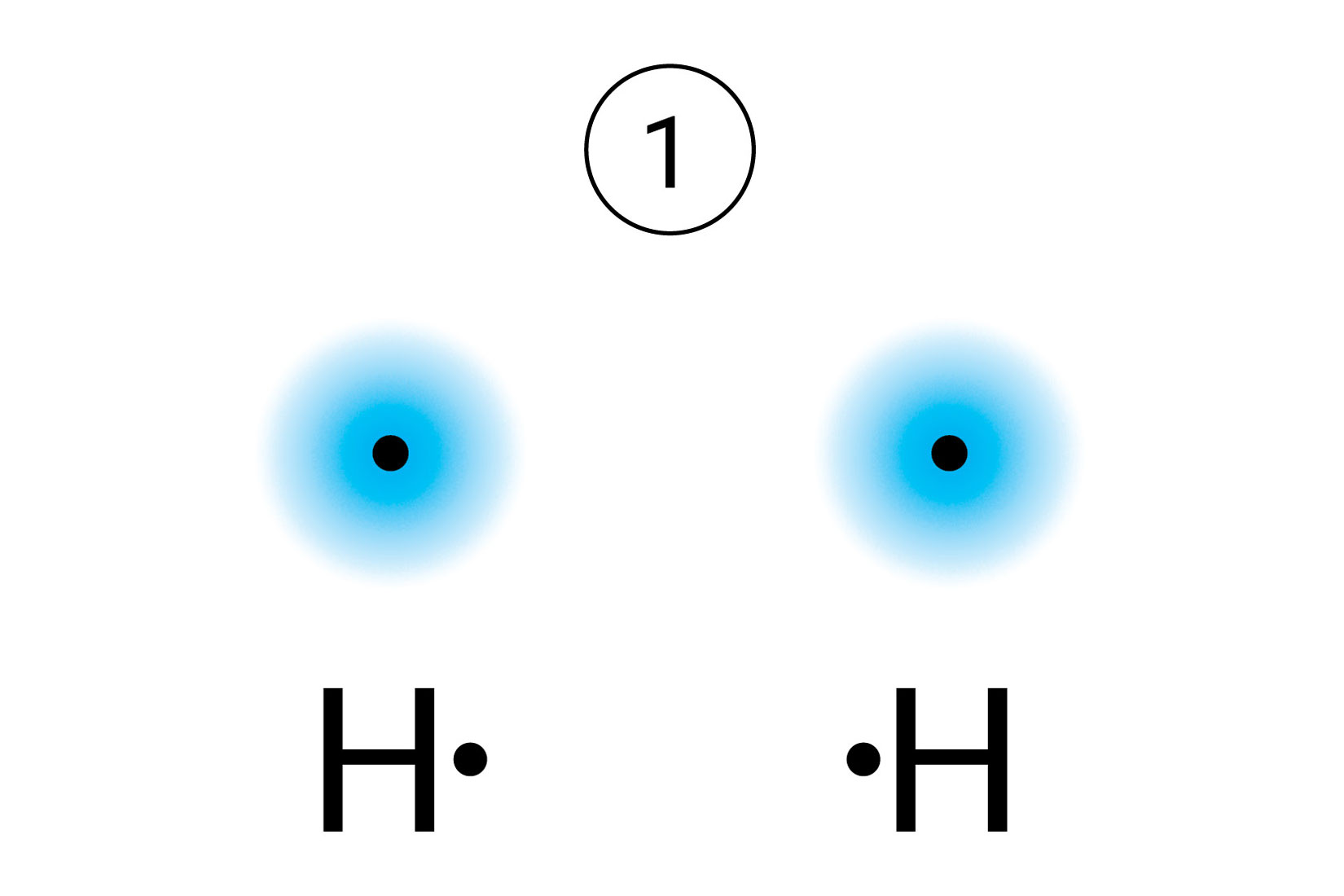
Što se događa kada se atomi vodika nađu dovoljno blizu?
Kada se dva atoma vodika međusobno povezuju u molekulu, smanjuje se energija sustava.
Energija potrebna da se kemijska veza između atoma tvari u plinovitom stanju raskine, jest energija veze.
Svaka je kemijska veza, određena duljinom i energijom veze. Veza je jača što je duljina veze manja, a energija veze veća.
Što se događa kada se atomi vodika nađu dovoljno blizu?
Kada se dva atoma vodika međusobno povezuju u molekulu, smanjuje se energija sustava.
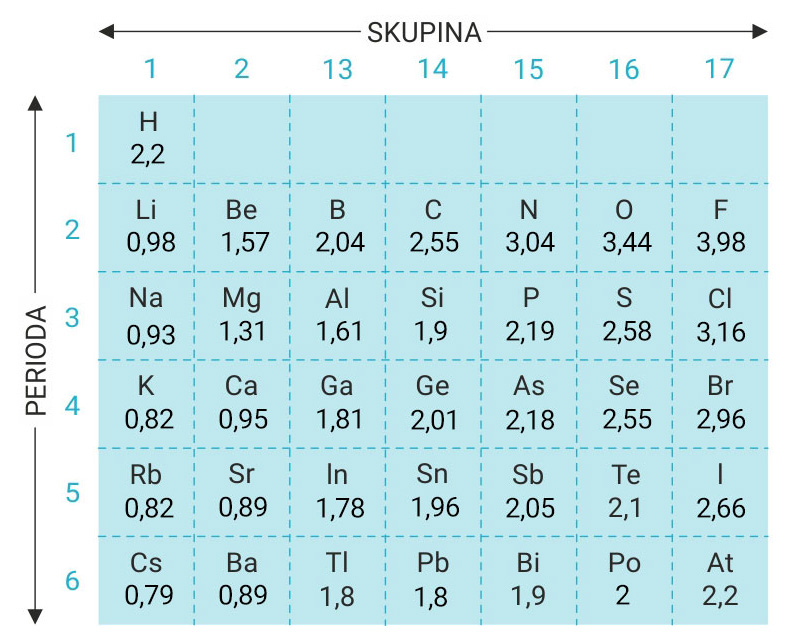
Elektronegativnost atoma
Pri nastajanju veze između raznovrsnih atoma jedan od njih jače privlači elektrone.
Gustoća zajedničkog oblaka uz njega veća.
Elektronegativnost, χ , je sposobnost atoma u molekuli
da privuče vezni elektronski par.
Jedna od definicija elektronegativnosti je Mullikenova definicija.
Elektronegativnost nekog atoma je srednja vrijednost
Elektronegativnošću se bavio i Linus Pauling.
On je godine 1932. elektronegativnost svake pojedine vrste atoma
brojčano izrazio tzv. koeficijentom elektronegativnosti.
Elektronegativnost atoma
Pri nastajanju veze između raznovrsnih atoma jedan od njih jače privlači elektrone, pa je gustoća zajedničkog oblaka uz njega veća.
Elektronegativnost, χ (grč. hi), je sposobnost atoma u molekuli da privuče vezni elektronski par.
Jedna od definicija elektronegativnosti je Mullikenova definicija prema kojoj je elektronegativnost nekog atoma srednja vrijednost
Elektronegativnošću se bavio i Linus Pauling koji je godine 1932. elektronegativnost svake pojedine vrste atoma brojčano izrazio tzv. koeficijentom elektronegativnosti.
Proučite podatke u tablici i odgovorite na sljedeća pitanja:
1. Koji atom ima najveći, a koji najmanji koeficijent elektronegativnosti?
2. Gdje se u periodnom sustavu elemenata nalaze atomi elemenata s najvećom, a gdje oni s najmanjom vrijednosti koeficijenata elektronegativnosti?
Odgovori:
1. Fluor ima najveću vrijednost koeficijenta elektronegativnosti 3,98, a cezij najmanju 0,79.
2. Najveću elektronegativnost imaju atomi nemetala u gornjem desnom kutu periodnog sustava elemenata, a najmanju elektronegativnost atomi metala u donjem lijevom kutu.
Elektronegativniji atom u molekuli
snažnije privlači vezni elektronski par.
Zbog toga se pomiče težište pozitivnog i negativnog naboja.
Kažemo da takva molekula ima dva pola.
Jedan je djelomično negativniji, a drugi djelomično pozitivniji pol.
Takve, polarne molekule, nazivamo dipolima.
Prava ili “čista” kovalentna veza moguća je samo između istovrsnih atoma.
U takvoj molekuli, težišta pozitivnog i negativnog naboja nalaze na istom mjestu.
Budući da elektronegativniji atom u molekuli snažnije privlači vezni elektronski par, pomiče se težište pozitivnog i negativnog naboja. Kažemo da takva molekula ima dva pola, djelomično negativniji i djelomično pozitivniji pol. Takve, polarne molekule, nazivamo dipolima.
Prava ili “čista” kovalentna veza moguća je samo između istovrsnih atoma. U takvoj molekuli, težišta pozitivnog i negativnog naboja nalaze na istom mjestu.
| kovalentna veza između istovrsnih atoma | |
|---|---|
| koeficijent elektronegativnosti, χ | |
| razlika elektronegativnosti između dvaju atoma | |
| Kovalentna veza u molekuli klora nije polarna jer se težište pozitivnog i negativnog naboja nalazi u istoj točki. Molekula klora je nepolarne građe, jer je elektronski oblak ravnomijerno raspoređen. | |
Veza između raznovrsnih atoma, atoma različite
| kovalentna veza između raznovrsnih atoma | |
|---|---|
| koeficijent elektronegativnosti, χ | |
| razlika elektronegativnosti između dvaju atoma | |
|
Kovalentna veza u molekuli klorovodika je polarna jer se težište pozitivnog i negativnog naboja ne nalazi u istoj točki. Molekula klorovodika je polarna. Klor je elektronegativniji od vodika pa je vezni elektronski par bliže atomu klora. Veća elektronska gustoća označava sa znakom δ – (delta minus) (u ovom primjeru dopisuje se uz simbol atoma klora), a manja elektronska gustoća znakom δ + (delta plus) (u ovom primjeru dopisuje se uz simbol atoma vodika).
|
|
Mjera za polarnost je električni dipolni moment, μ (grč. mi) , koji je jednak umnošku električnog naboja (e) i udaljenosti težišta pozitivnog i negativnog naboja (l). Javlja se samo u molekulama građenim od raznovrsnih atoma. Mjerna jedinica za dipolni moment je kulon metar (C m). Često se koristi i jedinica debye (D).
Osim razlike u elektronegativnosti, polarnost molekule uvjetuje i njezin oblik. Ako je oblik molekule takav da se, unatoč razlici u elektronegativnosti atoma koji je izgrađuju, težišta pozitivnog i negativnog naboja nalaze u istoj točki, molekula nije polarna.

Linus Carl Pauling (1901. – 1994.)
Linus Carl Pauling (1901. – 1994.), američki je kemičar, fizičar, borac za mir i nobelovac.
Značajan doprinos dao je različitim područjima kemije.
Proučavao je prirodu kemijskih veza, rendgenski istraživano oblike aminokiselina i peptida.
Pauling je nagrađen Nobelovom nagradom za kemiju 1954. godine
Nobelovom nagradom za mir je nagrađen 1962. godine.
Svoje zanimanje o ovom znanstvenku možete proširiti proučavajući podatke na mrežnoj stranici Nobelprize.org, podstranica Linus Pauling – Facts.
Linus Carl Pauling (1901. – 1994.)
Linus Carl Pauling (1901. – 1994.), američki je kemičar, fizičar, borac za mir i nobelovac.
Značajan doprinos dao je različitim područjima kemije, od prirode kemijskih veza do rendgenskih istraživanja oblika aminokiselina i peptida.
Pauling je nagrađen Nobelovom nagradom za kemiju 1954. godine i Nobelovom nagradom za mir 1962. godine.
Svoje zanimanje o ovom znanstvenku možete proširiti proučavajući podatke na mrežnoj stranici Nobelprize.org, podstranica Linus Pauling – Facts.
Na kraju…
Temeljem podataka koji se mogu isčitati iz PSE-a može se pretpostavljati spajanjem atoma kojih elemenata mogu nastati spojevi i kojim se modelom kemijskog vezivanja mogu opisati interakcije između atoma (ili iona) u tim spojevima.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U kojim od navedenih molekula, za središnji atom nije zadovoljeno pravilo okteta?
| A | B | C | D |
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koje od navedenih molekula imaju linearnu građu?
| A | B | C | D |
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Veza između dva atoma ugljika je:
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odredite između kojih atoma je najveća razlika u elektronegatvnosti?
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Koje su od navedenih molekula polarne? Dva su odgovora točna.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?