Međumolekulske interakcije
- prepoznati ion-ion interakcije
- prepoznati van der Waalsove privlačne sile
- usporediti vrelišta, tališta i agregacijska stanja tvari prema jakosti van der Waalsovih sila
- shematski prikazati vodikove veze na primjerima
- objasniti utjecaj vodikove veze na svojstva tvari, primjerice, anomalija vode
Uvod
Zašto se mlaz vode “savija”?
Odgovor na postavljeno pitanje dobit ćete pozornim praćenjem sljedećeg videozapisa.
Međumolekulske interakcije
Atomi u molekulama su povezani kovalentnim vezama.
Između molekula u tekućinama ili čvrstim tvarima dolazi
do međusobnog privlačenja ili međumolekulskih interakcija.
Jakost međumolekulskih interakcija
ima velik utjecaj na makroskopska svojstva tvari.
Makroskopska svojstva tvari su: agregacijsko stanje, talište,
vrelište, topljivost, viskoznost, površinska napetost, tlak pare.
Polarne se molekule jače polariziraju od nepolarnih.
Polarne molekule se orijentiraju na sljedeći način.
Negativno nabijeni kraj jedne molekule dođe u neposrednu blizinu
pozitivno nabijenog kraja druge molekule.
Međumolekulske interakcije
Atomi su u molekulama povezani kovalentnim vezama. Između molekula u tekućinama ili čvrstim tvarima dolazi do međusobnog privlačenja ili međumolekulskih interakcija.
Jakost međumolekulskih interakcija ima velik utjecaj na makroskopska svojstva tvari (agregacijsko stanje, talište, vrelište, topljivost, viskoznost, površinska napetost, tlak pare….).
Polarne (dipolne) molekule se orijentiraju tako da negativno nabijeni kraj jedne molekule dođe u neposrednu blizinu pozitivno nabijenog kraja druge molekule.
Suprotno nabijeni krajevi dipolnih molekula se privlače.
To znači da su dipolne privlačne sile elektrostatske prirode.
Nazivamo ih van der Waalsovim privlačnim silama.
Suprotno nabijeni krajevi dipolnih molekula se privlače što znači da su dipol-dipolne privlačne sile elektrostatske prirode. Nazivamo ih van der Waalsovim privlačnim silama.
Nepolarne molekule privlače se silama
koje nazivamo Londonovim ili disperzijskim silama.
Prirodu privlačnih sila između nepolarnih molekula,
objasnio je njemačko-američki fizičar Fritz London 1930. godine.
U jednom trenutku raspodjela elektrona unutar molekula nije simetrična.
Zbog nejednake raspodjele elektrona nastaju trenutačni dipoli.
Trenutačni dipoli polariziraju susjedne molekule.
Na taj način nastaju inducirani dipoli.
Jakost privlačnih sila između induciranih dipola ovisi o veličini molekula.
Veće se molekule lakše polariziraju jer imaju ukupno veći broj elektrona.
Zbog toga lakše dolazi do deformacije elektronskog oblaka.
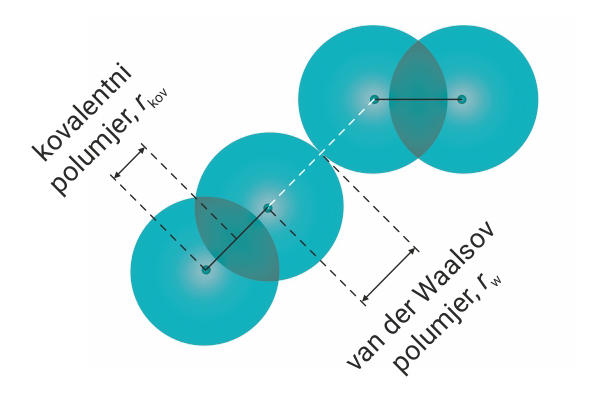
Kovalentni i van der Waalsov polumjer
Kovalentni polumjer, , je polovina udaljenosti jezgara atoma
u molekuli povezanih kovalentnom vezom tj. polovina duljine kovalentne veze.
Van der Waalsov polumjer, , je polovina udaljenosti između jezgara
dvaju istovrsnih atoma koji se dodiruju, a nisu međusobno povezani kemijskom vezom.
Nepolarne molekule privlače se silama koje nazivamo Londonovim ili disperzijskim silama. Prirodu privlačnih sila između nepolarnih molekula, objasnio je njemačko-američki fizičar Fritz London 1930. godine.
U jednom trenutku raspodjela elektrona unutar molekula nije simetrična. Zbog nejednake raspodjele elektrona nastaju trenutačni dipoli koji polariziraju susjedne molekule. Na taj način nastaju inducirani dipoli.
Jakost privlačnih sila između induciranih dipola ovisi o veličini molekula. Veće se molekule lakše polariziraju jer imaju ukupno veći broj elektrona pa lakše dolazi do deformacije elektronskog oblaka.
Kovalentni i van der Waalsov polumjer
Kovalentni polumjer, , je polovina udaljenosti jezgara atoma u molekuli povezanih kovalentnom vezom tj. polovina duljine kovalentne veze.
Van der Waalsov polumjer, , je polovina udaljenosti između jezgara dvaju istovrsnih atoma koji se dodiruju, a nisu međusobno povezani kemijskom vezom.

Johannes Diderik van der Waals(1837. – 1923.)
Johannes Diderik van der Waals je bio nizozemski fizičar.
Živio je od 1837. do 1923. godine.
Godine 1880., otkrio je
postojanje privlačnih sila između molekula.
Za to je otkriće dobio Nobelovu nagradu za fiziku 1910.
Ta su međudjelovanja njemu u čast nazvana van der Waalsove sile.

Johannes Diderik van der Waals(1837. – 1923.)
Johannes Diderik van der Waals (1837. – 1923.) nizozemski fizičar otkrio je godine 1880. postojanje privlačnih sila između molekula i za to je otkriće dobio Nobelovu nagradu za fiziku 1910. Ta su međudjelovanja njemu u čast nazvana van der Waalsove sile.
Kako veličina molekula utječe na agregacijsko stanje klora, broma i joda?
U periodnom sustavu elemenata, jedina skupina koja sadrži elementarne tvari različitih agregacijskih stanja pri sobnoj temperaturi je skupina halogenih elemenata. Tako su fluor i klor pri sobnoj temperaturi plinovi, brom tekućina, a jod čvrsta tvar.
Koja će se od navedenih molekula najlakše polarizirati?
Između molekula halogenih elemenata djeluju Londonove privlačne sile.
Najlakše će se polarizirati molekule joda.
Razlog tome jest što molekule joda imaju najviše elektrona.
Stoga, jakost Londonovih sila raste porastom broja elektrona.
Zbog toga je jod u čvrstom agregacijskom stanju.
Molekule broma imaju slabiju polarizaciju.
Između njih vladaju slabije privlačne sile.
Pri normalnim uvjetima, brom je u tekućem agregacijskom stanju.
Molekule klora i fluora najteže polariziraju.
Klor i fluor su zato u plinovitom agregacijskom stanju.
Koja će se od navedenih molekula najlakše polarizirati?
Između molekula halogenih elemenata djeluju Londonove privlačne sile.
Najlakše će se polarizirati molekule joda, jer imaju najviše elektrona i najveću masu u odnosu na molekule drugih halogenih elemenata. To je razlog da je jod u čvrstom agregacijskom stanju.
Zbog slabije polarizacije molekula broma, između njih vladaju slabije privlačne sile pa je pri normalnim uvjetima brom u tekućem agregacijskom stanju.
Budući da se molekule klora i fluora najteže polariziraju, klor i fluor su u plinovitom agregacijskom stanju.
Koje međumolekulske interakcije djeluju između atoma plemenitih plinova?
Odgovor:
Između atoma plemenitih plinova djeluju Londonove privlačne sile. Jakost Londonovih sila utječe na svojstva plemenitih plinova.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Jakost van der Waalsovih sila ovisi o:
1.raspodjeli elektronske gustoće
2.ukupnom broju elektrona
3.veličini atoma, odnosno molekula
4.međusobnoj udaljenosti molekula ili atoma
O jakosti van der Waalsovih sila ovise:
tališta i vrelišta tvari, prema tome i agregacijsko stanje.
Sve navedene interakcije zajedničkim imenom nazivamo van der Waalsovim silama.
Jakost van der Waalsovih sila ovisi o:
∙ raspodjeli elektronske gustoće
∙ ukupnom broju elektrona
∙ veličini atoma, odnosno molekula
∙ međusobnoj udaljenosti molekula ili atoma
O jakosti van der Waalsovih sila ovise tališta i vrelišta tvari, pa prema tome i agregacijsko stanje.
Sve navedene interakcije zajedničkim imenom nazivamo van der Waalsovim silama.
| vrste privlačnih sila | primjer | jakost međudjelovanja kJ/mol |
|---|---|---|
| ion-dipol | Na+ i |
40 – 600 |
| dipol-dipol | i |
5 – 25 |
| ion-inducirani dipol | i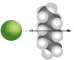 |
3 – 15 |
| dipol-inducirani dipol | i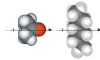 |
2 – 10 |
| Londonove sile ili disperzijske sile | i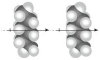 |
0,05 – 40 |
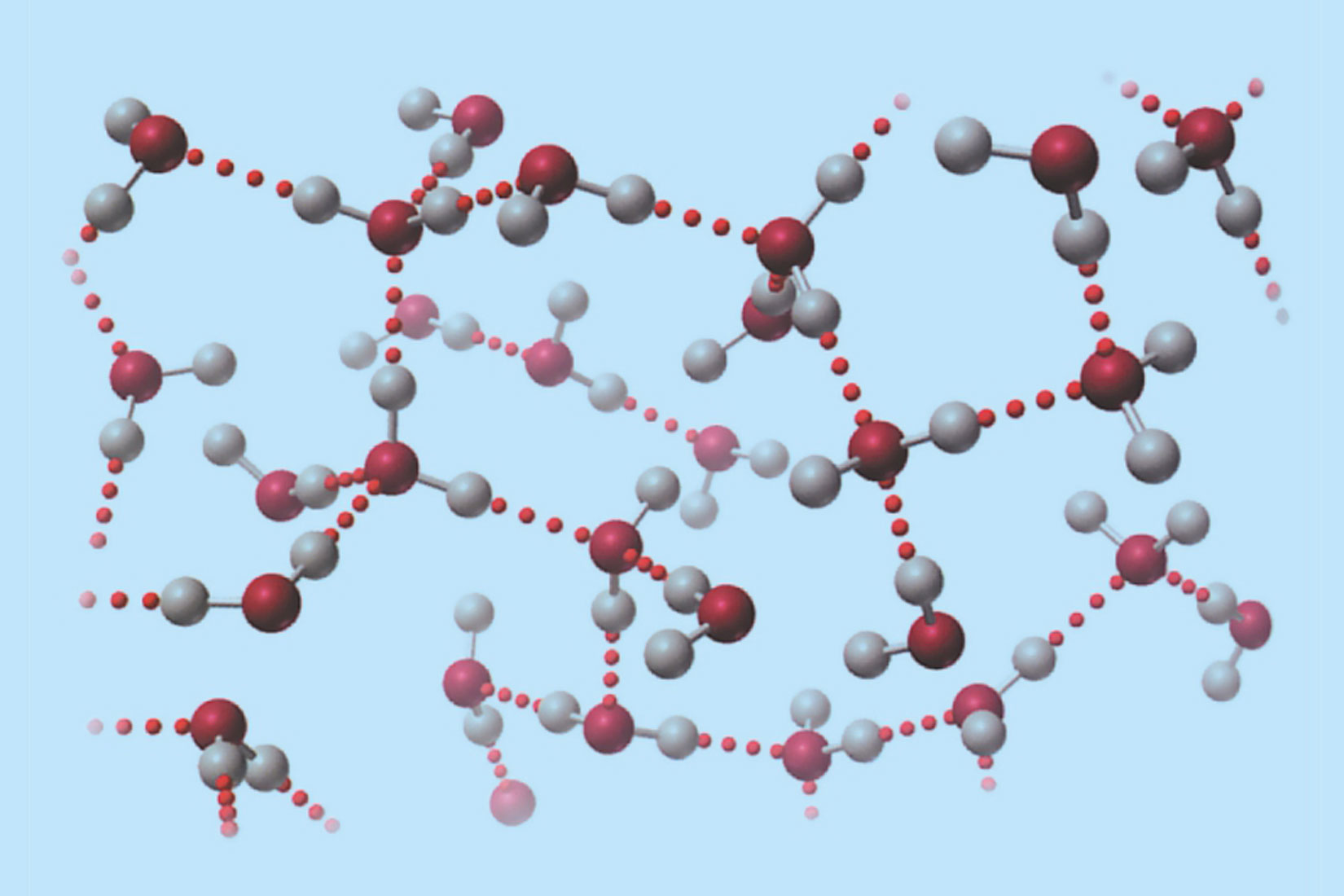
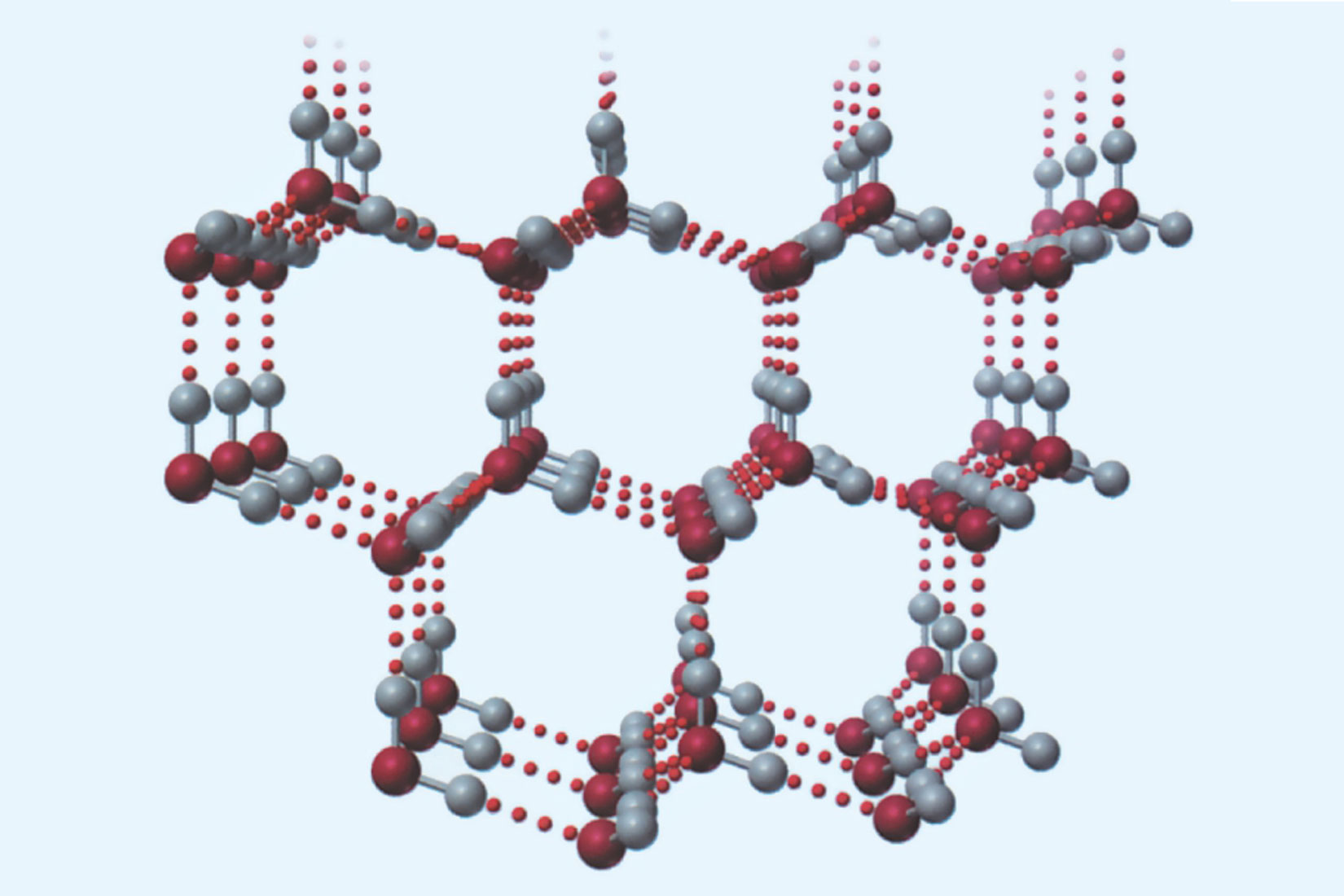
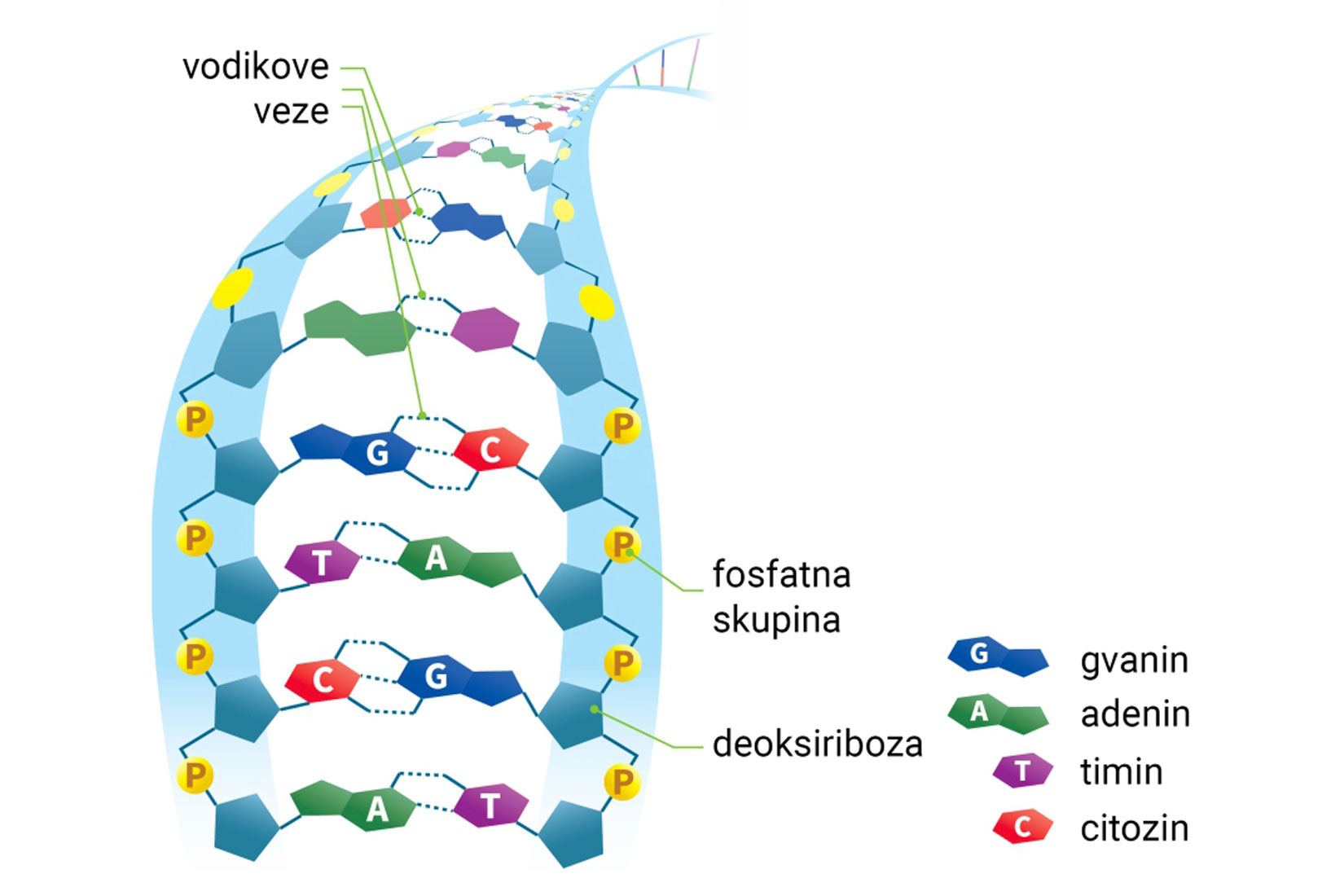
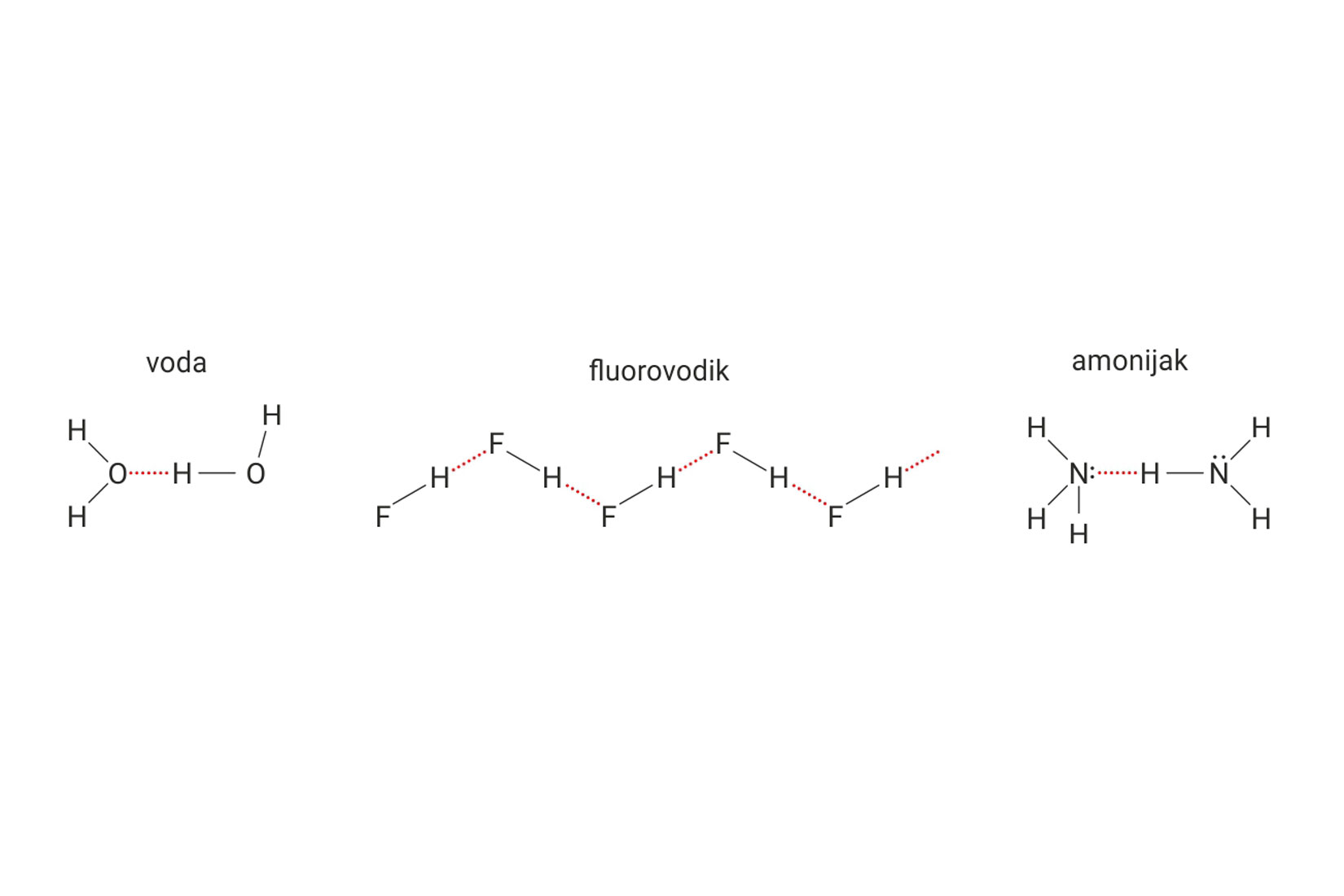
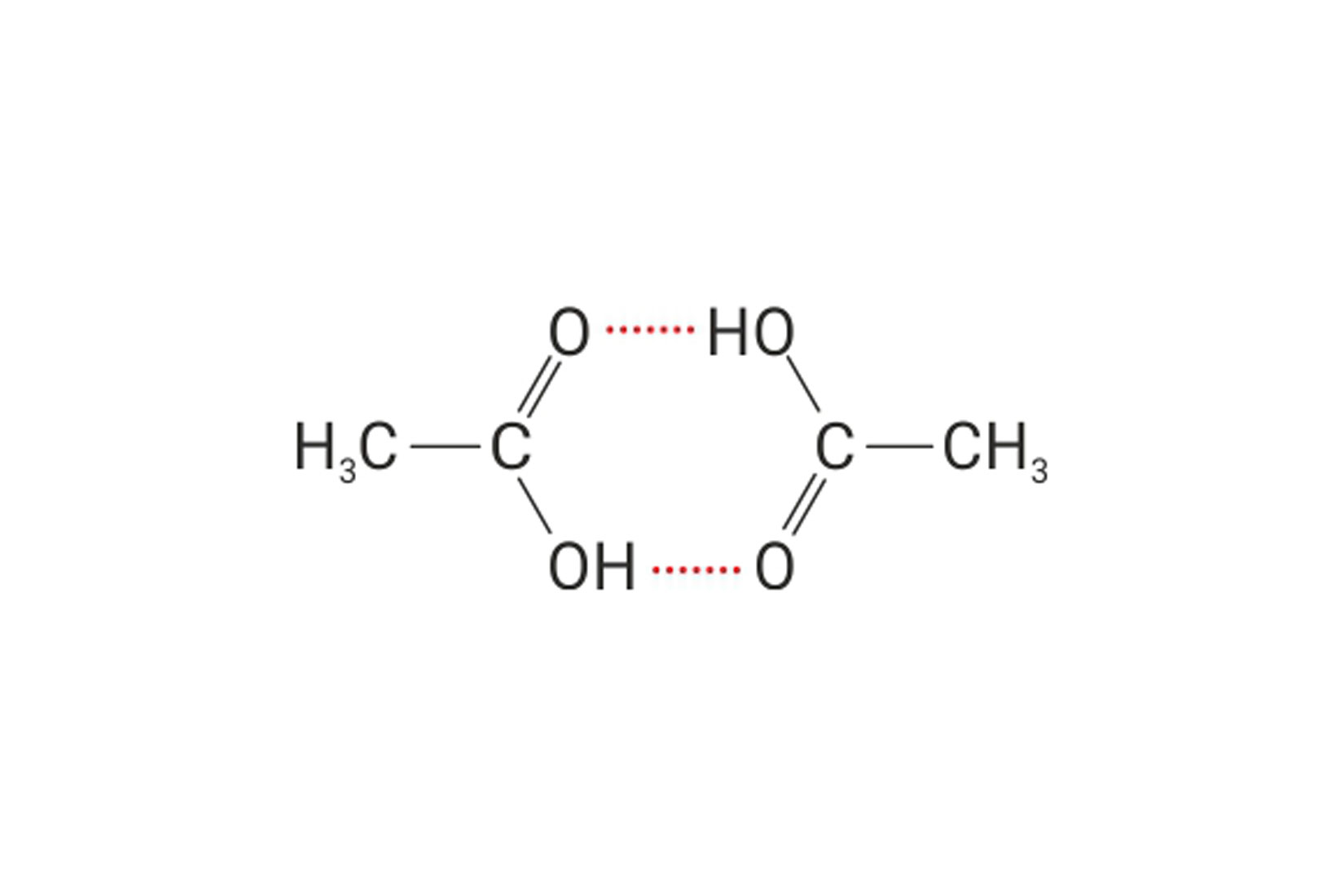
Vodikova veza
Vodikova veza je model kojim opisujemo
elektrostatske interakcije između dviju dipolnih molekula.
Vodikovom vezom se mogu opisati elektrostatski odnosi
dipolnih dijelova iste makromolekule.
U navedenim elektrostatskim odnosima,
atom vodika je vezan na atom izrazito elektronegativnog elementa.
Primjeri takvih atoma su fluor, kisik, dušik.
Vodikove veze su slabije od interakcija koje opisujemo modelom kovalentne veze.
Jače su od van der Waalsovih sila.
Vodikova veza
Vodikova veza je model kojim opisujemo elektrostatske interakcije između dviju dipolnih molekula (ili dipolnih dijelova iste makromolekule) u kojima je atom vodika vezan na atom izrazito elektronegativnog elementa (fluora, kisika, dušika). Vodikove veze su slabije od interakcija koje opisujemo modelom kovalentne veze, a jače od van der Waalsovih sila.
Proučite ilustracije i zaključite kakvo značenje imaju
Grafikon prikazuje vrelišta spojeva atoma vodika s atomima elemenata 14., 15., 16. i 17. skupine periodnoga sustava elemenata. Proučite grafikon i potom odgovorite na pitanja.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Na kraju…
Ponovite osnovne pojmove vezane za međumolekulske interakcije te potom riješite interaktivni zadatak.