Ionsko vezivanje
- prikazati ionsko vezivanje na različitim primjerima
- usporediti polumjere atoma i iona
Uvod
Svuda oko nas nalaze se raznoliki izvori hrane i sirovina.
Ti izvori su nužni za ljudske i tehnološke potrebe.
Velik dio njih može se zamijeniti
nekim drugim izvorima hrane ili sirovina.
Ipak, ima ih nezamjenjivih.
Jedna od njih je sol, natrijev klorid.
Sol prati razvoj čovječanstva
i već stoljećima ima važnu ulogu u životu ljudi.
Zbog soli su se selili cijeli narodi.
Zbog soli su se vodili ratovi.
Kroz trgovinu soli razvijala su se carstva i kulture.
Služeći se podatcima koji su vam dostupni na mrežnim stranicama,
istražite značenja imena gradova Salzburg i Tuzla.
Uvod
Svuda oko nas nalaze se raznoliki izvori hrane i sirovina koji su nužni za ljudske i tehnološke potrebe. Velik dio njih može se zamijeniti drugima, ali ima i nezamjenjivih. Jedna od njih je sol natrijev klorid. Maseni udio ove soli većim dijelom opisuje sastav kuhinjske soli koja prati razvoj čovječanstva i već stoljećima ima važnu ulogu u životu ljudi. Zbog soli su se selili cijeli narodi, oko nje su se vodili ratovi, a kroz trgovinu soli razvijala su se carstva i kulture. Gdje je bilo soli, tu su se razvijali gradovi, trgovina i promet.
Služeći se podatcima koji su vam dostupni na mrežnim stranicama, istražite značenja imena gradova Salzburg i Tuzla.
Sinteza natrijeva klorida
Prikažimo pokusom nastajanje natrijeva klorida reakcijom elementarnih tvari.
1. Navedite:
a) pribor i kemikalije koje su korištene u demonstracijskom pokusu sinteze natrijeva klorida
b) mjere opreza kojih se treba pridržavati prilikom izvođenja pousa.
2. Načinite u alatu Chemix skicu aparature za sintezu natrijeva klorida, pazeći na odnose veličina posuđa i pribora.
Odgovori:
Pribor i kemikalije korištene u izvedbi pokusa su: epruveta s rupicama, reagens boca od 250 mL, filtrirni papir, čep, plamenik, nož, pinceta, Petrijeva zdjelica, Erlenmeyerova tikvica, natrij, Erlenmeyerova tikvica s klorom.
Mjere opreza:
Natrij jako nagriza kožu, zato treba rabiti zaštitne rukavice i staviti zaštitne naočale. Klor je vrlo otrovan plin, pa valja raditi u digestoru.
Atomi metala imaju malu energiju ionizacije.
Lako tvore pozitivne ione koje nazivamo kationi.
Proces otpuštanja elektrona naziva se oksidacija.
Pozitivni nabojni broj kationa jednak je broju otpuštenih elektrona.
Atomi nemetala imaju velik afinitet prema elektronu
Lako tvore negativne ione koje nazivamo anioni.
Proces primanja elektrona naziva se redukcija.
Negativni nabojni broj aniona jednak je broju primljenih elektrona.
Atomi metala imaju malu energiju ionizacije pa lako tvore pozitivne ione koje nazivamo kationi.
Proces otpuštanja elektrona naziva se oksidacija.
Pozitivni nabojni broj kationa jednak je broju otpuštenih elektrona.
Atomi nemetala imaju velik afinitet prema elektronu, pa lako tvore negativne ione koje nazivamo anioni.
Proces primanja elektrona naziva se redukcija.
Negativni nabojni broj aniona jednak je broju primljenih elektrona.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Ionsko vezivanje
Natrijev klorid je tvar sastavljena
od ogromnog broja iona natrija i iona klora.
Zbog svog ionskog sastava, kažemo da je natrijev klorid ionski spoj.
U ionskim je spojevima svaki ion okružen ionima suprotnog naboja.
Na okupu ih drže elektrostatske privlačne sile.
Takva privlačna međudjelovanja nisu usmjerena
između pojedinačnih iona, poput onih između atoma u molekulama.
Ona se prožimaju kroz čitav ionski kristal.
Stoga nema smisla govoriti o pojedinačnim ionskim vezama.
Međusobno privlačenja svih suprotno nabijenih iona
u kristalu nazivamo ionskim vezivanjem.
Ionsko vezivanje
Natrijev klorid je tvar sastavljena od ogromnog broja natrijevih i kloridnih iona. Zbog svog ionskog sastava, kažemo da je natrijev klorid ionski spoj. U ionskim je spojevima svaki ion okružen ionima suprotnog naboja. Na okupu ih drže elektrostatske privlačne sile. Takva privlačna međudjelovanja nisu usmjerena između pojedinačnih iona, poput onih između atoma u molekulama. Ona se prožimaju kroz čitav ionski kristal. Stoga nema smisla govoriti o pojedinačnim ionskim vezama. Fenomen međusobnog privlačenja svih suprotno nabijenih iona u kristalu nazivamo ionskim vezivanjem.
Omjer broja kationa i aniona u ionskom je spoju točno određen.
Primjerice, u natrijevu kloridu ioni natrija i klora nalaze se u omjeru 1:1.
Različiti uzorci imaju različit broj iona.
Zato sastav ionskog spoja prikazujemo empirijskom formulom.
Iz nje se vidi sastav tvari te omjer kationa i aniona.
Termin
Ipak, empirijsku se formulu ionskog spoja
uvriježilo nazivati formulskom jedinkom.
Tako je, primjerice, formulska jedinka natrijeva klorida, , a formulska jedinka magnezijeva bromida, .
Nastajanje iona
Da bi došlo do ionskog vezivanja,ioni suprotnog naboja
moraju se naći dovoljno blizu da se privuku.
Ti ioni već moraju postojati.
Primjerice u nekoj otopini.
Također,mogu nastati kemijskom reakcijom.
Kemijske reakcije kojima nastaju ioni
nazivamo oksidacijsko-redukcijskim procesima.
U prisutnosti tvari koja može primiti elektrone,
atomi metala ih mogu otpustiti.
Otpuštanjem elektrona atomi metala se oksidiraju.
Pri tome nastaju pozitivno nabijeni ioni koji se zovu kationi.
Otpuštene elektrone vežu atomi nemetala.
Vezivanjem elektrona, atomi nemetala se reduciraju.
Pri tome nastaju negativno nabijeni ioni koji se zovu anioni.
Proces oksidacije i proces redukcije mogu se prikazati
parcijalnim kemijskim jednadžbama.
Slijedi primjer nastajanja natrijeva klorida iz elementarnih tvari.
Zbrajanjem parcijalnih kemijskih jednadžbi
dobiva se ukupna jednadžba promatrane kemijske reakcije.
Omjer broja kationa i aniona u ionskom je spoju točno određen. Primjerice, u natrijevu kloridu natrijevi i kloridni ioni nalaze se u omjeru 1:1. S obzirom da različiti uzorci imaju različit broj iona, sastav ionskog spoja prikazujemo empirijskom formulom. Iz nje se vidi sastav tvari te omjer broja kationa i aniona. Iako termin
Nastajanje iona
Da bi došlo do ionskog vezivanja, ioni suprotnog naboja moraju se naći dovoljno blizu da se privuku. Ti ioni već moraju postojati, primjerice u nekoj otopini, ili mogu nastati kemijskom reakcijom.
Kemijske reakcije kojima nastaju ioni nazivamo oksidacijsko-redukcijskim procesima. U prisutnosti tvari koja može primiti elektrone, atomi metala ih mogu otpustiti. Otpuštanjem elektrona atomi metala se oksidiraju. Pri tome nastaju pozitivno nabijeni ioni, kationi.
Otpuštene elektrone vežu atomi nemetala. Vezivanjem elektrona, atomi nemetala se reduciraju. Pri tome nastaju negativno nabijeni ioni, anioni.
Proces oksidacije i proces redukcije mogu se prikazati parcijalnim kemijskim jednadžbama, kao što je primjerom nastajanja natrijeva klorida iz elementarnih tvari pokazano u nastavku. Zbrajanjem parcijalnih kemijskih jednadžbi dobiva se ukupna jednadžba promatrane kemijske reakcije.
Nastajanje ionskih spojeva iz elementarnih tvari
oksidacija:
redukcija:
ukupna jednadžba:
Svojstva kemijskih elemenata koji grade natrijev klorid
| Natrij, | Klor, |
|---|---|
 |
 |
| Natrij je vrlo mekan srebrnobijeli metal te se zbog male tvrdoće može rezati nožem.
Na svježem je prerezu sjajne srebrno bijele boje. Zbog svoje velike reaktivnosti, nepostojanosti na zraku čuva se u petroleju ili parafinskom ulju. Zagrijavanjem se brzo rastali i poprimi oblik kuglice. Gorenjem natrija nastaje natrijev peroksid, .
Burno reagira s vodom, zbog velike egzotermosti reakcije nastali vodik se može spontano zapaliti. |
Klor je vrlo otrovan zeleno žuti plin, bockajuća mirisa.
U laboratoriju se dobiva reakcijom kalijeva permanganata i koncentrirane klorovodične kiseline. |
| natrijev klorid, | |
 |
|
| Čist natrijev klorid je bezbojni ionski kristal slana okusa, vrlo je rasprostranjen i najrašireniji je spoj natrija. Neophodan je u prehrani. | |
Kemijskim jednadžbama prikažimo nastajanje litijeva nitrida, kalcijeva bromida i aluminijeva sulfida iz elementarnih tvari.
Primjer 1: Nastajanje litijeva nitrida
Primjer 2: Nastajanje kalcijeva bromida
Primjer 3: Nastajanje aluminijeva sulfida
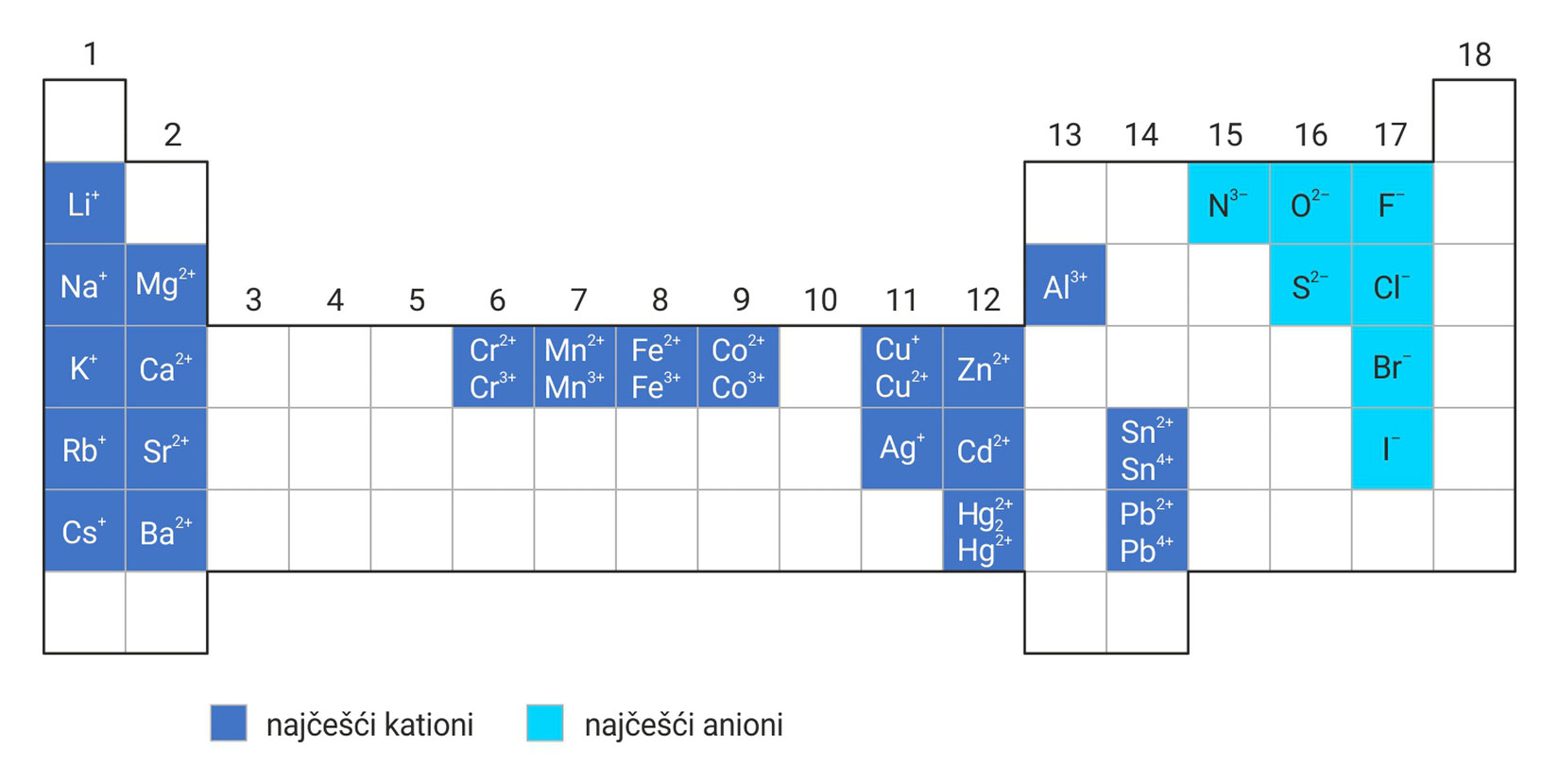
Najčešći kationi i anioni
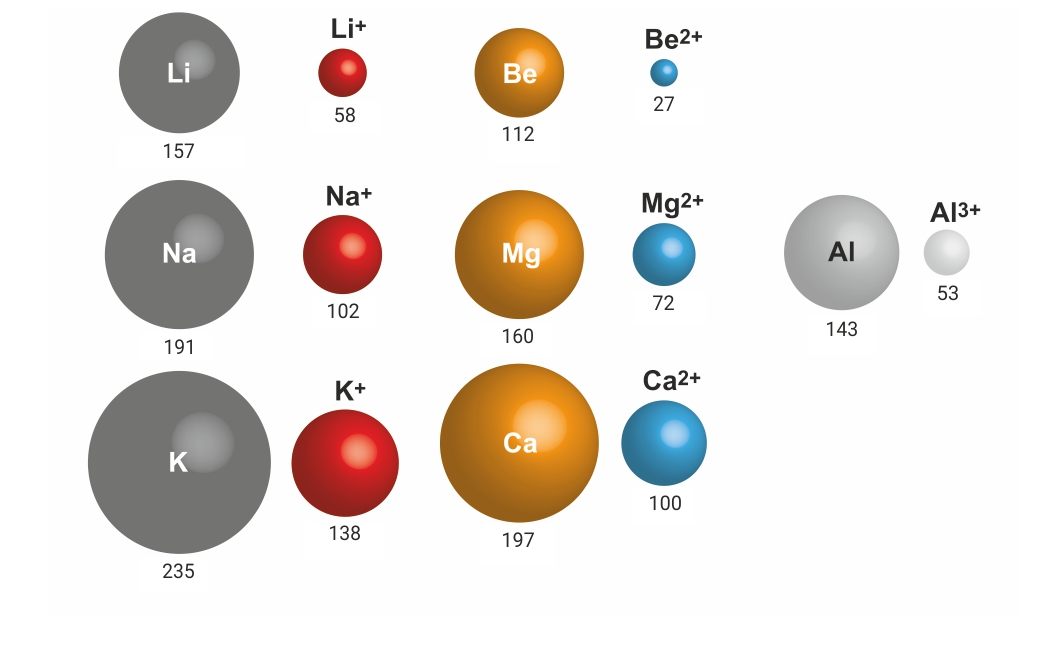
Polumjeri atoma nekih metala i njihovih kationa
Što možete zaključiti iz shematskog prikaza o odnosu polumjera kationa i njegova atoma?
Odgovor:
Polumjer kationa je manji od polumjera njegova atoma, jer je broj elektronskih ljusaka u elektronskom omotaču kationa manji.
Valencija iona u ionskom spoju
U ionskom je spoju
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Imenovanje jednoatomnih kationa i aniona
| formula iona | naziv iona |
|---|---|
| natrijev ion | |
| kalcijev ion | |
| srebrov ion | |
| željezov(II) ion | |
| željezov(III) ion |
| formula iona | naziv iona |
|---|---|
| kloridni ion | |
| sulfidni ion | |
| nitridni ion |
Imenovanje ionskih spojeva
Ime ionskog spoja tvori se tako da se najprije navede ime kationa, u obliku posvojnog pridjeva, a zatim aniona.
Za atome elemenata koji u spojevima imaju uvijek istu valenciju poput alkalijskih, zemnoalkalijskih metala i aluminija valencija se u imenovanju ionskog spoja izostavlja. Primjerice;
| natrijev klorid | |
| magnezijev fluorid | |
| aluminijev bromid |
Za atome elemenata koji u spojevima mogu imati različite valencije, valencija se označava rimskim brojem koji se piše u okrugloj zagradi odmah uz ime kationa (bez razmaka). Primjerice;
| bakrov(I) oksid | |
| bakrov(II) oksid |
Imenovanje višeatomnih kationa i aniona
| formula iona | naziv iona |
|---|---|
| amonijev ion | |
| oksonijev ion |
| formula iona | naziv iona |
|---|---|
| hidroksidni ion | |
| nitritni ion | |
| nitratni ion | |
| cijanidni ion | |
| permanganatni ion | |
| sulfitni ion | |
| sulfatni ion | |
| karbonatni ion | |
| kromatni ion | |
| dikromatni ion | |
| fosfatni ion |
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji od navedenih parova elementarnih tvari kemijskom reakcijom daje ionski spoj? odaberite točan odgovor.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Kemijskim formulama u lijevom stupcu, pridružite naziv kemijskog spoja.
dušikov(I) oksid
sumporov(VI) oksid
bakrov(II) klorid
fosforov(III) fluorid
Unesite odgovore na pripadajuća mjesta.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Navedenim kemijskim simbolima pridružite elektronsku konfiguraciju:
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Navedenim elektronskim konfiguracijama pridružite kemijske simbole:
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?