Ionski kristali
- povezati strukturu ionskih kristala sa svojstvima tvari
- odrediti koordinacijski broj iona na primjerima
- objasniti značenje pojma polimorfija
Uvod
Kako je građen kristal natrijeva klorida?
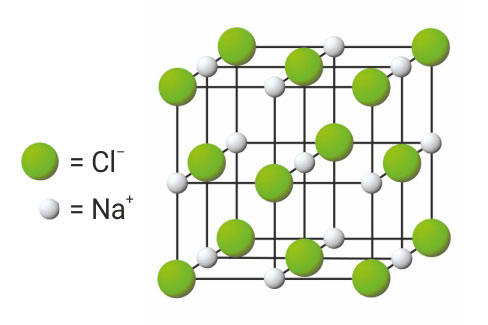
Kloridni se ioni nalaze na vrhovima i u središtima ploha kocke.
Na taj način grade plošno centriranu jediničnu ćeliju.
Natrijevi se ioni također nalaze na vrhovima i u središtima ploha kocke.
Natrijevi ioni grade plošno centriranu jediničnu ćeliju.
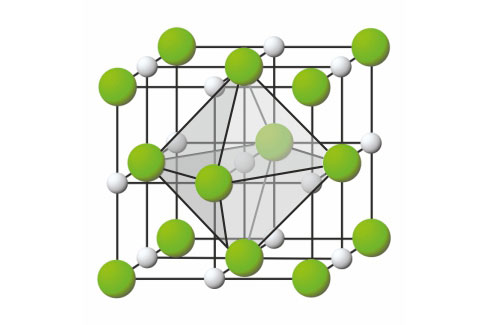
Jedinične ćelije natrijevih i kloridnih iona
međusobno su pomaknute za polovinu duljine brida jedinične ćelije.
Svaki natrijev ion u jediničnoj ćeliji okružen je sa 6 kloridnih iona.
Svaki kloridni ion okružen je sa 6 natrijevih iona.
Kloridni se ioni nalaze na vrhovima i u središtima ploha kocke. Na taj način grade plošno centriranu jediničnu ćeliju. Natrijevi se ioni također nalaze na vrhovima i u središtima ploha kocke. Prema tome i natrijevi ioni grade plošno centriranu jediničnu ćeliju.
Jedinične ćelije natrijevih i kloridnih iona međusobno su pomaknute za polovinu duljine brida jedinične ćelije. Svaki natrijev ion u jediničnoj ćeliji okružen je sa 6 kloridnih iona, a svaki kloridni ion okružen je sa 6 natrijevih iona.
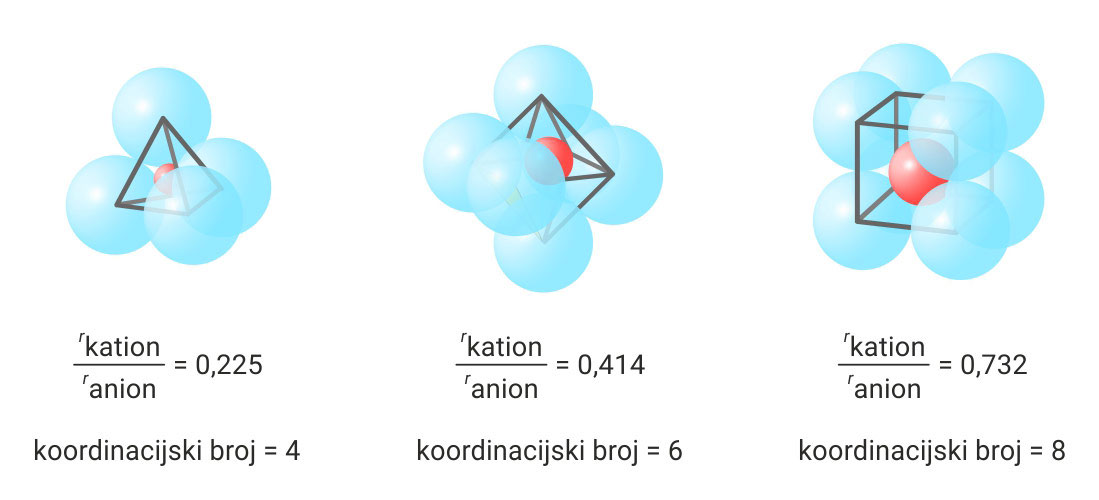
Broj iona suprotnog naboja koji neposredno okružuje odgovarajući ion naziva se koordinacijskim brojem.
U kristalnoj strukturi natrijeva klorida koordinacijski broj iona je 6.
Koordinacijski broj ovisi o omjeru polumjera kationa i aniona.
Gustoća kristalne tvari
Gustoća neke kristalne tvari omjer je mase jedinične ćelije i volumena jedinične ćelije.
N – broj jedinki (atoma, iona, molekula) koje se nalaze u jediničnoj ćeliji
Riješeni primjer 1
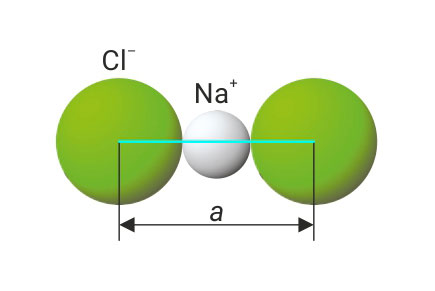
Izračunajte gustoću natrijeva klorida ako je duljina brida jedinične ćelije 564,1 pm.
Zadano je:
a = 564,1 pm
Traži se:
ρ(NaCl) = ?
Izradak:
Jediničnoj ćeliji natrijeva klorida pripadaju 4 natrijeva iona i 4 kloridna iona. Prema tome, masa jedinične ćelije jednaka je zbroju masa četiri iona natrija i četiri iona klora.
Volumen kocke je a3, je gustoća natrijeva klorida dana izrazom:
Odgovor:
Gustoća natrijeva klorida je 2,162 g cm-3
Svojstva ionskih kristala
- Građeni su od iona pravilno razmještenih u kristalnoj strukturi.
- Između iona suprotnog naboja djeluju
jake elektrostatske privlačne sile.
Te sile se zovu Coulombove sile.
Jakost elektrostatske privlačne sile između iona određena je Coulombovim zakonom:
gdje je:
F – privlačna sila
Q1, Q2 – naboji iona
r – zbroj ionskih polumjera
k – konstanta
Svojstva ionskih kristala
- Građeni su od iona pravilno razmještenih u kristalnoj strukturi.
- Između iona suprotnog naboja djeluju jake elektrostatske privlačne sile, Coulombove sile.
Jakost elektrostatske privlačne sile između iona određena je Coulombovim zakonom:
gdje je:
F – privlačna sila
Q1, Q2 – naboji iona
r – zbroj ionskih polumjera;
k – konstanta
Odgovorite na pitanje i objasnite svoj izbor.
Koji od navedenih ionskih kristala u paru ima više talište?
- ili
- ili
- ili
- ili
- ili
Odgovor:
Objašnjenje:
Sila privlačenja iona obrnuto je proporcionalna kvadratu zbroja ionskih polumjera. Ako je zbroj ionskih polumjera veći privlačna sila je manja, a talište kristalne tvari niže.
I obratno, ako je zbroj ionskih polumjera manji privlačna sila iona je veća, a talište kristalne tvari više.
Ako je veća količina naboja u brojniku, talište kristalne tvari biti će više i obratno.
a – duljina brida jedinične ćelije,
r – zbroj ionskih polumjera,
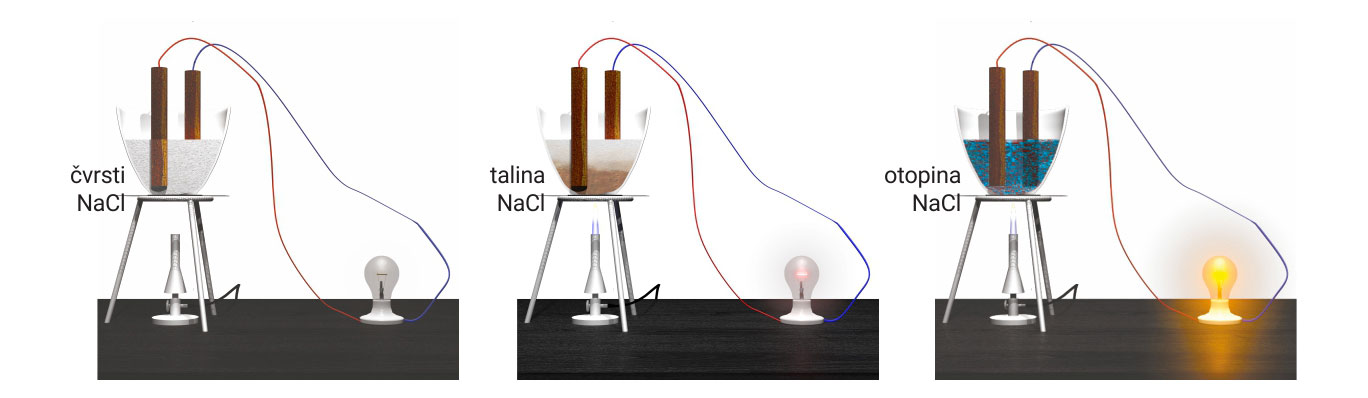
- U čvrstom stanju ne provode električnu struju.
Ionski kristali u čvrstom stanju su izolatori.
- U čvrstom stanju ne provode električnu struju. Ionski kristali u čvrstom stanju su izolatori.
Nastaju električki nabijeni ioni.
Ioni s površine kristala ostvaruju interakcije s molekulama vode.
Veći broj takvih interakcija može “nadjačati”
kation-anion privlačenja u kristalu.
Zbog toga se ioni mogu izdvojiti iz kristala.
Hidratizirani ioni su okruženi molekulama vode.
Vodene otopine ionskih kristala vode električnu struju.
- Dovođenjem topline razlaže se kristalna struktura i nastaju električki nabijeni ioni. Taline ionskih kristala vode električnu struju.
- U vodi topljivi ionski kristali disociraju na ione. Naime, ioni s površine kristala ostvaruju interakcije s molekulama vode. Veći broj takvih interakcija može “nadjačati” kation-anion privlačenja u kristalu. Zbog toga se ioni, okruženi molekulama vode (nazivamo ih hidratiziranim ionima), mogu izdvojiti iz kristala.
Vodene otopine ionskih kristala vode električnu struju.
Pri sobnoj temperaturi ionski su kristali u čvrstom agregacijskom stanju.
To znači da se lome u smjeru određene plohe
ako se na njih djeluje mehaničkom silom.
- Tališta i vrelišta ionskih kristala su visoka. Pri sobnoj temperaturi ionski su kristali u čvrstom agregacijskom stanju.
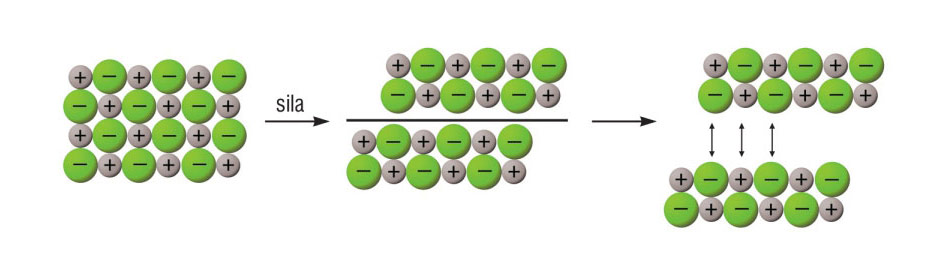
- Ionski kristali se kalaju, lome se u smjeru određene plohe ako se na njih djeluje mehaničkom silom.
Magnezij gori blještavom svjetlošću uz oslobađanje topline.
Gorenjem magnezijeve trake na zraku, magnezij reagira s kisikom i dušikom iz zraka.
Gorenjem magnezija nastaju nove tvari drugačijih svojstava.
Nastaje bijeli magnezijev oksid i sivkasti magnezijev nitrid.
Magnezij gori blještavom svjetlošću uz oslobađanje topline. Gorenjem magnezijeve trake na zraku, magnezij osim s kisikom reagira i s dušikom iz zraka. Gorenjem magnezija nastaju nove tvari drugačijih svojstava, bijeli magnezijev oksid i sivkasti magnezijev nitrid.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Što je polimorfija?
Polimorfija je pojava da se neki kemijski spoj javlja u dvije ili više kristalnih struktura.
Primjerice, kalcijev karbonat, , sastoji od kalcijevih kationa i karbonatnih aniona u prirodi se može naći kao kalcit i aragonit.
Kalcit kristalizira u trigonskom, a aragonit u rompskom sustavu. Koji će od njih nastati ovisi o uvjetima kristalizacije.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Označite svojstva ionskih kristala.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U kojem su nizu formulama prikazani samo spojevi sastavljeni od čestica povezanih ionskim vezivanjem.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Polimorfija je pojava kad se:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Srebrov klorid, AgCl, kristalizira u kubičnom sustavu, poput natrijeva klorida, NaCl. Jedinična ćelija mu je plošno centrirana kocka. Izračunajte masu jedinične ćelije srebrova klorida.
Masa jedinične ćelije srebrova klorida je:
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?