

Izvučete li klip iz medicinske sisaljke, njezin će se cilindar ispuniti zrakom. Prstom zatvorite izlazni otvor sisaljke i pogurnite klip. Zrak u cilindru se stlačio, a klip treba držati kako se ne bi vratio u početni položaj. Smanjenje volumena zraka u sisaljci uzrokovalo je povećanje tlaka zraka gotovo bez promjene temperature.

Robert Boyle bio je irski fizičar i kemičar koji je 1662. godine eksperimentalnim putem otkrio vezu između tlaka i volumena plina uz stalnu temperaturu.
Edmé Mariotte je također bio francuski fizičar koji je, potpuno neovisno o Boyleu, eksperimentom otkrio istu vezu tlaka i volumena plina uz stalnu temperaturu.
Za idealni plin vrijedi pravilnost prema kojoj se tlak plina poveća onoliko puta koliko se puta smanji volumen posude koja je ispunjena tim plinom.
Promjena stanja plina bez promjene temperature naziva se izotermna promjena stanja plina.
Izotermna promjena stanja plina prikazuje se jednadžbom:
Tijekom promjene stanja plina temperatura i količina plina imaju stalne vrijednosti. Za dva različita stanja plina u kojima ćemo s označiti početnu vrijednost tlaka plina, s početni volumen plina, a s i njihove vrijednosti u konačnom stanju, vrijedi:
odnosno:
Pri stalnoj temperaturi, tlak i volumen plina obrnuto su proporcionalne veličine.
Pomoću sljedeće animacije detaljnije istražite tu povezanost.
Prikazano je neko početno stanje plina točkom u
dijagramu za dani položaj klipa koji zatvara određenu količinu plina u cilindričnoj posudi.
Označite pokazivačem na graf.
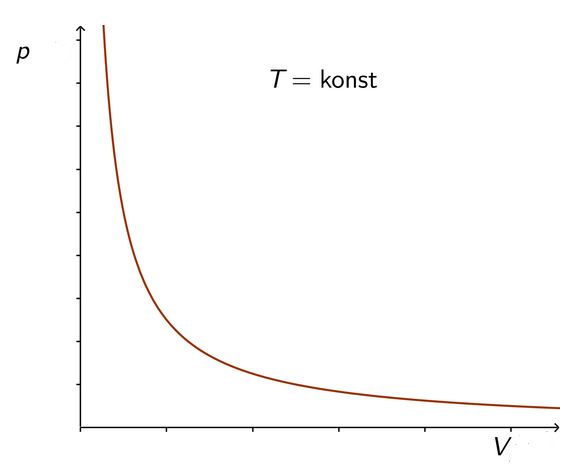
Koliki je tlak plina ako je volumen smanjen na polovicu početne vrijednosti?
Smanjimo li volumen plina na polovicu početne vrijednosti, tlak plina će se udvostručiti.
Prepolovimo li volumen još jedanput, koliki je sad tlak plina u odnosu prema početnoj vrijednosti?
Tlak je četiri puta veći.
Isto ponovimo još jedanput. Koliki je konačni tlak plina s obzirom na njegovu početnu vrijednost?
Tlak je osam puta veći.
Graf dobivene krivulje na animaciji naziva se jednakostrana hiperbola. O hiperboli ćete više učiti u Matematici u trećem razredu.
Ovisnost tlaka plina o volumenu uz stalnu temperaturu može se prikazati u dijagramu.
Pravac koji prikazuje ovisnost tlaka plina o volumenu plina pri konstantnoj temperaturi naziva se izoterma.
Prikažite u bilježnici izotermne promjene stanja plina u i dijagramima.
Vertikalni cilindar s pomičnim klipom površine ispunjen je idealnim plinom. Tlak idealnog plina u cilindru (zbog opterećenja vlastitom težinom) iznosi Temperatura zraka u klipu s cilindrom jest stalna. Za koliko se puta smanji volumen plina u cilindru ako se klip optereti utegom mase
Težina utega poveća tlak plina u cilindru za:
Ukupni tlak plina u cilindru:
Za izotermnu promjenu stanja plina vrijedi:
Volumen plina u cilindru smanjio se puta.
Na medicinsku sisaljku s pomoću gumene cjevčice spojite manometar.
a. Za pet različitih položaja klipa sisaljke volumen zraka bit će drukčiji. Očitajte s manometra pripadajuće vrijednosti tlaka. Tablicu prepišite u bilježnicu i dobivene vrijednosti upišite u nju.
U treći stupac tablice upišite umnožak iznosa tlaka i pripadajućeg volumena te provjerite ispravnost Boyle-Mariotteova zakona.
| Broj mjerenja | |||
|---|---|---|---|
U svih pet mjerenja umnožak tlaka i volumena trebao bi biti približno međusobno jednakih vrijednosti.
b. Uvrstite vrijednosti tlaka i volumena u
dijagram i nacrtajte u bilježnici krivulju.
Podatke dobivene iz pokusa obradite u Microsoft Excelu.
Kratka uputa o obradi podataka dobivenih u pokusu
Komentirajte prikazanu jednadžbu i zaključite dokazuje li jednadžba koju ste dobili u Excelu vezu tlaka i volumena iskazanu Boyle-Mariotteovim zakonom.
Koliko će se puta smanjiti polumjer mjehurića zraka na dubini od
ako je na površini atmosferski tlak
Temperatura vode ne mijenja se s dubinom.
Dva puta.
Izotermnu promjenu stanja plina opisuje Boyle-Mariotteov zakon koji kaže da je na stalnoj temperaturi tlak plina obrnuto proporcionalan s njegovim volumenom, tj.
Uz jednostavnu opremu, koja je navedena u uputi za izvođenje pokusa u ovoj jedinici, možete dokazati ispravnost Boyle-Mariotteova zakona.