


Kad gumeni elastični balon napunite zrakom, on poprimi svoj oblik. Zagrijete li ili ohladite taj balon, primijetit ćete promjene na njemu. Molekule plina promijenit će svoju brzinu. Pri zagrijavanju, molekule plina će se brže gibati i jače udarati o stjenke balona. Kao rezultat zagrijavanja tog balona, osim povećanja temperature plina u njemu, promijenit će se tlak i obujam plina. Ono što se događa sa zrakom u balonu nazivamo promjena stanja plina. Stanje plina opisuju tri fizikalne veličine: tlak
volumen
i termodinamička temperatura
Vrlo razrijeđeni plinovi ili plinovi kojima su molekule na vrlo velikim razmacima, ne sudaraju se, a pritom su i dimenzije samih molekula zanemarive u usporedbi s njihovim udaljenostima. Plin s takvim karakteristikama nazivamo idealni plin.
Za idealne plinove vrijede tri plinska zakona: Boyle-Mariotteov zakon, koji opisuje promjene stanja plina pri konstantnoj temperaturi, Gay-Lussacov zakon, koji opisuje promjene stanja plina pri konstantnom tlaku i Charlesov zakon, koji opisuje promjene stanja plina pri konstantnom volumenu. Zbog velikog doprinosa u razvoju znanosti, plinski zakoni su dobili imena prema prezimenima navedenih znanstvenika. Proučimo svaki zakon detaljnije.

Joseph Louis Gay-Lussac bio je francuski fizičar koji je proučavao promjenu stanja plina uz stalni tlak.
Eksperimentalnim putem otkrio je kako volumen plina ovisi o njegovoj termodinamičkoj temperaturi. Taj je zakon nazvan Gay-Lussacov zakon.
Animacija prikazuje promjenu volumena plina ovisno o njegovoj temperaturi, uz nepromijenjeni tlak plina.
Gay-Lussacov zakon za idealni plin kaže da se, uz stalan tlak, volumen plina proporcionalno mijenja s promjenom temperature. Takva promjena stanja plina naziva se izobarna promjena stanja plina.
Jednadžba kojom opisujemo izobarnu promjenu stanja plina je:
Za dva različita stanja plina, označenih indeksima i vrijedi:
što se može napisati i u ovom obliku:
Izobarna promjena stanja plina može se prikazati u
i
dijagramima.
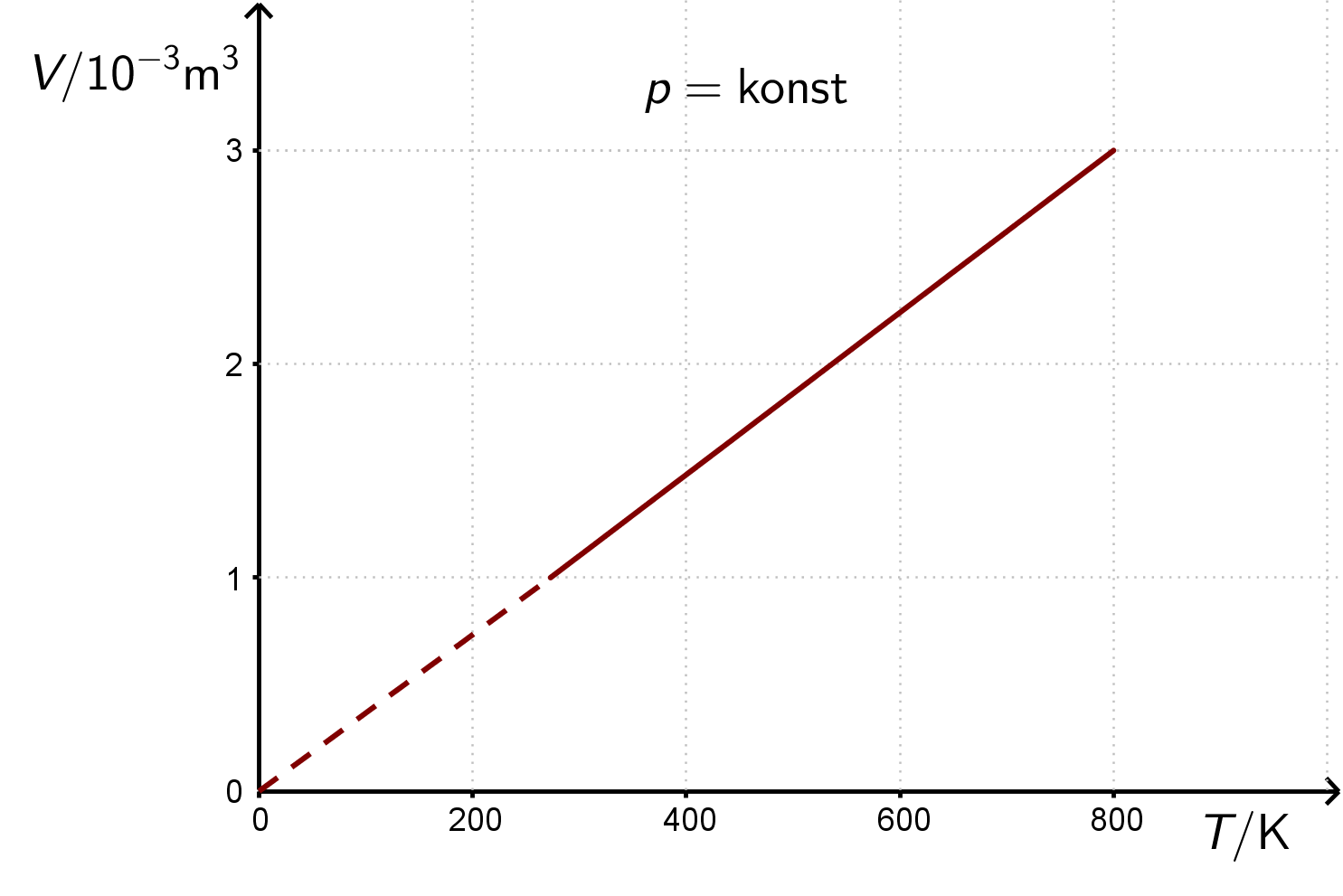
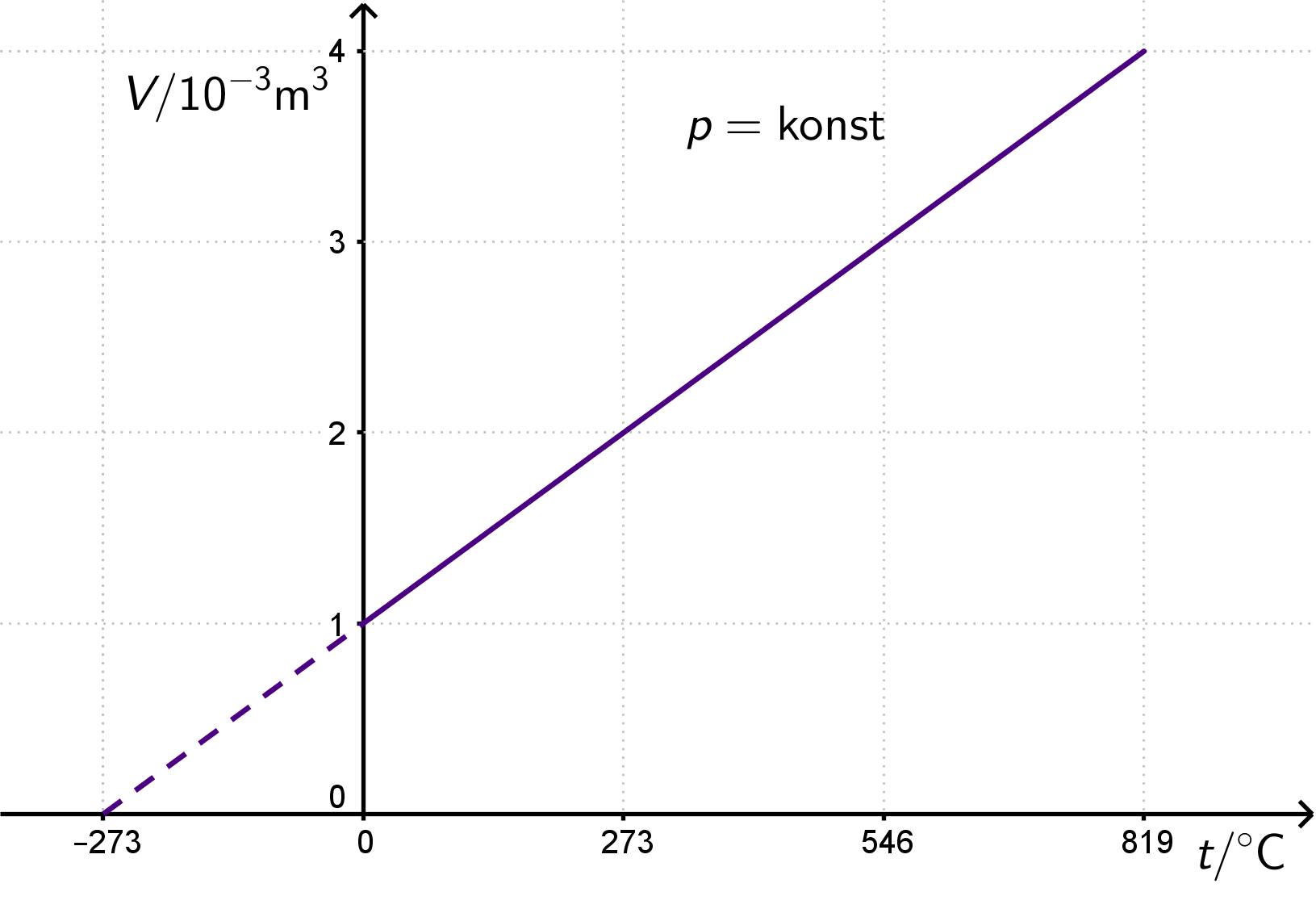
Pri vrlo niskim temperaturama Gay-Lussacov zakon ne vrijedi, zato je taj dio pravca u dijagramu prikazan isprekidanom crtom.
Pravac koji prikazuje izobarnu promjenu stanja plina naziva se izobara.
Razmislite kako biste prikazali izobarne promjene stanja plina u i dijagramima.
Uzmite gumeni elastični balon i ispunite ga zrakom. Stavite ga da na osunčano mjesto. Što se događa s volumenom zraka u njemu? Pokušajte taj balon rashladiti hladnom vodom. Što sad zapažate
–
što se događa s volumenom zraka u njemu?
Uz pretpostavku da je balon savršeno elastičan tijekom promjene stanja plina u njemu, vrijedio bi zakon za izobarnu promjenu stanja plina.
Razmislite!
Zašto će zakon za izobarnu promjenu stanja plina (zraka) u balonu vrijediti samo u jednome malome temperaturnom intervalu zagrijavanja ili hlađenja?
Zašto u ovome jednostavnom pokusu postoje ograničenja pri upotrebi zakona za izobarnu promjenu stanja plina?
Jeli tlak u balonu stalan?
Postoji li način kojim bi se ipak moglo spriječiti povećanje tlaka plina u balonu?
Odgovori su na sva pitanja slični. Balon nije savršeno elastičan i tlak će se ipak promijeniti pri zagrijavanju. Pokus u animaciji koja se nalazi u ovoj jedinici DOS-a prikazuje promjenu stanja plina uz zanemarivu promjenu tlaka tog plina. Međutim, za izvođenje tog pokusa potrebna je složenija oprema.
Ovaj jednostavan pokus s balonom na zoran način pokazuje promjenu stanja plina uz konstantan tlak. Volumen plina u balonu povećava se kada ga zagrijavamo. Bez obzira na to što se ipak mijenja tlak plina u balonu, vidljiva je proporcionalnost volumena i temperature plina.
U nekoj prostoriji temperatura zraka iznosi
Kad se ta prostorija zagrije pri stalnom tlaku, iz nje iziđe određena masa zraka. Omjer mase zraka u toj prostoriji prije zagrijavanja i nakon toga iznosi
Kolika je temperatura te prostorije nakon zagrijavanja?
Zakoni o plinu vrijede za model idealnog plina. U ovoj su jedinici kroz animaciju i vježbu navedena dva pokus koja je moguće izvesti u kabinetu fizike. Ti pokusi na zoran način prikazuju i dokazuju zakon kojim se iskazuje izobarna promjena stanja plina.
Izobarna promjena stanja plina dana je formulom: