


Pokušajte odgonetnuti što se događa s plinom u balonu žarulje nakon što kroz žarnu nit žarulje poteče struja? Što se događa sa zrakom u zatvorenoj čvrstoj boci kada je uronite u vruću vodu?
Opažate da je volumen plina nepromijenjen.
Čvrsta posuda sa zrakom uronjena je u vodu koja se grije kuhalom. Posuda je zatvorena čepom na kojemu se nalazi naprava za mjerenje tlaka
–
manometar. Zagrijavanjem vode zagrijava se i plin u posudi, a tlak u njoj raste.
Ilustracija prikazuje tri primjene zakonitosti opisane u prethodnom pokusu u svakodnevnom životu: automobilska guma u kojoj se nalazi određena količina zraka, boca sa sprejem, plinska boca.
Pokušajte objasniti što se događa s automobilskom gumom, bočicom spreja ili bocom plina kad temperatura raste uz stalan volumen.
U bocama sa sprejom i plinskim bocama nalazi se plin. Pri zagrijavanju se tlak plina povećava. Zato se staklene i metalne bočice sa sprejem ne smiju izlagati visokim temperaturama (više od
), zbog opasnosti od eksplozija. U automobilskim se gumama temperatura zraka može povisiti ako je, na primjer, automobil parkiran na osunčanom mjestu. Uz to, do zagrijavanja dolazi i tijekom vožnje. Uzrok su tome trenja koja nastaju između gume i ceste. Zato se automobilska guma puni do tlakova prema preporuci proizvođača pri uobičajenim temperaturama.
Charlesov zakon za idealni plin kaže da se uz stalan volumen tlak plina proporcionalno mijenja s promjenom termodinamičke temperature. Promjena stanja plina uz stalan volumen naziva se izovolumna ili izohorna promjena stanja plina.
Jednadžba za izohornu promjenu stanja plina:
Za dva različita stanja plina, pri čemu je indeksom 1 označeno početno stanje plina, a indeksom 2 konačno stanje, vrijedi jednadžba:
Ona može biti napisana i u obliku:
Prikaz izohorne promjene stanja plina u i dijagramima.
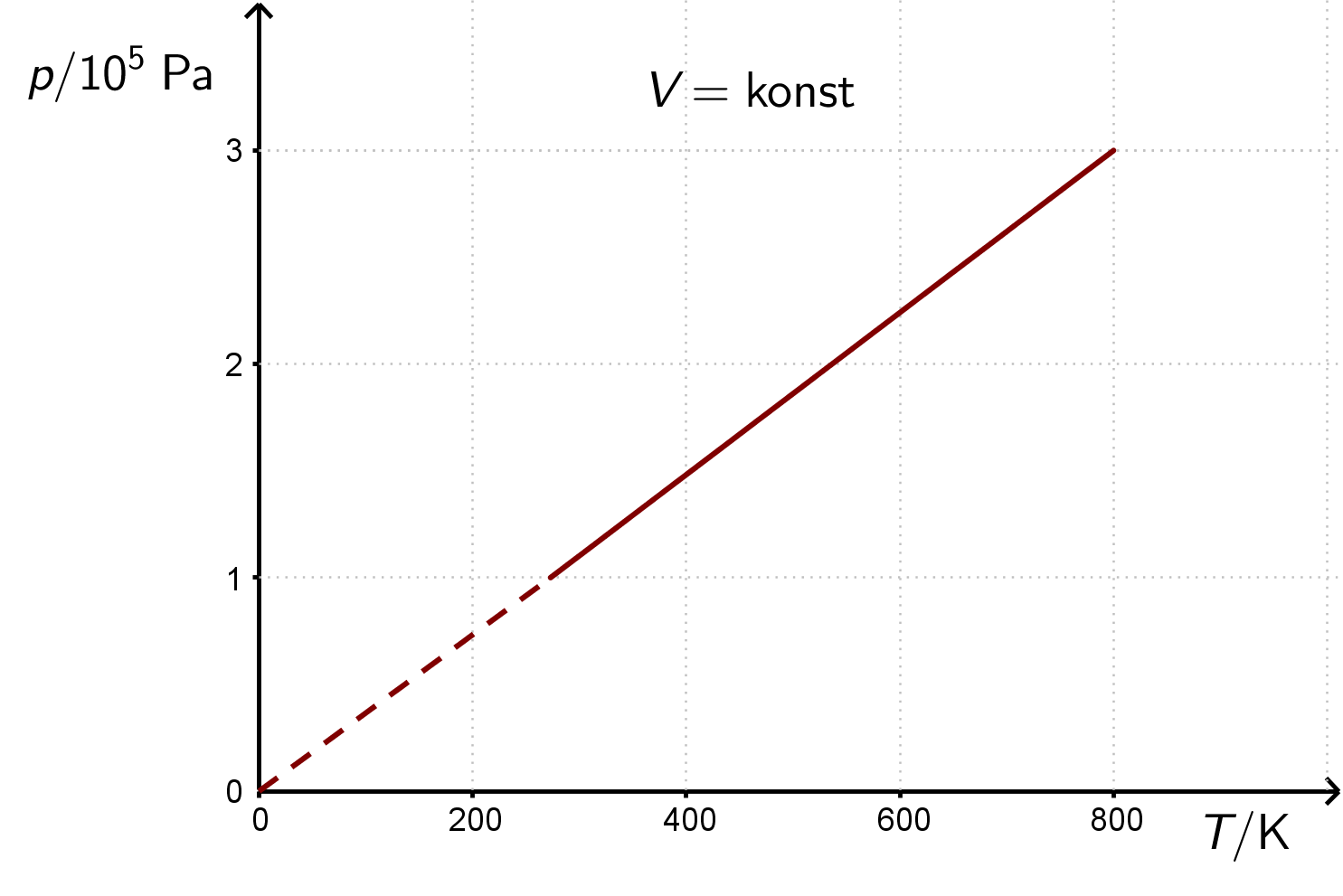
Pri vrlo niskim temperaturama ne vrijedi Charlesov zakon pa je taj dio pravca u dijagramima prikazan isprekidanom crtom.
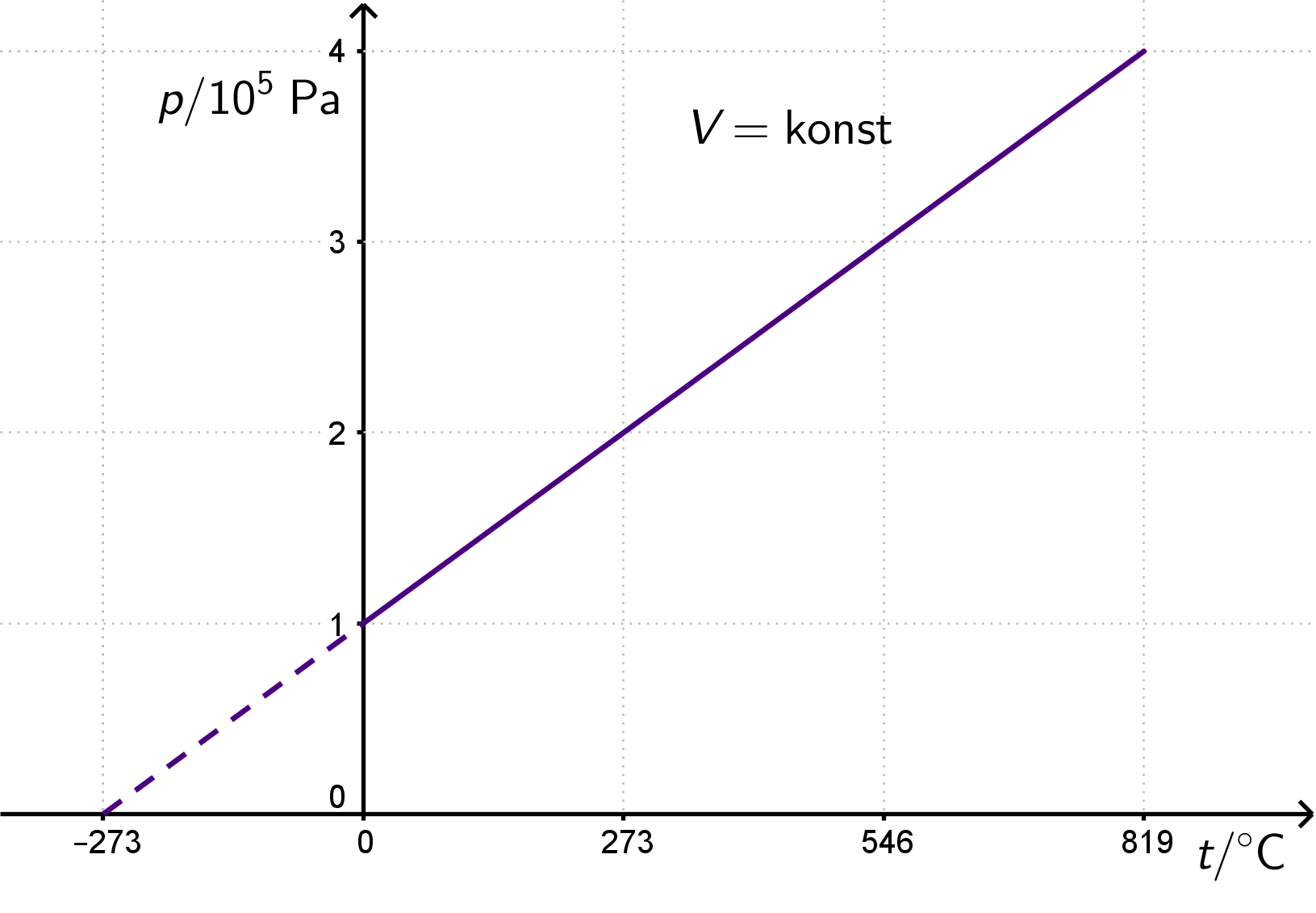
Pravac koji prikazuje izohornu promjenu stanja plina naziva se izohora.
Primjer 1.
U čvrstoj zatvorenoj posudi nalazi se zrak pri atmosferskom tlaku od bara i sobnoj temperaturi od Za koliko bi stupnjeva trebalo povećati temperaturu kako bi tlak zraka u boci narastao na bara?
Kako bismo riješili ovaj zadatak, potrebno je temperaturu iz Celzijevih stupnjeva preračunati u kelvine. Početni tlak plina iznosi:
Početna temperatura preračunata u kelvine iznosi:
Konačni tlak plina iznosi:
Budući da je u primjeru navedeno da se plin nalazi u zatvorenoj čvrstoj posudi, zaključak je da plin prolazi kroz izohornu promjenu stanja za koju vrijedi:
Iz te jednadžbe izačunava se konačna temperatura plina u zatvorenoj boci.
Preračunata u Celzijeve stupnjeve, konačna temperatura iznosi:
U primjeru je potrebno izračunati za koliko stupnjeva treba povećati temperaturu plina. Prema tome je potrebno izračunati temperaturnu razliku konačne i početne temperature:
Zrak u boci potrebno je zagrijati za kako bi njegov tlak porastao na bara.
Pri temperaturi
i atmosferskom tlaku
nadtlak u automobilskoj gumi iznosi
Koliki je nadtlak ako se zrak u gumi pri jednakom atmosferskom tlaku zagrije na
bara
Zakon koji opisuje izohornu promjenu stanja plina dobiven je eksperimentalnim putem. U videoprilogu ove jedinice može se vidjeti pokus koji prikazuje izohornu promjenu stanja plina i koji je moguće izvesti u kabinetu Fizike. Ako zabilježite nekoliko različitih izmjerenih vrijednosti tlaka i pripadajućih temperatura dobivenih pokusom, možete dokazati izrečen zakon za izohornu promjenu stanja plina koji glasi:
Koje od navedenih uvjeta pri stalnom obujmu i stalnoj količini plina, za izohorne promjene stanja idealni plin mora ispuniti:
1.
2.
3.
Tlak zraka u automobilskoj gumi pri temperaturi
iznosi
Nakon
vožne temperatura zraka povećala se za
Koliki je tlak zraka u gumi?