

U ovoj jedinici koristit ćemo se nekim pojmovima koji su uobičajeni u termodinamici. Njima se opisuju termodinamičke pojave i procesi pa je iznimno važno navesti ih i objasniti njihovo značenje.
Termodinamički sustav određena je količina materije koja zauzima određeni ograničeni volumen. Npr., stlačeni plin u posudi s pomičnim klipom primjer je termodinamičkog sustava.
Materija ili tvar koju sadrži termodinamički sustav može biti u nekom od triju agregacijskih stanja. Materija je unutar termodinamičkog sustava jednoliko raspoređena i istog je kemijskog sastava u svim područjima sustava.
Stanje termodinamičkog sustava opisuju tlak, temperatura i volumen pa ih zato nazivamo termodinamičke veličine. Ako su te veličine jednake za sve dijelove sustava i ako se ne mijenjaju tijekom vremena, smatramo da je sustav u stanju termodinamičke ravnoteže.
Okolina je sva materija izvan termodinamičkog sustava. Termodinamika se upravo bavi istraživanjem načina na koji je sustav u međudjelovanju s okolinom, odnosno bavi se načinima međudjelovanja više termodinamičkih sustava.
Zatvoreni sustav jest termodinamički sustav koji s okolinom izmjenjuje energiju, odnosno toplinu i rad, a pritom nema izmjene materije preko granice kojom su razdijeljeni sustav i okolina.
Otvoreni sustav jest termodinamički sustav koji s okolinom izmjenjuje energiju, rad i materiju.
Izolirani sustav s okolinom ne razmjenjuje ni materiju ni energiju.
Termodinamički proces jest prijelaz iz jednog ravnotežnog stanja u drugo, pri čemu se događa promjena veličina koje opisuju stanje plina unutar termodinamičkog sustava.
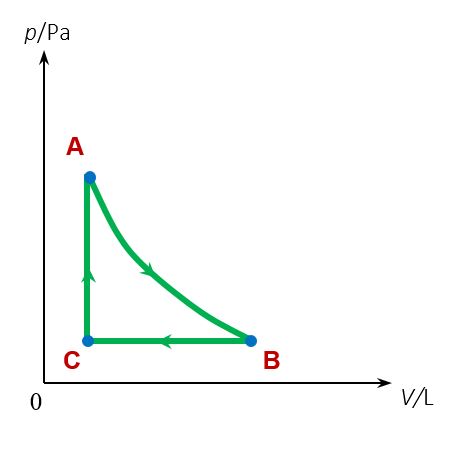
Kada se nakon nekoliko termodinamičkih procesa termodinamički sustav vraća u početno stanje, kažemo da je sustav prošao kružni proces. Na kraju takvog kružnog procesa sva svojstva sustava jednaka su onima s početka procesa. Kružni proces prikazuje se u dijagramu, a usmjerenost kružnog procesa označen je strelicama na grafu.
U cilindru s pomičnim klipom nalazi se plin, odnosno termodinamički sustav. Na klip je stavljen uteg. Kada se plin zagrijava, podižu se i klip i uteg.
Termodinamički sustav ima unutarnju energiju koja potječe od molekularnog gibanja čestica plina i potencijalne energije njihovih međudjelovanja. Unutarnja energija proporcionalna je temperaturi sustava. Povećanjem temperature sustava povećava se unutarnja energija sustava. Kako se dovodi toplina, tako raste temperatura, a samim time molekule plina još se brže gibaju.
Plin se širi i obavlja rad na utegu koji je u ovom slučaju dio okoline.
Prvi zakon termodinamike kaže da se dovedena toplina iz okoline dijelom utroši na povećanje unutarnje energije plina, a dijelom sustavu daje sposobnost obavljanja rada.
Prvi zakon termodinamike ustvari je zakon očuvanja energije, a njegova matematička formulacija glasi:
Prilikom primjene prvog zakona termodinamike iznimno je važno pravilno uvrštavati predznake fizikalnih veličina!
Predznak topline - kada se termodinamičkom sustavu toplina dovodi iz okoline, tada je ona pozitivnog predznaka ili a ako sustav predaje toplinu, ona je negativnog predznaka ili
Predznak rada - kada termodinamički sustav obavlja rad na okolini, tada je taj rad pozitivan ili
a ako okolina obavlja rad na termodinamičkom sustavu, kažemo da je rad negativan ili
Predznak promjene unutarnje energije - promjenu unutarnje energije sustava dobijemo iz formule koja opisuje prvi zakon termodinamike. Ovisno o predznacima
i
možemo dobiti povećanje unutarnje energije
ili smanjenje unutarnje energije
Naravno, predznak promjene unutarnje energije ovisi o iznosu početne i konačne unutarnje energije plina.
Za koliko se promijeni unutarnja energija sustava kojemu dovedemo
topline i istodobno nad njim obavimo rad od
Pomoć:
Treba voditi računa o predznacima! Pogledajte dogovorena pravila o predznacima. Kad je rad pozitivan, a kad negativan?
Postupak:
Količina topline ima pozitivan predznak jer sustavu dovodimo toplinu i ona iznosi
.
Rad ima negativan predznak jer se nad sustavom obavlja rad i iznosi
.
Koristeći se prvim zakonom termodinamike
, dolazimo do:
Prvi zakon termodinamike primjenjujemo u mogim termodinamičkim procesima. Pritom promjena unutarnje energije ne ovisi o smjeru procesa, već samo o početnom i konačnom stanju termodinamičkog sustava, a u kružnim procesima promjena unutarnje energije jednaka je nuli.
Adijabatski proces jest termodinamički proces pri kojem nema izmjene topline s okolinom. Toplina ne izlazi iz sustava niti u njega ulazi. Za adijabatski proces vrijedi:
Primjenom prvog zakona termodinamike
dolazimo do formule:
ili
Sustav obavlja rad na okolini smanjenjem svoje unutarnje energije. Takav je primjer adijabatsko širenje ili ekspanzija plina.
Pri adijabatskoj kompresiji ili smanjenju volumena plina na sustavu se obavlja rad iz okoline.
Valja napomenuti kako se adijabatski procesi odvijaju relativno brzo te se tijekom procesa ne stigne izmijeniti toplina s okolinom.
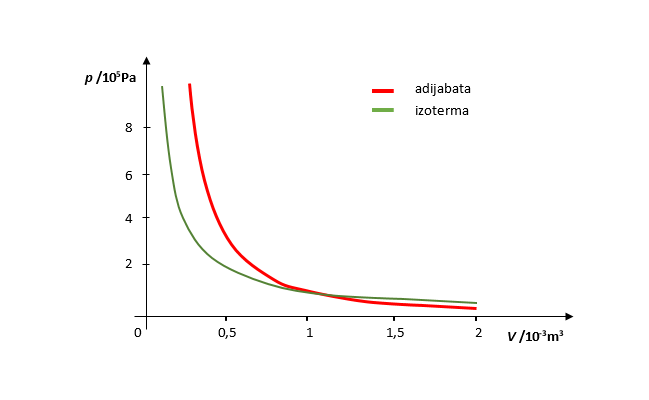
U izotermnim procesima tijekom promjene stanja plina nema promjene temperature. Ako nema promjene temperature, nema ni promjene unutarnje energije. Prema prvom zakonu termodinamike slijedi:
Prema tome, imamo:
Toplina koja ulazi u sustav pretvara se u mehanički rad. Želimo li da neki stroj obavlja rad zaključujemo kako je nužno stalno dovoditi toplinu .
Nije moguće konstruirati stroj koji bi nakon izvođenja kružnog procesa bez promjene unutarnje energije proizveo rad uz odnosno ne postoji stroj koji bi davao rad bez utroška energije.
Kad bi postojao takav stroj, nazvali bismo ga perpetuum mobile prve vrste.
Jedan od načina na koji se može definirati prvi zakon termodinamike jest: perpetuum mobile prve vrste ne postoji!
Postoje mnoge tvrdnje kako je perpetuum mobile prve vrste ipak moguć. Navodno postoje i različiti uređaji i naprave koje to dokazuju. Istražite na videokanalu Youtube radove koji pretpostavljaju da perpetuum mobile postoji i razmislite o njihovoj izvedivosti. Na kanalu Youtube ima i mnoštvo uputa za izradu kućnog "vječnog stroja". Pokušajte sami izraditi neke jednostavne modele i provjerite rade li oni zaista.
U izohornim procesima tijekom promjene stanja plina nema promjene volumena. Dakle
U prethodnoj jedinici naučili smo kako će rad biti obavljen samo ako dođe do promjene volumena tijekom procesa. Dakle u ovom slučaju vrijedi
Koristeći prvi zakon termodinamike dolazimo do:
Toplina dovedena termodinamičkom sustavu tijekom izohornog procesa povećava unutarnju energiju termodinamičkog sustava.
Prvi zakon termodinamike jest zakon očuvanja energije, a njegova matematička formulacija glasi:
DOGOVORI O PREDZNACIMA
Predznak topline - kada se termodinamičkom sustavu toplina dovodi iz okoline, tada je ona pozitivnog predznaka ili a ako sustav predaje toplinu, ona je negativnog predznaka ili
Predznak rada - kada termodinamički sustav obavlja rad na okolini, tada je taj rad pozitivan ili
a ako okolina obavlja rad na termodinamičkom sustavu, kažemo da je rad negativan ili
Predznak promjene unutarnje energije - promjenu unutarnje energije sustava dobijemo iz formule koja opisuje prvi zakon termodinamike. Ovisno o predznacima i možemo dobiti povećanje unutarnje energije ili smanjenje unutarnje energije Naravno, predznak promjene unutarnje energije ovisi o iznosu početne i konačne unutarnje energije plina.
Također, valja imati na umu i perpetuum mobile prve vrste: nije moguće konstruirati stroj koji bi nakon izvođenja kružnog procesa bez promjene unutarnje energije proizveo rad uz odnosno ne postoji stroj koji bi obavljao rad bez utroška energije.
Pojmove termodinamika, termodinamički sustav i termodinamički proces povežite s njihovim definicijama.
|
Termodinamika
|
promjena je veličina koje opisuje prijelaz iz jednog ravnotežnog stanja u drugo. |
|
Termodinamički proces
|
dio je materije omeđen nekom čvrstom granicom. |
|
Termodinamički sustav
|
dio je fizike koji se bavi proučavanjem pretvorbe topline u rad. |
Koja od sljedećih formula daje matematički oblik prvog zakona termodinamike?
U slijedećih par zadataka odredite predznake za toplinu, rad i promjenu unutarnje energije.
Kada toplinu dovodimo termodinamičkom sustavu, kažemo da je predznak topline
Kada toplinu odvodimo od termodinamičkog sustava, kažemo da je predznak topline
Kada termodinamički sustav obavlja rad na okolini, kažemo da rad ima predznak koji je
Kad se nad sustavom obavlja rad iz okoline, kažemo da je rad tada
Pri povećanju unutarnje energije, predznak promjene unutarnje energije jest
Pri smanjenju unutarnje energije, predznak promjene unutarnje energije jest
Idealni plin pri adijabatskoj ekspanziji daje
rada. Kolika je promjena unutarnje energije plina?
Pomoć:
Adijabatski procesi jesu oni procesi kod kojih nema izmjene topline. Dakle,
Iskoristite prvi zakon termodinamike i dobit ćete rješenje.
Idealnom plinu predali smo toplinu od
pri stalnom tlaku, a plin je pritom obavio rad od
Unutarnja energija plina:
Pomoć:
Primijenite prvi zakon termodinamike i pritom pazite na predznake.