Svojstva koloidnih otopina
- istražiti svojstva, sastav, vrstu i dobivanje koloidnih sustava
- objasniti koloidne sustave na primjerima
- povezati utjecaj različitih čimbenika sa stabilnosti koloidnih sustava
- kritički razmotriti utjecaj koloidnih sustava na život čovjeka i okoliš
Uvod
Što su koloidni sustavi?
Gdje ih sve koristimo u svakodnevnom životu?
Što im je zajedničko?
Uvod
Što su koloidni sustavi i gdje ih sve koristimo u svakodnevnom životu? Što im je zajedničko?
Sve tvari na slikama izgledaju homogeno (iste gustoće), ali jesu li te tvari doista homogene?
Koloidni sustavi
Koloidni sustavi su disperzni sustavi.
Sastoje se od disperznog sredstva i dispergirane faze.
Dispergirana faza je jednakomjerno dispergirana (raspršena) u otapalu, disperznom sredstvu.
Proučavanjem koloidnih sustava bavi se koloidna kemija.
Naziv koloidi predložio je 1861. godine škotski kemičar Thomas Graham kojeg često nazivaju i ocem koloidne kemije.
On je u kemiju uveo izraz colloid prema grčkoj riječi kόlla koja znači ljepilo.
Sve tvari na slikama izgledaju homogeno, ali jesu li te tvari doista homogene?
Koloidni sustavi
Koloidni sustavi su disperzni sustavi koji se sastoje se od disperznog sredstva i dispergirane faze. Dispergirana faza je jednakomjerno dispergirana (raspršena) u otapalu, disperznom sredstvu.
Proučavanjem koloidnih sustava bavi se koloidna kemija. Naziv koloidi predložio je 1861. škotski kemičar Thomas Graham kojeg često nazivaju i ocem koloidne kemije. On je u kemiju uveo izraz colloid prema grčkoj riječi kόlla koja znači ljepilo.
Zašto su nam važni koloidni sustavi?
Istražite praktičnu važnost koloidne kemije i koja svojstva otopina je proučavao T. Graham.
Pri tome se poslužite stručnim mrežnim stranicama.
Primjerice, pronađite stručne članke po zadanoj temi na mrežnim stranicama Google znalac.
S pojmom otopina upoznali ste se još u osnovnoj školi.
U čemu se razlikuju koloidi i suspenzije od pravih otopina saznat ćete nakon izvedenog pokusa.
Zašto su nam važni koloidni sustavi?
Istražite praktičnu važnost koloidne kemije i koja svojstva otopina je proučavao T. Graham. Pri tome se poslužite stručnim mrežnim stranicama. Primjerice, pronađite stručne članke po zadanoj temi služeći se tražilicom Google znalac.
S pojmom otopina upoznali ste se još u osnovnoj školi.
U čemu se razlikuju koloidi i suspenzije od pravih otopina saznat ćete nakon izvedenog pokusa.
S pojmom otopina upoznali ste se još u osnovnoj školi. U čemu se razlikuju koloidi i suspenzije od pravih otopina saznat ćete nakon izvedenog pokusa.
Koloidi (engl. colloid, prema grč. ϰόλλα: ljepilo + -oid), su disperzni sustavi s toliko malim česticama da čvrstu tvar u koloidnoj otopini ne vidimo okom, ali vidimo pomoću ultra mikroskopa.
Takve čvrste čestice su veličine do nekoliko stotina nanometara.
U koloidnim sustavima dispergirana faza i disperzno sredstvo mogu biti u različitim agregacijskim stanjima.
Zato postoje različiti tipovi koloidnih sustava:
- pjena,
- aerosol,
- emulzija,
- gel,
- sôl.
Koloidi (engl. colloid, prema grč. ϰόλλα: ljepilo + -oid), su disperzni sustavi s toliko malim česticama da čvrstu tvar u koloidnoj otopini ne vidimo okom, ali vidimo pomoću ultramikroskopa. Takve čvrste čestice su veličine od jednog do nekoliko stotina nanometara.
U koloidnim sustavima dispergirana faza i disperzno sredstvo mogu biti u različitim agregacijskim stanjima i zato postoje različiti tipovi koloidnih sustava: pjena, aerosol, emulzija, gel i sôl.
Čestice čvrste tvari koje se nalaze u tekućoj koloidnoj otopini ne možemo odijeliti filtriranjem.
U koloidnim sustavima čestice su još uvijek dovoljno velike da se mogu smatrati zasebnom fazom.
Kinetički se ponašaju kao molekule.
Da bi se čestice čvrste faze koloida iz tekuće faze ipak moglo filtrirati, potrebno ih je najprije koagulirati.
Jedna od metoda separacije čvrste faze je taloženje.
Taloženje se može postići pomoću vrlo brze centrifuge.
Uz to postoje i druge tehnike kao što je kromatografija, elektroforeza, elektroosmoza itd. pomoću kojih je moguće izdvojiti čvrstu fazu iz koloidnog sustava tekuće-čvrsto.
Svojstva koloidnih sustava
Neka od koloidnih svojstava su:
- Tyndallov fenomen,
- adsorpcija,
- koagulacija,
- elektroforeza,
- Brownovo gibanje,
- difuzija,
- ultrafiltracija,
- dijaliza itd.
Veličina čestica i vrsta disperzne tvari bitno utječu na svojstva koloidnih sustava.
Tyndallov fenomen
Tyndallov fenomen je pojava raspršivanja (disperzije) svjetlosti na česticama koloidnih dimenzija veličine od 1 do 200 nm.
Tyndallov fenomen karakterističan je za koloidne otopine, ali ne iz za prave otopine.
Za prave otopine kažemo da su za razliku od koloidnih „optički prazne otopine“.
Optički su prazne one otopine čija je veličina čestica toliko mala da na njima ne dolazi do raspršenja.
Čestice čvrste tvari koje se nalaze u tekućoj koloidnoj otopini ne možemo odijeliti filtriranjem. U koloidnim sustavima čestice su još uvijek dovoljno velike da se mogu smatrati zasebnom fazom, ali se kinetički ponašaju kao molekule. Da bi se čestice čvrste faze koloida iz tekuće faze ipak moglo filtrirati, potrebno ih je najprije koagulirati. Jedna od metoda separacije čvrste faze je taloženje koje se može postići pomoću vrlo brze centrifuge. Uz to postoje i druge tehnike kao što je kromatografija, elektroforeza, elektroosmoza itd. pomoću kojih je moguće izdvojiti čvrstu fazu iz koloidnog sustava tekuće-čvrsto.
Svojstva koloidnih sustava
Veličina čestica i vrsta disperzne tvari bitno utječu na svojstva koloidnih sustava. Neka od koloidnih svojstava su: Tyndallov fenomen, adsorpcija, koagulacija, elektroforeza, Brownovo gibanje, difuzija, ultrafiltracija, dijaliza itd.
Tyndallov fenomen
Tyndallov fenomen je pojava raspršivanja (disperzije) svjetlosti na česticama koloidnih dimenzija veličine od 1 do 200 nm. Tyndallov fenomen karakterističan je za koloidne otopine, ali ne i za prave otopine. Za prave otopine kažemo da su za razliku od koloidnih „optički prazne otopine“. Optički su prazne one otopine čija je veličina čestica toliko mala da na njima ne dolazi do raspršenja.
Tyndallov fenomen
Tyndallov fenomen
Istražite kada i po kojem znanstveniku je pojava raspršenja svjetlosti na koloidnim česticama dobila ime.
Istražite koje su mogućnosti primjene te pojave u fizici, matematici i likovnoj umjetnosti.
Pronađite recepturu za pripravu nekih stabilnih koloidnih sustava na kojima se može dokazati što više svojstava koloida.
Proučite sadržaj dostupan na poveznici.
Tyndallov fenomen
Istražite kada i po kojem znanstveniku je pojava raspršenja svjetlosti na koloidnim česticama dobila ime, kao i mogućnosti primjene te pojave u fizici, matematici i likovnoj umjetnosti.
Pronađite recepturu za pripravu nekih stabilnih koloidnih sustava na kojima se može dokazati što više svojstava koloida. Proučite sadržaj dostupan na poveznici.
Adsorpcija
Adsorpcija (lat. adsorptio: pripijanje), proces u kojemu površina krutog tijela veže na sebe čestice plina ili kapljevine.
Zbog svoje velike površine koloidne čestice imaju veliku sposobnost adsorpcije jer se time smanjuje njihova površinska energija.
Adsorpcija omogućava razdvajanje ili pročišćavanje plinova i kapljevina.
Npr. ugljen u plinskim maskama djelotvorno upija otrove iz zraka.
Silika-gel adsorbira molekule vode iz vlažnog zraka.
Adsorpcija
Adsorpcija (lat. adsorptio: pripijanje), proces u kojemu površina krutog tijela veže na sebe čestice plina ili kapljevine. Zbog svoje velike površine koloidne čestice imaju veliku sposobnost adsorpcije jer se time smanjuje njihova površinska energija. Adsorpcija omogućava razdvajanje ili pročišćavanje plinova i kapljevina. Npr. ugljen u plinskim maskama djelotvorno upija otrove iz zraka, a silika-gel adsorbira molekule vode iz vlažnog zraka.
Koagulacija
Zbog malih dimenzija čestica i velikog stupnja njihove disperzije (raspršenja), ukupna površina koloida je relativno velika.
Stoga, za održavanje takve površine potrebna i veća energija.
Koloidni sustavi zato su nestabilni te se koloidne čestice udružuju u veće čestice, s manjom ukupnom površinom.
Dolazi do koagulacije (grušanje, širenje).
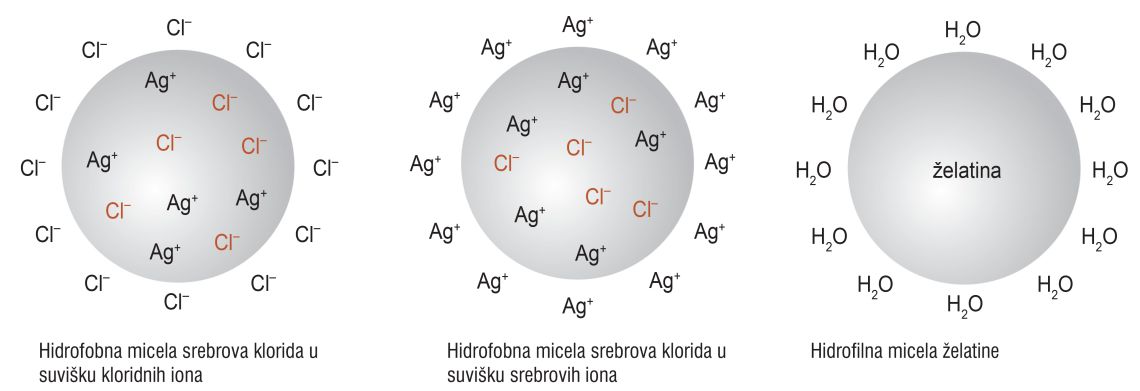
Čestice dispergirane faze raspršene su u obliku koloidnih micela koje su nakupine iona ili molekula na površini čestice dispergirane faze.
Koloidne micele se dalje ne udružuju, već odbijaju zbog ionskog ili hidratnog ovoja na njihovoj površini.
Koloidne micele mogu biti:
- hidrofobne (micele srebrnog klorida, )
- hidrofilne (micele želatine).
Koagulacija
Zbog malih dimenzija čestica i velikog stupnja njihove disperzije, ukupna površina koloida je relativno velika, pa je za održavanje takve površine potrebna i veća energija. Koloidni sustavi zato su nestabilni, te se koloidne čestice udružuju u veće čestice, s manjom ukupnom površinom. Dolazi do koagulacije. Čestice dispergirane faze raspršene su u obliku koloidnih micela, nakupina iona ili molekula. Koloidne micele se dalje ne udružuju, već odbijaju zbog ionskog ili hidratnog ovoja na njihovoj površini.
One mogu biti:
- hidrofobne (micele srebrova klorida, )
- hidrofilne (micele želatine).
Sve koloidne micele jednog koloidnog sustava imaju isti naboj.
Kakav će naboj biti ovisi o načinu priprave koloidnog sustava.
U hidrofobnim koloidima doći će do koagulacije dodatkom elektrolita.
Elektroliti će neutralizirati ione na površini micele i tako omogućiti zgrušavanje tj. koagulaciju.
U hidrofilnim koloidima dolazi do koagulacije zagrijavanjem tj. uklanjanjem hidratnog ovoja.
Elektroforeza
Elektroforeza je postupak odvajanja čestica koloidnih dimenzija djelovanjem istosmjerne struje.
Koloidne čestice istog naboja putuju različitim brzinama prema suprotno nabijenoj elektrodi.
Na osnovi različite brzine putovanja može se identificirati pojedine koloide, npr. aminokiseline i proteine.
Sve koloidne micele jednog koloidnog sustava imaju isti naboj, a kakav će on biti ovisi o načinu priprave koloidnog sustava. U hidrofobnim koloidima doći će do koagulacije dodatkom elektrolita koji će neutralizirati ione na površini micele i tako omogućiti zgrušavanje tj. koagulaciju. U hidrofilnim koloidima dolazi do koagulacije zagrijavanjem tj. uklanjanjem hidratnog ovoja.
Elektroforeza
Elektroforeza je postupak odvajanja čestica koloidnih dimenzija djelovanjem istosmjerne struje. Koloidne čestice istog naboja putuju različitim brzinama prema suprotno nabijenoj elektrodi. Na osnovi različite brzine putovanja može se identificirati pojedine koloide, npr. aminokiseline i proteine.

Koloidni sustavi u forenzici
Istražite koja svojstva koloidnih sustava se primjenjuju u elektroforezi?
Koja je primjena elektroforeze u forenzici.
Koristite mrežne stranice koje se bave forenzikom.
Informacije možete pronaći i na mrežnim stranicama Centra za forenzična ispitivanja, istraživanja i vještačenja Ivan Vučetić ili u izravnom kontaktu s njima.

Koloidni sustavi u forenzici
Istražite koja svojstva koloidnih sustava se primjenjuju u elektroforezi i njenu primjenu u forenzici. Koristite mrežne stranice koje se bave forenzikom. Informacije možete pronaći i na mrežnim stranicama Centra za forenzična ispitivanja, istraživanja i vještačenja Ivan Vučetić ili u izravnom kontaktu s njima.
Brownovo gibanje
Brownovo gibanje je kaotično, neprestano kretanje koloidnih čestica u tekućem disperznom sredstvu.
Brzina gibanja koloidnih čestica ovisi o temperaturi.
Zbog Brownovog gibanja molekule otapala predaju svoju termičku energiju dispergiranim česticama usljed čega one difundiraju.
Pojavu je prvi uočio botaničar R. Brown 1827. godine kad je promatrao gibanje čestica cvjetnog praha u vodi koje su se kaotično gibale.
Difuzija
Difuzija je pojava spontanoga miješanja čestica jedne tvari s česticama druge tvari, do izjednačenja koncentracije otopine.
Kako su dimenzije koloidnih čestica veće (>) od dimenzija molekula u pravim otopinama i brzina njihove difuzije je manja (<) od brzine difuzije molekula.
Jednostavan pokus u kojem možete promatrati brzinu difuzije možete tako da na želatinu u jednu čašu ulijete otopinu bakrova(II) sulfata.
U drugu čašu s želatinom ulijete otopinu kalijeva dikromata.
Objasnite zašto se difuzija u ove dvije čaše odvija različitim brzinama?
Ultrafiltracija
Ultrafiltracija je filtracija koloidne otopine pomoću polupropusne membrane koju se naziva ultrafilter.
U ultrafilteru pod utjecajem hidrostatskog tlaka čestice tekućine i male molekulske mase prolaze kroz membranu.
Dijaliza
Dijaliza je postupak odvajanja koloidnih čestica od iona iz elektrolita pomoću polupropusne membrane (životinjski mjehur, celofan i drugi sintetski materijali).
Brownovo gibanje
Brownovo gibanje je kaotično neprestano kretanje koloidnih čestica u tekućem disperznom sredstvu. Brzina gibanja koloidnih čestica ovisi o temperaturi. Zbog Brownovog gibanja molekule otapala predaju kinetičku energiju dispergiranim česticama zbog čega one difundiraju.
Pojavu je prvi uočio botaničar R. Brown 1827. godine, promatrajući kaotično gibanje čestica cvjetnog praha u vodi.
Difuzija
Difuzija je spontano miješanje čestica različitih tvari, do izjednačenja koncentracije otopine. Kako su dimenzije koloidnih čestica veće od dimenzija molekula u pravim otopinama i brzina njihove difuzije je manja od brzine difuzije molekula.
Jednostavan pokus u kojem možete promatrati brzinu difuzije možete tako da na želatinu u jednu čašu ulijete otopinu bakrova(II) sulfata, a u drugu čašu sa želatinom otopinu kalijeva dikromata. Objasnite zašto se difuzija u ove dvije čaše odvija različitim brzinama?
Ultrafiltracija
Ultrafiltracija je filtracija koloidne otopine pomoću polupropusne membrane koju se naziva ultrafilter, gdje pod utjecajem hidrostatskog tlaka čestice tekućine i male molekulske mase prolaze kroz membranu.
Dijaliza
Dijaliza je postupak odvajanja koloidnih čestica od iona iz elektrolita pomoću polupropusne membrane (životinjski mjehur, celofan i drugi sintetski materijali).
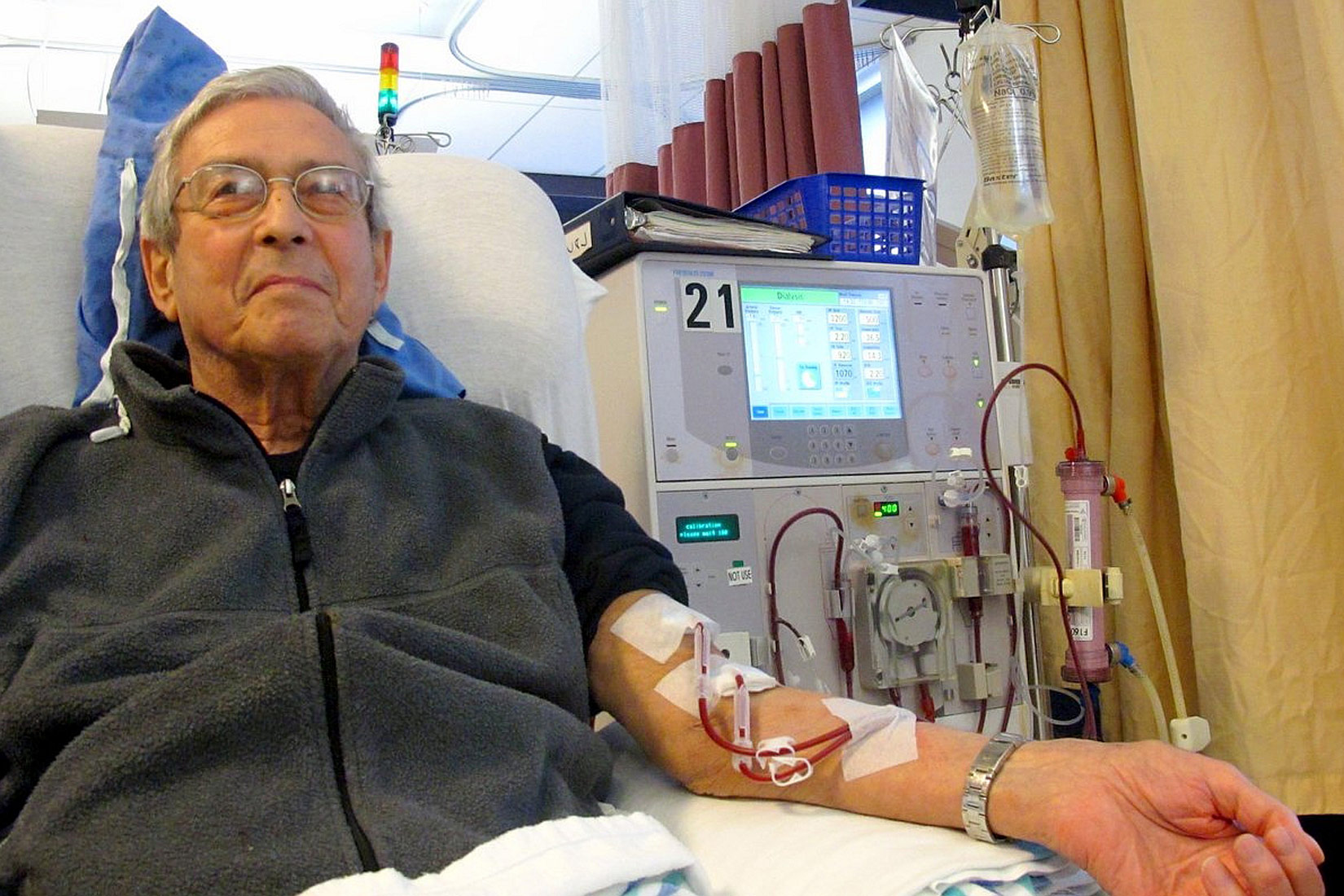
U medicini se bubrežnim bolesnicima dijalizom pročišćava krv, koja je koloidni sustav, od štetnih tvari koje se inače izlučuju putem mokraće kad bubrezi pravilno rade.
Taj se postupak naziva hemodijaliza.
Krv se ispumpava iz arterije kroz polupropusnu membranu.
Male čestice otpadnih tvari prolaze kroz membranu i ispiru se izotoničnom otopinom za dijalizu.
Zatim se krv vraća u venu.
Sedimentacija
Sedimentacija je proces spontanog taloženja koloidnih čestica pod djelovanjem gravitacijske sile.
Najčešći i najznačajniji koloidni sustavi
Najčešći i najznačajniji su koloidni sustavi koje nazivamo sôl i gel.
Želatina je primjer sôla koji često koristimo u svakodnevnom životu.
U sôl stanju čvrste čestice disperzne faze se slobodno kreću u tekućem disperznom sredstvu.
U stanju gela nastaje mrežasta struktura tekuće dispergirane faze u kojoj je uklopljeno mnogo čestica čvrstog disperznog sredstva.
Prijelaz iz sôl stanja u gel stanje može biti reverzibilan ili ireverzibilan proces.
U medicini se bubrežnim bolesnicima dijalizom pročišćava krv, koja je koloidni sustav, od štetnih tvari koje se inače izlučuju putem mokraće kad bubrezi pravilno rade. Taj se postupak naziva hemodijaliza. Krv se ispumpava iz arterije kroz polupropusnu celofansku membranu. Male čestice otpadnih tvari prolaze kroz membranu i ispiru se izotoničnom otopinom za dijalizu i zatim se krv vraća u venu.
Sedimentacija
Sedimentacija proces spontanog taloženja koloidnih čestica pod djelovanjem gravitacijske sile.
Najčešći i najznačajniji koloidni sustavi
Najčešći i najznačajniji su koloidni sustavi koje nazivamo sôl i gel. Želatina je primjer sôla koji često koristimo u svakodnevnom životu. U sôl stanju čvrste čestice dispergirane faze se slobodno kreću u tekućem disperznom sredstvu, a u stanju gela nastaje mrežasta struktura tekuće dispergirane faze u kojoj je uklopljeno mnogo čestica čvrstog disperznog sredstva. Prijelaz iz sôl stanja u gel stanje može biti reverzibilan ili ireverzibilan proces.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Što je uzrok tome i zašto je mlijeko bijelo, a ne bezbojna tekućina?
Mlijeko je bijelo, neprozirno jer sadrži sićušne kapljice masti raspršene u vodi u kojoj se te kapljice ne otapaju niti se iz nje izlučuju.
Mlijeko sadrži bjelančevinu kazein.
Kazein sprječava izdvajanje masti iz mlijeka.
Kazein djeluje kao emulgator, tvar koja uzrokuje stabilnost emulzije.
Što je uzrok tome i zašto je mlijeko bijelo, a ne bezbojna tekućina?
Mlijeko je bijelo, neprozirno jer sadrži sićušne kapljice masti raspršene u vodi u kojoj se te kapljice ne otapaju niti se iz nje izlučuju. Mlijeko sadrži bjelančevinu kazein, koja sprječava izdvajanje masti iz mlijeka. Kazein djeluje kao emulgator, tvar koja uzrokuje stabilnost emulzije.
Dobivanje koloida
Koloidne otopine može se pripremiti:
- iz pravih otopina, kondenzacijom (povećanjem dimenzija čestica koloida)
- iz suspenzija (grubo disperznih sustava) disperzijom (smanjivanjem dimenzija čestica koloida)
Uporaba koloida
Koloidni sustavi su neophodni za život i vrlo su rašireni u prirodi.
Dobivanje koloida
Koloidne otopine može se pripremiti:
- iz pravih otopina, kondenzacijom (povećanjem dimenzija čestica)
- iz suspenzija disperzijom (smanjivanjem dimenzija čestica)
Uporaba koloida
Koloidni sustavi su neophodni za život i vrlo su rašireni u prirodi.
Pretražite mrežne stranice i prikupite podatke o primjeni koloidnih sustava i njihovoj ulozi u industriji.
Načinite infografiku služeći se alatom Piktochart.
Proučite podatke u tablici.
Usporedite koloidne sustave s pravim otopinama i sa suspenzijama.
Pretražite mrežne stranice i prikupite podatke o primjeni koloidnih sustava i njihovoj ulozi u industriji. Načinite infografiku služeći se alatom Piktochart.
Proučite podatke u tablici i usporedite koloidne sustave s pravim otopinama i sa suspenzijama.
| vrste disperznih sustava | prava otopina | koloidni sustav | suspenzija |
|---|---|---|---|
| veličina čestica | < 1 nm | 1 – 200 nm | > 200 nm |
| vrsta tvari | homogene smjese | heterogene smjese | heterogene smjese |
| odjeljivanje | Čvrstu tvar (ne vidimo okom) i iz prave otopine ne možemo ju odijeliti filtracijom. |
Čvrstu tvar (ne vidimo okom, ali se vidi ultra mikroskopom) iz tekuće koloidne otopine ne možemo odijeliti filtracijom.
|
Čvrstu tvar (vidimo okom) i iz tekućih suspenzija možemo ju odijeliti filtriranjem ili taloženjem. |
| Tyndallov fenomen | NE | DA | PONEKAD DA |
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Pripremljen je sôl srebrova klorida ( ) sa suviškom kloridnih iona.
Koji će elektrolit i zašto biti djelotvorniji pri koagulaciji tog sôla?
Željezov(III) nitrat, Fe(NO3)3, jer kation, Fe3+, ima veći (>) pozitivan naboj (+), od kationa, , iz natrijeva nitrata ().
Micela tog sola imati će negativan naboj (-) zbog suviška kloridnih iona, pa će na njegovu koagulaciju utjecati pozitivno nabijeni ioni (+).
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Pojmovima u lijevom stupcu pridružite odgovarajući pojam u desnom stupcu.
koloidni sustav
temperatura i tlak pri kojem su sve tri faze sustava u ravnoteži
sniženje ledišta
nestabilna otopina
osmoza
prolaz vode kroz polupropusnu membranu iz razrjeđenije u koncentriraniju otopinu
trojna točka
Tyndallov fenomen koligativno svojstvo
prezasićena otopina
koligativno svojstvo temperatura i tlak pri kojem su sve tri faze sustava u ravnoteži
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Pripremljen je sôl srebrova klorida sa suviškom kloridnih iona. Koji će elektrolit i zašto biti djelotvorniji pri koagulaciji tog sôla?
Željezov(III) nitrat, , jer kation, , ima veći pozitivan naboj, od kationa, , iz natrijeva nitrata ().
Micela tog sola imati će negativan naboj zbog suviška kloridnih iona, pa će na njegovu koagulaciju utjecati pozitivno nabijeni ioni.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Pojmovima u lijevom stupcu pridružite odgovarajući pojam u desnom stupcu.
koloidni sustav
prolaz vode kroz polupropusnu membranu iz razrjeđenije u koncentriraniju otopinu
sniženje ledišta
koligativno svojstvo
osmoza
Tyndallov fenomen
trojna točka
nestabilna otopina
prezasićena otopina
temperatura i tlak pri kojem su sve tri faze sustava u ravnoteži
Želite li pokušati ponovo?