Koligativna svojstva otopina
- objasniti koligativna svojstva (tlak pare, sniženje ledišta, povišenje vrelišta, osmotski tlak)
- prepoznati koligativna svojstva na primjerima
- naglasiti važnu ulogu difuzije i osmoze u živome svijetu
- izračunati osmotski tlak otopina
- izračunati promjenu ledišta (vrelišta) koju će izazvati otapanje određene količine tvari u određenome otapalu
Uvod
Za pouzdan rad automobilskog motora pri niskim temperaturama koristi se antifriz, smjesa etilen-glikola i vode.
Etilen-glikol, C2H4(OH)2, gusta je i otrovna tekućina slatkastog okusa.
Navedena smjesa ima niže ledište od ledišta vode.
Zato se koristi zimi za hlađenje motora.
Uvod
Za pouzdan rad automobilskog motora pri niskim temperaturama koristi se antifriz, smjesa etilen-glikola i vode. Etilen-glikol, \(\ce{C2H4(OH)2}\), gusta je i otrovna tekućina slatkastog okusa. Navedena smjesa ima niže ledište od ledišta vode, zato se koristi zimi za hlađenje motora.
Koligativna svojstva otopina su svojstva otopina nehlapljivih otopljenih tvari.
Ova svojstva ovise o koncentraciji otopljenih čestica, a ne o njihovoj prirodi.
Koligativnim svojstvima naziva se sljedeće pojave:
- sniženje tlaka para
- osmotski tlak
- povišenje vrelišta (ebulioskopija)
- sniženje ledišta (krioskopija)
Sniženje tlaka para
Iznad bilo koje tekućine postoji različit broj molekula tekućine koje uzrokuju neki tlak.
Taj se tlak naziva tlak para tekućine.
Eksperimentalno je utvrđeno da je tlak para otapala iznad otopine proporcionalan umnošku (•) množinskog udjela otapala, χ0 , i tlaka para čistog otapala, p0.
Izraz koji pokazuje tu ovisnost poznat je kao Raoultov zakon (čitaj Raulov zakon).
p = χ0 ⋅ p0
Koligativna svojstva otopina su svojstva otopina nehlapljivih otopljenih tvari. Ova svojstva ovise o koncentraciji otopljenih čestica, a ne o njihovoj prirodi. Koligativnim svojstvima nazivaju se sljedeće pojave:
- sniženje tlaka para
- osmotski tlak
- povišenje vrelišta
- sniženje ledišta
Sniženje tlaka para
Iznad bilo koje tekućine postoji različit broj molekula tekućine koje uzrokuju neki tlak. Taj se tlak naziva tlak para tekućine.
Eksperimentalno je utvrđeno da je tlak para otapala iznad otopine proporcionalan umnošku množinskog udjela otapala, χ0 , i para čistog otapala, p0 . Izraz koji pokazuje tu ovisnost poznat je kao Raoultov zakon (čitaj Raulov zakon).
\(p = \chi_\textrm{0} \cdot p^\textrm{0} \)
U površinskom sloju otapala nalaze samo molekule otapala.
Neka količina tih molekula prelazi u parnu fazu.
U slučaju otopine, u površinskom sloju otopine nalaze se i čestice otopljene nehlapljive tvari koje ne isparavaju.
Zbog toga iz otopine u parnu fazu može prijeći manji (<) broj molekula otapala nego li što prelazi broj molekula u slučaju čistog otapala.
Budući da se u parnoj fazi otopine nalazi manji (<) broj molekula otapala nego li u parnoj fazi čistog otapala, tlak para otapala iznad otopine manji (<) je od tlaka para iznad čistog otapala.
Prema tome otopljena nehlapljiva tvar, primjerice saharoza, snižava tlak para iznad otopine u odnosu na čisto otapalo pri istoj temperaturi.
U površinskom se sloju otapala nalaze samo molekule otapala, i neka količina tih molekula prelazi u parnu fazu.
U slučaju otopine, u površinskom sloju otopine nalaze se i čestice otopljene nehlapljive tvari koje ne isparavaju. Zbog toga iz otopine u parnu fazu može prijeći manji broj molekula otapala u odnosu na broj molekula koji prelazi u parnu fazu kod čistog otapala.
Budući da se u parnoj fazi otopine nalazi manji broj molekula otapala nego li u parnoj fazi čistog otapala, tlak para otapala iznad otopine manji je od tlaka para iznad čistog otapala.
Prema tome otopljena nehlapljiva tvar, primjerice, saharoza, snižava tlak para iznad otopine u odnosu na tlak para čistog otapala pri istoj temperaturi.
Riješeni primjer 1.
Koliko iznosi tlak para vode (H2O) iznad vodene otopine fruktoze (C6H12O6) s masenim udjelom (w) 10,0 %, ako tlak para iznad vode (p) pri 25 °C (t) iznosi 3,169 kPa?
Za koliko se snizio tlak para otopine fruktoze (C6H12O6) u odnosu na tlak para vode (H2O), kao čistog otapala?
Ako se pretpostavi da je razrijeđena otopina priređena otapanjem nehlapljive tvari B koja u otopini nije disocirana, tada je pB0 = 0.
Iz toga možemo zaključiti da tlak para otapala iznad otopine ovisi samo o molekulama otapala A, pA0.
Za tako razrijeđenu otopinu vrijedi Raoultov zakon.
p = χA ⋅ pA0
Zbroj (+) množinskih udjela otapala χA i otopljene tvari χB iznosi 1.
χA + χB = 1
prema tome:
χA = 1 – χB
slijedi:
p = (1 – χB) ⋅ pA0
rješavanjem zagrade slijedi:
p = pA0 – χB p0
Tlak para otapala A snižen je za iznos χB ⋅ pA0.
Zadano je:
U 100 g 10,0%-tne (w) otopine masa (m) fruktoze (C6H12O6) iznosi 10,0 g.
Masa vode (m, H2O) iznosi 90,0 g.
w (C6H12O6) =10,0%
m (C6H12O6) = 10,0 g
Mr (C6H12O6) = 180,2
m (H2O) = 90,0 g
Mr (H2O) = 18,02
p (H2O) = 3,169 kPa
t = 25 °C
Traži se:
p = ?
Izradak:
n (C6H12O6) = m (C6H12O6) / M (C6H12O6)
= 10,0 g / 180,2 g mol–1
= 0,0555 mol
n (H2O) = m (H2O) / M (H2O)
= 90,0 g / 18,02 g mol–1
= 4,99 mol
χ (C6H12O6) = n (C6H12O6) / n (C6H12O6) + n (H2O)
= 0,0555 mol / 0,0555 mol + 4,99 mol
= 0,0110 mol
χ (H2O) = n (H2O) / n (H2O) + n (C6H12O6)
= 4,99 mol / 4,99 mol + 0,0555 mol
= 0,989 mol
p = χA ⋅ pA0
p = χ (H2O) ⋅ p (H2O)
p = 0,989 ⋅ 3,169 kPa
p = 3,134 kPa
Do rezultata možete doći na dva načina:
a) oduzimanjem (-) tlaka para otopine od tlaka para vode ili
b) množenjem (•) množinskog udjela otopljene tvari s tlakom para vode.
Δp = p (H2O) – p (otopina)Δp = 3,169 kPa – 3,134 kPa
Δp = 0,035 kPa
Δp = χ (C6H12O6) ⋅ p (H2O)Δp = 0,011 ⋅ 3,169 kPa
Δp = 0,035 kPa
Odgovor:
Tlak para (p) iznad 10,0%-tne (w) otopine fruktoze (C6H12O6) je 3,134 kPa.
Prema tome tlak para otopine u odnosu na vodu kao otapalo pri 25 °C (t) niži je za 0,035 kPa.
Riješeni primjer 1.
Koliko iznosi tlak para vode iznad vodene otopine fruktoze s masenim udjelom 10,0 %, ako tlak para iznad vode pri 25 °C iznosi 3,169 kPa? Za koliko se snizio tlak para otopine fruktoze u odnosu na tlak para vode, kao čistog otapala?
Za tako razrijeđenu otopinu vrijedi Raoultov zakon.
\(p = \chi_\textrm{A} \cdot p_\textrm{A}^\textrm{0} \)
Zbroj množinskih udjela otapala \(\chi_\textrm{A}\) i otopljene tvari \(\chi_\textrm{B}\) iznosi 1.
\( \chi_\textrm{A} + \chi_\textrm{B} = 1\)
prema tome:
\(\chi_\textrm{A} = 1 – \chi_\textrm{B}\)
slijedi:
\(p = (1 – \chi_\textrm{B}) \cdot p_\textrm{A}^\textrm{0}\)
rješavanjem zagrade slijedi:
\(p = p_\textrm{A}^\textrm{0} – \chi_\textrm{B} p_\textrm{A}^\textrm{0}\)
Tlak para otapala A snižen je za iznos \(\chi_\textrm{B} \cdot p_\textrm{A}^\textrm{0}\) .
Zadano je:
U 100 g 10,0 %-tne otopine masa fruktoze iznosi 10,0 g, a masa vode 90,0 g.
\(
w(\ce{C6H12O6}) = \pu{10,0 \%}\)
\(m(\ce{C6H12O6}) = \pu{10,0 g} \)
\(M_\textrm{r}(\ce{C6H12O6}) = 180,2\)
\(m(\ce{H2O}) = \pu{90,0 g}\)
\(M_\textrm{r}(\ce{H2O}) = 18,02\)
\(p(\ce{H2O}) = \pu{3,169 kPa}\)
\( t = \pu{25 ^\circ C} \)
Traži se:
\( p = ? \)
\(
n(\ce{C6H12O6}) &= \dfrac{m(\ce{C6H12O6})}{M(\ce{C6H12O6})} \)
\(= \dfrac{\pu{10 g}}{\pu{180,2 g/mol}}\)
\(= \pu{0,0555 mol}\)
\( n(\ce{H2O}) = \dfrac{m(\ce{H2O})}{M(\ce{H2O})} \)
\(= \dfrac{\pu{90,0 g}}{\pu{18,02 g/mol}} \)
\(= \pu{4,99 mol} \)
\( = \dfrac{\pu{0,0555 mol}}{\pu{0,0555 mol} + \pu{4,99 mol}} \)
\( = \pu{0,0110}\)
\( \chi (\ce{H2O}) = \frac{n(\ce{H2O})}{n(\ce{C6H12O6}) + n(\ce{H2O})} \)
\( = \dfrac{\pu{4,99 mol}}{\pu{0,0555 mol + 4,99 mol}} \)
\( = \pu{0,989}\)
\( p = \chi (\ce{H2O})\cdot p(\ce{H2O}) \)
\( p = \pu{0,989 \cdot 3,169 kPa}\)
\( p = \pu{3,134 kPa} \)
Do rezultata možete doći na dva načina:
a) oduzimanjem tlaka para otopine od tlaka para vode
\( \Delta p = \pu{3,169 kPa – 3,134 kPa} \)
\( \Delta p = \pu{0,035 kPa} \)
b) množenjem množinskog udjela otopljene tvari s tlakom para vode;
\( \Delta p = \pu{3,169 kPa – 3,134 kPa} \)
\( \Delta p = \pu{0,035 kPa} \)
\Delta p = \pu{0,011 \cdot 3,169 kPa} \\
\Delta p = \pu{0,035 kPa} \)
Odgovor:
Tlak para iznad 10,0 %-tne vodene otopine fruktoze je 3,134 kPa, prema tome tlak para otopine u odnosu na vodu kao otapalo pri 25 °C niži je za 0,035 kPa.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Tlak vodene pare čiste vode (po) pri 20 °C (t) iznosi 2,3388 kPa.
Izračunajte za koliko se snizi tlak pri istoj temperaturi iznad otopine koja sadrži 45,0 g (m)
uree, CO(NH2)2 otopljene u 550 g (m) vode (H2O).
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliko iznosi tlak para (p) iznad 10,00%-tne (w) vodene otopine glicerola pri 25 °C (t).
Molekulska formula glicerola je C3H8O3.
Tlak vodene pare (p) pri 25 °C iznosi 3,169 kPa.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Tlak vodene pare čiste vode pri 20 °C iznosi 2,3388 kPa. Izračunajte za koliko se snizi tlak pri istoj temperaturi iznad otopine koja sadrži 45,0 g uree, \( \ce{CO(NH2)2} \), otopljene u 550 g vode.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliko iznosi tlak para iznad 10,00%-tne vodene otopine glicerola
pri 25 °C .
Molekulska formula glicerola je \( \ce{C3H8O3} \). Tlak vodene pare pri 25 ° C iznosi 3,169 kPa.
Želite li pokušati ponovo?
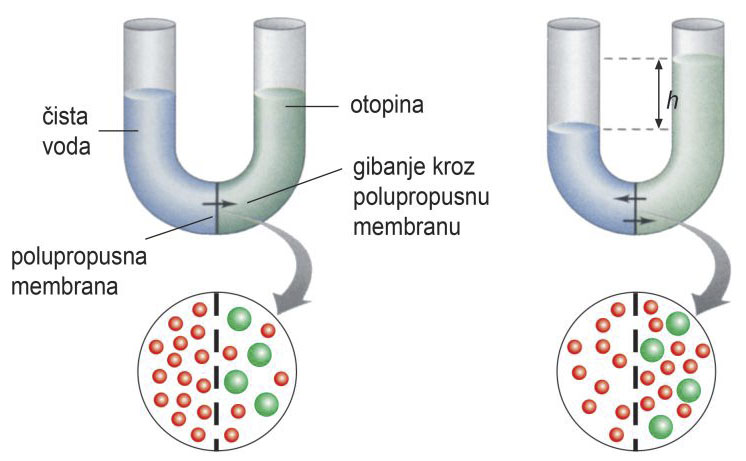
Osmotski tlak
Načinite jednostavan pokus kod kuće.
Na temelju pokusa ćete iznijeti zaključke o osmozi i osmotskom tlaku.
Životinjski mjehur (ili umjetna polupropusna membrana) napuni se otopinom saharoze (šećera) množinske koncentracije (c) 1 mol/L.
Otopina saharoze se prethodno oboji prehrambenom bojom i pričvrsti na staklenu cijev.
Mjehur se uroni u čašu s otopinom saharoze množinske koncentracije (c) 0,5 mol/L.
Staklena cijev se pričvrsti za stalak.
Tako složena aparatura ostavi se neko vrijeme.
Što primjećujete?
Osmotski tlak
Načinite jednostavan pokus kod kuće na temelju kojega ćete izvesti zaključke o
Životinjski mjehur (ili umjetna polupropusna membrana) napuni se otopinom saharoze množinske koncentracije 1 mol/L, koja se prethodno oboji prehrambenom bojom i pričvrsti na staklenu cijev. Mjehur se uroni u čašu s otopinom saharoze množinske koncentracije 0,5 mol/L, a staklena se cijev pričvrsti za stalak. Tako složena aparatura ostavi se neko vrijeme. Što primjećujete?
U uskoj cjevčici porasao je nivo tekućine.
Molekule vode (H2O) prolaze kroz polupropusnu membranu iz otopine saharoze manje (<) množinske koncentracije (c) u otopinu saharoze veće (>) množinske koncentracije (c).
Molekule prolaze do izjednačenja (=) koncentracija otopina s obje strane membrane.
Zbog toga se nivo tekućine u uskoj cjevčici povisio.
Navedena pojava naziva se osmoza.
U uskoj cjevčici podigao se nivo tekućine. Molekule vode prolaze kroz polupropusnu membranu iz otopine saharoze manje množinske koncentracije u otopinu saharoze veće množinske koncentracije do izjednačenja koncentracija otopina s obje strane membrane.
Zbog toga se nivo tekućine u uskoj cjevčici povisio. Navedena pojava naziva se osmoza.
Osmoza je difuzija otapala kroz polupropusnu membranu iz otopine manje (<) koncentracije u otopinu veće (>) koncentracije.
Tlak koji je potreban da se uspostavi ravnoteža između dviju otopina različitih koncentracija odvojenih polupropusnom membranom naziva se osmotskim tlakom.
Osmozom molekule otapala prolaze kroz polupropusnu membranu sve dok se hidrostatski i osmotski tlak ne izjednače (=).
Osmoza je difuzija otapala kroz polupropusnu membranu iz otopine manje koncentracije u otopinu veće koncentracije. Tlak koji je potreban da se uspostavi ravnoteža između dviju otopina različitih koncentracija odvojenih polupropusnom membranom naziva se osmotskim tlakom.
Osmozom molekule otapala prolaze kroz polupropusnu membranu sve dok se hidrostatski i osmotski tlak ne izjednače.
ρ ⋅ g ⋅ h = i ⋅ c ⋅ T
Hidrostatski tlak definiran je izrazom:
p = ρ ⋅ g ⋅ h
gdje je:
p – hidrostatski tlak
ρ – gustoća vodene otopine
g – gravitacijsko ubrzanje (9,81 m s–2)
h – visina stupca
Izraz za izračunavanje osmotskog tlaka, \( \mathit{\Pi} \), izveo je J. H. van’t Hoff.
Π = i ⋅ c ⋅ R ⋅ T
Π = osmotski tlak
Mjerna jedinica osmotskog tlaka u SI sustavu je Pascal, Pa.
i = broj čestica nastalih otapanjem jedne molekule ili formulske jedinke spoja (za neelektrolitne otopine vrijedi i = 1)
c = množinska koncentracija otopine
R = opća plinska konstanta
T = termodinamička temperatura
Primjerice, otapanjem sljedećih tvari u vodi proizlazi da je:
\(\rho \cdot g\cdot h = i \cdot c \cdot T\)
Hidrostatski tlak definiran je izrazom:
\(p = \rho \cdot g\cdot h \)
gdje je:
p – hidrostatski tlak
ρ – gustoća vodene otopine
g – gravitacijsko ubrzanje (9,81 m s-2)
h – visina stupca
Više informacija o hidrostatskom tlaku možete pronaći u jedinici 5.1 Hidrostatski tlak u DOS-u Fizika 1.
Izraz za izračunavanje osmotskog tlaka, Π, izveo je J. H. van’t Hoff.
\( \mathit{\Pi} = i\cdot c\cdot R\cdot T \)
Π = osmotski tlak, mjerna jedinica u SI sustavu je Pascal, Pa.
i = broj čestica nastalih otapanjem jedne molekule ili formulske jedinke spoja (za neelektrolitne otopine vrijedi i = 1)
c = množinska koncentracija otopine
R = opća plinska konstanta
T = termodinamička temperatura
Primjerice, otapanjem sljedećih tvari u vodi proizlazi da je:
\(\begin{align}
&\ce{C6H12O6(s) ->[H2O] C6H12O6(aq)}\quad i = 1 \\
&\ce{KCl(s) ->[H2O] K+(aq) + Cl–(aq)}\quad i = 2 \\
&\ce{Ca(NO3)2(s) ->[H2O] Ca^{2+}(aq) + 2NO3–(aq)}\quad i = 3
\end{align}
\)
Riješeni primjer 2.
Izračunajte osmotski tlak (Π) otopine kalcijeva nitrata, Ca(NO3)2, množinske koncentracije (c) 0,0500 mol dm–3 pri 25 °C (t).
Zadano je:
c (Ca(NO3)2 ) = 0,0500 mol dm–3
t = 25 °C
Traži se:
Π = ?
Izradak:
Π = i ⋅ c ⋅ R ⋅ T
Ca(NO3)2 (s) → Ca2+ (aq) + 2NO3– (aq)
Kalcijev nitrat, Ca(NO3)2 je sol potpuno disocirana u vodi.
Budući da jedna formulska jedinka disocira na tri iona, i = 3.
T = 25 °C + 273 = 298 K
Π = 3 ⋅ 0,0500 mol dm–3 ⋅ 8,314 × 103 Pa dm3 mol-1 K-1 ⋅ 298 K
Π= 371,6 × 103 Pa
Π = 371,6 kPa
Odgovor:
Osmotski tlak (Π )otopine kalcijeva nitrata, Ca(NO3)2, množinske koncentracije 0,0500 mol dm–3 (c) pri 25 °C (t) iznosi 371,6 kPa.
Riješeni primjer 2
Izračunajte osmotski tlak otopine kalcijeva nitrata, \( \ce{Ca(NO3)2}\) , množinske koncentracije 0,0500 mol/dm3 pri 25 °C.
Zadano je:
\( c(\ce{Ca(NO3)2) = \pu{0,0500 mol/dm3}}\\
t = \pu{25 ^\circ C}\)
Traži se:
Π= ?
Izradak:
\( \mathit{\Pi} = i c R T \)
\( \ce{Ca(NO3)2(s) ->[H2O] Ca^{2+}(aq) + 2NO3–(aq)} \)
Kalcijev nitrat je sol potpuno disocirana u vodi. Budući da jedna formulska jedinka disocira na tri iona,
\( i = 3 \).
\( \begin{align}
& T = \pu{25 ^\circ C + 273 K = 298 K} \\
&\mathit{\Pi} = \pu{3 } \:\cdot \: \pu{0,0500 \: mol/dm3} \: \cdot \: \pu{8,314 \times 10^3 Pa dm3/mol K} \: \cdot \: \pu{298 K} \\
&\mathit{\Pi} = \pu{371,6 \times 10^3 Pa} \\
&\mathit{\Pi} = \pu{371,6 kPa}
\end{align} \)
Odgovor:
Osmotski tlak otopine kalcijeva nitrata, \( \ce{Ca(NO3)2} \), množinske koncentracije 0,0500 mol dm-3 pri 25 °C iznosi 371,6 kPa.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Osmotski tlak (Π) neke neelektrolitne otopine množinske koncentracije (c) 0,0150 mol/L pri 25 °C (t) iznosi:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Osmotski tlak (Π) neelektrolitne izmjeren u osmometru iznosi 1,80 × 104 Pa.
Gustoća (ρ) otopine je 1,00 g/cm3.
Visina stupca (h) na koju će se dignuti otopina iznosi:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Osmotski tlak (Π) vodene otopine natrijeva klorida (NaCl) množinske koncentracije (c) 5,00 mmol/L pri 25 °C (t) iznosi:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Osmotski tlak neke neelektrolitne otopine množinske koncentracije 0,0150 mol/L pri 25 °C iznosi:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Osmotski tlak neelektrolitne otopine izmjeren u osmometru iznosi \(\pu{1,80 × 10^4 Pa} \). Gustoća otopine je 1,00 g/cm3. Visina stupca, h, na koju će se dignuti otopina iznosi:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Osmotski tlak vodene otopine natrijeva klorida množinske koncentracije 5,00 mmol/L pri 25 °C iznosi:
Želite li pokušati ponovo?
Vrelište i ledište otopina
Sniženje tlaka para iznad otopine neke nehlapljive otopljene tvari utječe na vrelište i ledište otopina.
Otopina ima niže (<) ledište u odnosu na čisto otapalo.
Otopina ima više (>) vrelište u odnosu na čisto otapalo.
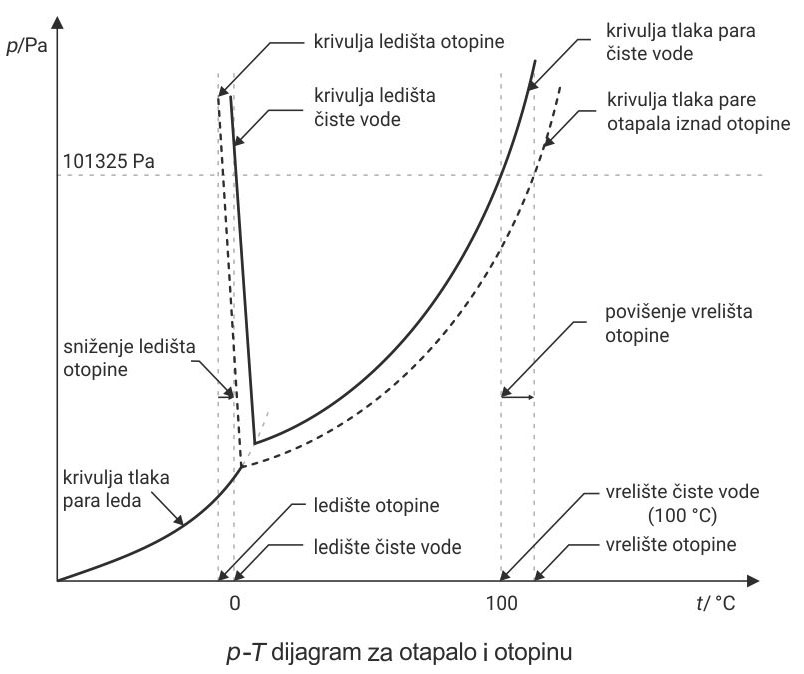
Proučite p–T dijagram za otapalo i otopinu.
Vrelište i ledište otopina
Sniženje tlaka para iznad otopine neke nehlapljive otopljene tvari utječe na vrelište i ledište otopina. Otopina ima niže ledište, a više vrelište u odnosu na čisto otapalo.
Proučite p–T dijagram za otapalo i otopinu.
Puna krivulja prikazuje tlak para čistog otapala.
Crtkana krivulja prikazuje tlak para otopine nehlapljive tvari.
Povišenje vrelišta i sniženje ledišta, važna su koligativna svojstva otopina.
Puna krivulja prikazuje tlak para čistog otapala, a crtkana tlak para otopine nehlapljive tvari. Povišenje vrelišta i sniženje ledišta, važna su koligativna svojstva otopina.
Riješeni primjer 3.
Slika prikazuje otapanje 10,0 g saharoze (C12H22O11) i 10,0 g natrijevog klorida (NaCl) u vodi.
U kojoj otopini očekujete veći (>) broj čestica nehlapljive tvari?
Pretpostavku provjerite računom.
Zadano je:
m(C12H22O11) = 10,0 g
m(NaCl) = 10,0 g
Traži se:
N(C12H22O11) = ?
N(Na+) = ?
N(Cl–) = ?
Izradak:
Budući da je molarna masa (M) saharoze (C12H22O11) veća (>) od molarne mase (M) natrijevog klorida (NaCl), manji (<) je broj molekula saharoze (\(\ce{C12H22O11}\)) od broja formulskih jedinki natrijevog klorida (\(\ce{NaCl}\)).
\( \begin{align}
N(\ce{C12H22O11}) &= \dfrac{m(\ce{C12H22O11})}{M(\ce{C12H22O11})}\cdot N_{\textrm{A}} \\
&= \dfrac{\pu{10,0 g}}{\pu{342,30 g mol-1}}\cdot \pu{6,022 \times 10^{23} mol-1} \\
&= \pu{1,76 \times 10^{22}} \end{align} \)
\( \begin{align}
N(\ce{NaCl}) &= \dfrac{m(\ce{NaCl})}{M(\ce{NaCl})}\cdot N_{\textrm{A}}
&= \dfrac{\pu{10,0 g}}{\pu{58,44 g mol-1}} \cdot \pu{6,022 \times 10^{23} mol-1}\\
&= \pu{1,03 \times 10^{23}}
\end{align} \)
Otapanjem u vodi broj molekula saharoze (\(\ce{C12H22O11}\)) ostaje nepromijenjen.
\( \ce{C12H22O11(s) ->[H2O] \ce{C12H22O11(aq)}} \)
\( N(\ce{C12H22O11(aq)) = \pu{1,76}\times 10^{22}} \)
Disocijacijom natrijevog klorida (NaCl) u vodi broj iona dvostruko je veći (>) od broja formulskih jedinki.
\( \ce{NaCl(s) ->[H2O] Na+(aq) + Cl-(aq)} \)
\( N(\ce{Na+}) + N(\ce{Cl-}) = 2N(\ce{NaCl}) = 2\cdot \pu{1,03 \times 10^{23} = 2,06 \times 10^{23}} \)
Budući da vrelište i ledište otopine ovise o broju čestica, važno je znati da je saharoza (\(\ce{C12H22O11}\)) molekulski kristal koji u vodi ne disocira.
Natrijev klorid (\(\ce{NaCl}\)) je ionski kristal koji disocira u vodenoj otopini.
Na taj način povećava broj čestica u otopini.
Riješeni primjer 3
Slika prikazuje otapanje 10,0 g saharoze i 10,0 g natrijeva klorida u vodi. U kojoj otopini očekujete veći broj čestica nehlapljive tvari? Pretpostavku provjerite računom.
Zadano je:
m(C12H22O11) = 10,0 g
m(NaCl) = 10,0 g
Traži se:
N(C12H22O11) = ?
N(Na+) = ?
N(Cl–) = ?
Izradak:
Budući da su mase saharoze i natrijeva klorida jednake, zbog veće molarne mase množina saharoze je manja od množine natrijeva klorida. Prema tome, može se pretpostaviti, da je broj molekula saharoze manji od broja formulskih jedinki natrijeva klorida.
\( \begin{align}
N(\ce{C12H22O11}) &= \dfrac{m(\ce{C12H22O11})}{M(\ce{C12H22O11})}\cdot N_{\textrm{A}} \\
&= \dfrac{\pu{10,0 g}}{\pu{342,30 g mol-1}}\cdot \pu{6,022 \times 10^{23} mol-1} \\
&= \pu{1,76 \times 10^{22}} \end{align} \)
\( \begin{align}
N(\ce{NaCl}) &= \dfrac{m(\ce{NaCl})}{M(\ce{NaCl})}\cdot N_{\textrm{A}}
&= \dfrac{\pu{10,0 g}}{\pu{58,44 g mol-1}} \cdot \pu{6,022 \times 10^{23} mol-1}\\
&= \pu{1,03 \times 10^{23}}
\end{align} \)
Otapanjem u vodi broj molekula saharoze ostaje nepromijenjen.
\( \ce{C12H22O11(s) ->[H2O] \ce{C12H22O11(aq)}} \)
\( N(\ce{C12H22O11(aq)) = \pu{1,76}\times 10^{22}} \)
Disocijacijom natrijeva klorida u vodi broj iona dvostruko je veći od broja formulskih jedinki.
\( N(\ce{Na+}) + N(\ce{Cl-}) = 2N(\ce{NaCl}) = 2\cdot \pu{1,03 \times 10^{23} = 2,06 \times 10^{23}} \)
Odgovor: Saharoza je molekulski kristal koji u vodi ne disocira, za razliku od natrijeva klorida, koji je ionski kristal te disocira u vodenoj otopini i na taj način također povećava broj čestica u otopini.
Općenito za razrijeđene otopine se može izračunati povišenje vrelišta otopine:
ΔT = i ⋅ Kb ⋅ b
ΔT – povišenje vrelišta otopine
i – broj iona nastalih otapanjem jedinke tvari
Kb – ebulioskopska konstanta otapala
b – molalnost
Kb je oznaka za ebulioskopsku konstantu otapala ili molalnu konstantu povišenja vrelišta.
Ebulioskopska konstanta za vodu iznosi 0,52 K kg mol-1 .
To znači da se otapanjem 1 mola bilo koje tvari, koja ne disocira, u 1 kg vode, vrelište otopine povisi za 0,52 K (ili 0,52 °C) u odnosu na vrelište vode.
Za koliko se snizi ledište otopine, može se izračunati prema formuli:
ΔT = i ⋅ Kf ⋅ b
Kf je oznaka za krioskopsku konstantu otapala ili molalnu konstantu sniženja ledišta.
Krioskopska konstanta za vodu iznosi 1,86 K kg mol-1.
Ako se 1 mol tvari koja ne disocira otopi u 1 kg vode, ledište vode se snizi za 1,86 K (1, 86 C°).
Zimi se u gradovima troše velike količine soli (smjese različitih vrsta soli) da se spriječi zaleđivanje cesta i da se ljudima omogući sigurnije kretanje po njihovom gradu.
Istražite može li ta sol imati i negativan utjecaj na okoliš?
Sol šteti biljkama, ona nagriza fasade zgrada, šteti automobilima.
Sva ta sol završi u tlu, a možda i u podzemnim vodama.
U nekim njemačkim gradovima su zabranili koristiti sol u te svrhe na ulicama i svim površinama kojima se kreću pješaci.
Umjesto soli predložili su pijesak ili piljevinu.
Piljevina je posebno dobra jer se može prikupiti i kompostirati nakon što se led i snijeg rastale.
Općenito za razrijeđene otopine se može izračunati povišenje vrelišta otopine:
\( \Delta T = i\cdot K_{\textrm{b}}\cdot b \)
ΔT – povišenje vrelišta otopine
i – broj iona nastalih otapanjem jedinke tvari
Kb – ebulioskopska konstanta otapala
b – molalnost
Kb je oznaka za ebulioskopsku konstantu otapala ili molalnu konstantu povišenja vrelišta. Ebulioskopska konstanta za vodu iznosi 0,52 K kg mol-1. To znači da se otapanjem 1 mola bilo koje tvari, koja ne disocira, u 1 kg vode, vrelište otopine povisi za 0,52 K (0,52 °C) u odnosu na vrelište vode.
Za koliko se snizi ledište otopine, može se izračunati prema formuli:
\( \Delta T = i\cdot K_{\textrm{f}}\cdot b \)
Kf je oznaka za krioskopsku konstantu otapala ili molalnu konstantu sniženja ledišta. Krioskopska konstanta za vodu iznosi 1,86 K kg mol-1. Ako se 1 mol tvari koja ne disocira otopi u 1 kg vode, ledište vode se snizi za 1,86 K (1,86 °C).
Zimi se u gradovima troše velike količine soli (smjese različitih vrsta soli) da se spriječi zaleđivanje cesta i da se ljudima omogući sigurnije kretanje po njihovom gradu. No, istražite može li ta sol imati i negativan utjecaj na okoliš?
Sol šteti biljkama, ona nagriza fasade zgrada, šteti automobilima, konačno sva ta sol završi u tlu, a možda i u podzemnim vodama. U nekim njemačkim gradovima su zabranili koristiti sol u te svrhe na ulicama i svim površinama kojima se kreću pješaci. Umjesto soli predložili su pijesak ili piljevinu. Piljevina je posebno dobra zbog toga što se nakon što se led i snijeg rastale može prikupiti i kompostirati.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Vrelište koje od otopina množinskih koncentracija (c) 0,4 mol dm–3 je jednako (=) vrelištu vodene otopine natrijeva klorida (NaCl) množinske koncentracije (c) 0,6 mol dm–3 ?
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Vrelište koje od otopina množinskih koncentracija 0,4 mol/dm3 je jednako vrelištu vodene otopine natrijeva klorida množinske koncentracije 0,6 mol/dm3 ?
Želite li pokušati ponovo?
Na kraju
Riješite zadatak.
Ponovite nastavne sadržaje obrađene u ovoj jedinici DOS-a.
Na kraju…
Riješite zadatak i ponovite nastavne sadržaje obrađene u ovoj jedinici DOS-a.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U čaši se nalazi usitnjeni led čija je temperatura –4 °C.
Dodavanjem šećera sobne temperature nastaje smjesa čija će temperatura nakon 10-tak minuta biti:
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Sva mora i oceani svijeta međusobno su povezani i čine jedinstvenu prirodnu cjelinu – Svjetsko more.
Njihov ukupan volumen (V) iznosi oko 1 350 000 000 km3.
Kada bi se teoretski moglo otopiti 1,00 kg saharoze (C12H22O11) u volumenu (V) Svjetskog mora broj molekula saharoze u 1,00 L morske vode iznosio bi:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Osmotski tlak (Π) 150 mL otopine u kojoj je otopljeno 6,00 g (m) proteina pri 25 °C (t) iznosi 1800 Pa.
Molarna masa (M) nepoznatog proteina je:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U čaši se nalazi usitnjeni led čija je temperatura -4 °C. Dodavanjem šećera sobne temperature nastaje smjesa čija će temperatura nakon 10-tak minuta biti:
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Sva mora i oceani svijeta međusobno su povezani i čine jedinstvenu prirodnu cjelinu – Svjetsko more.
Njihov ukupan volumen iznosi oko 1 350 000 000 km3.
Kada bi se teoretski moglo otopiti 1,00 kg saharoze u volumenu Svjetskog mora broj molekula saharoze u 1,00 L morske vode iznosio bi:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Osmotski tlak 150 mL otopine u kojoj je otopljeno 6,00 g proteina pri 25 °C iznosi 1800 Pa. Molarna masa nepoznatog proteina je:
Želite li pokušati ponovo?