Iskazivanje sastava otopina
- izračunati maseni udio tvari
- pripremiti otopine različitih masenih i množinskih koncentracija
- iskazati i izračunati molalnost otopine
Uvod
Jeste li znali da se kuhinjska sol ne koristi samo kao začin već da se sterilna vodena otopina može koristiti za liječenje?
Fiziološka otopina je 0,9 %-tna sterilna otopina soli u vodi.
Široku primjenu ima u kućnoj medicini jer je njezina koncentracija slična koncentraciji koja se prirodno nalazi u našim tjelesnim tekućinama (suzama, krvi…).
Fiziološka otopina se zbog toga naziva i izotoničnom otopinom.
Koristi se:
Uvod
Jeste li znali da se vodena otopina natrijeva klorida može koristiti i za liječenje?
Fiziološka otopina je 0,9 %-tna sterilna otopina natrijeva klorida i vode. Široku primjenu ima u kućnoj medicini jer je njezina koncentracija slična onoj koja se prirodno nalazi u našim tjelesnim tekućinama (suzama, krvi…). Zbog toga se naziva i izotoničnom otopinom. Koristi se:
Svakodnevno se koriste otopine određenog kvantitativnoga sastava.
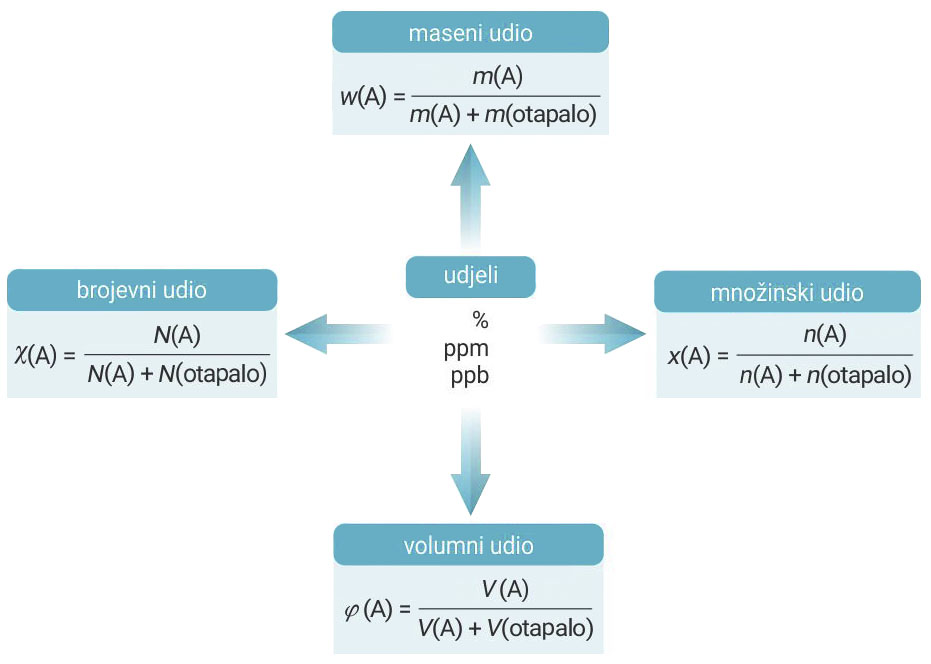
Kvantitativni sastav otopina može se izraziti pomoću:
1. udjela (maseni, volumni, množinski)
2. koncentracija (masena, množinska)
3. molalnosti
Udjeli:
Masene udjele najčešće iskazujemo brojem od 0 do 1 ili
postotkom (% = 1/100).
Udjeli manjih < vrijednosti iskazuju se:
1. promilima, ‰, (‰ = 1/1 000),
2. dijelovima na milijun, ppm, (ppm = 1/1 000 000 – parts per milion)
3. dijelovima na milijardu, ppb, (ppb = 1/1 000 000 000 , parts per bilion).
Maseni udio otopljene tvari u otopini
Maseni udio tvari X u otopini, w (X), određen je omjerom mase otopljene tvari, m (X) i mase otopine, m (otopina).
Svakodnevno se koriste otopine određenog kvantitativnoga sastava. Kvantitativni sastav otopina može se izraziti pomoću:
- udjela (maseni, volumni, množinski)
- koncentracija (masena, množinska)
- molalnosti
Udjeli
Masene udjele najčešće iskazujemo brojem od 0 do 1 ili
postotkom, (% = 1/100). Udjeli manjih vrijednosti iskazuju se promilima, dijelovima na tisuću, (‰ = 1/1 000), dijelovima na milijun, ppm,
(ppm = 1/1 000 000 – parts per milion) i dijelovima na bilijun, ppb,
(ppb = 1/1 000 000 000, parts per bilion).
Maseni udio otopljene tvari u otopini
Maseni udio tvari, X, u otopini, w(X), određen je omjerom mase otopljene tvari, m(X), i mase otopine.
Unesite odgovore na pripadajuća mjesta.
1) m(NaCl) = 4,0 g
2) m(C12H22O11) = 13,4 g
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
1)
2)
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
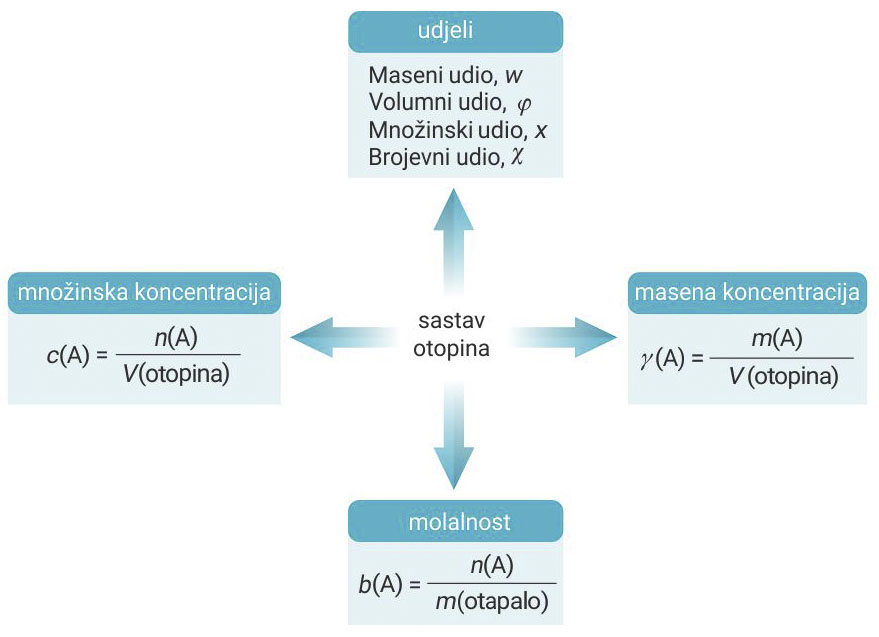
Koncentracije
Masena koncentracija
Masena koncentracija označava se grčkim slovom gama, γ (X).
Iskazuje se omjerom mase otopljene tvari, m (X) i volumena otopine, V (otopina).
γ (X) = m (X) / V (otopina)
SI-jedinica za masenu koncentraciju jest kg m-3 (čitamo: kilogram po kubnom metru).
Češće se upotrebljava g dm-3 (čitamo: gram po kubnom decimetru) ili
g L-1 (čitamo: gram po litri) .
Množinska koncentracija
Množinska koncentracija, c (X) iskazuje se omjerom množine otopljene tvari, n (X) i volumena otopine, V (otopine).
c (X) = n (X) / V (otopine)
SI-jedinica za množinsku koncentraciju jest mol m-3 (čitamo: mol po kubnom metru).
Češće je u uporabi mol dm-3 (čitamo: mol po kubnom decimetru) ili
mol L-1 (čitamo: mol po litri).
Priprema otopine određene masene i množinske koncentracije
Za pripremu otopine potrebna nam je laboratorijska vaga za mjerenje mase uzoraka.
Točnost mjerenja mase uzorka ovisi o osjetljivosti vage.
Za vaganje u laboratoriju koriste se:
1. laboratorijske tehničke vage (preciznost do 0,01 g),
2. analitičke vage za veću > točnost vaganja.
Danas se sve češće koriste digitalne vage.
Za mjerenje volumena tekućina, kad nije potrebna velika točnost, upotrebljava se menzura.
Ponovite kako treba, s obzirom na meniskus, očitati volumen otopine u menzuri.
Koncentracije
Masena koncentracija
Masena koncentracija, označava se grčkim slovom gama, γ(X), iskazuje se omjerom mase otopljene tvari, m(X), i volumena otopine.
SI-jedinica za masenu koncentraciju jest kg m-3, ali češće je u uporabi g dm-3 ili g L-1.
Množinska koncentracija
Množinska koncentracija, c(X), iskazuje se omjerom množine otopljene tvari, n(X) i volumena otopine.
SI-jedinica za množinsku koncentraciju jest mol m-3, ali češće je u uporabi mol dm-3 ili mol L-1.
Priprema otopine određene masene i množinske koncentracije
Za pripremu otopine potrebna nam je laboratorijska vaga za mjerenje mase uzoraka. Točnost mjerenja mase uzorka ovisi o osjetljivosti vage. Za vaganje u laboratoriju koriste se laboratorijske tehničke vage (preciznost do 0,01 g), i analitičke vage za veću točnost vaganja. Danas se sve češće koriste digitalne vage.
Za mjerenje volumena tekućina kad nije potrebna velika točnost upotrebljava se menzura.
Ponovite kako ispravno treba, s obzirom na meniskus, očitati volumen otopine u menzuri.
Otopine zadanih koncentracija često se priprema u odgovarajućoj odmjernoj tikvici.
Odmjerne tikvice su staklene boce, kruškastog oblika s dugim, uskim vratom i ravnim dnom.
Imaju ubrušeni stakleni čep.
Tikvica je ispravno napunjena kad se donji rub meniskusa podudara s crtom na vratu tikvice.
Na svakoj je tikvici, uz volumen, označena i temperatura na kojoj je tikvica baždarena.
Oznaka temperature ima prefiks In (lat. u).
To znači da je tikvica baždarena na uljev.
Pripremanje vodene otopine bakrova(II) sulfata množinske koncentracije 1,00 mol/L
Otopine zadanih koncentracija često se priprema u odgovarajućoj odmjernoj tikvici. Odmjerne tikvice su staklene boce, kruškastog oblika s dugim uskim vratom i ravnim dnom koje imaju ubrušeni stakleni čep. Tikvica je ispravno napunjena kad se donji rub meniskusa podudara s crtom na vratu tikvice. Na svakoj je tikvici, uz volumen, označena i temperatura na kojoj je tikvica baždarena. Oznaka temperature ima prefiks In (lat. u) što znači da je tikvica baždarena na uljev.
Pripremanje vodene otopine bakrova(II) sulfata množinske koncentracije 1,00 mol/L
- U čaši vagnemo 249,69 g bakrova (II) sulfata pentahidrata (CuSO4 • 5 H2O).
- To je masa 1,00 mola bakrova (II) sulfata pentahidrata (CuSO4 • 5 H2O).
- Kroz lijevak kvantitativno se prenese 1,00 mol tvari u odmjernu tikvicu od 1L.
- Lijevak se ispere destiliranom vodom.
- Tikvica napuni vodom do 70 % svoga volumena uz povremeno potresanje sadržaja tikvice.
- Nakon što se bakrov(II) sulfat pentahidrat (CuSO4 • 5 H2O) potpuno otopio, dolije se destilirana voda da volumen otopine bude nešto ispod oznake.
- Tikvica se zatim začepi ubrušenim čepom.
- Otopina se promiješa okretanjem tikvice.
- Kapaljkom se doda destilirane vode do oznake.
- Nakon što se promiješa provjeri još jednom položaj meniskusa.
- Dobivena je vodena otopina bakrova(II) sulfata množinske koncentracije (c) 1,00 mol/L.
- U čaši vagnemo 249,69 g bakrova(II) sulfata pentahidrata. To je masa 1,00 mola navedene tvari koja se kroz lijevak kvantitativno prenese u odmjernu tikvicu od 1 L.
- Lijevak se ispere destiliranom vodom, a tikvica napuni vodom otprilike do 70 % svoga volumena uz povremeno potresanje sadržaja tikvice.
- Nakon što se bakrov(II) sulfat pentahidrat potpuno otopio dolije se destilirana voda da volumen otopine bude nešto ispod oznake.
- Tikvica se zatim začepi ubrušenim čepom i otopina se promiješa okretanjem tikvice.
- Kapaljkom se doda destilirane vode do oznake i nakon što se promiješa provjeri još jednom položaj meniskusa.
- Dobivena je vodena otopina bakrova(II) sulfata množinske koncentracije 1,00 mol/L.
Riješeni primjer 1.
Izračunajte masenu koncentraciju (γ) 20,0 % -tne otopine octene kiseline gustoće (ρ) 1,025 g cm-3.
Izradak:
Masa (m) octene kiseline (CH3COOH) se može iskazati iz masenog udjela (w), a volumen (V) otopine pomoću gustoće (ρ) otopine.
Nakon što se mase otopine pokrate, može se izračunati masena koncentracija (γ) octene kiseline (CH3COOH) kao produkt masenog udijela (w) kiseline i gustoće (ρ) otopine:
Odgovor:
Masena koncentracija (γ) otopine octene kiseline (CH3COOH) iznosi 205 g dm–3.
Riješeni primjer 1
Izračunajte masenu koncentraciju 20,0% -tne otopine octene kiseline gustoće .
Zadano je:
Traži se:
Izradak:
Masa octene kiseline se može iskazati pomoću masenog udjela, a volumen otopine iz izraza za gustoću otopine. Masena koncentracija octene kiseline produkt je masenog udjela kiseline i gustoće otopine:
Odgovor:
Masena koncentracija otopine octene kiseline iznosi 205 g dm-3.
Riješeni primjer 2.
Izračunajte množinsku koncentraciju (c) 70,0 % -tnog etanola gustoće (ρ) 0,8676 g cm-3.
Zadano je:
Traži se:
Izradak:
Ako se množina (n) etanola (C2H5OH) iskaže kao omjer mase (m) i molarne mase (M), a volumen (V) otopine kao omjer mase (m) i gustoće (ρ) otopine, onda je množinska koncentracija (c) otopine jednaka (=) produktu gustoće (ρ) otopine i omjera masenog udjela (w) otopine i molarne mase (M) etanola (C2H5OH).
Odgovor:
Množinska koncentracija (c) otopine octene kiseline (CH3COOH) iznosi 13,2 mol dm–3.
Riješeni primjer 2
Izračunajte množinsku koncentraciju 70,0 % -tnog etanola gustoće 0,8676 g cm-3.
Zadano je:
Traži se:
Izradak:
Ako se množina etanola iskaže kao omjer mase i molarne mase, a volumen otopine kao omjer mase i gustoće otopine, onda je množinska koncentracija otopine jednaka produktu gustoće otopine i omjera masenog udjela otopine i molarne mase etanola.
Odgovor:
Množinska koncentracija otopine octene kiseline iznosi 13,2 mol dm–3.
Molalnost
Molalnost, b (X) iskazuje se omjerom množine otopljene tvari, n (X) i mase otapala, m (otapala).
SI-jedinica za molalnost jest mol kg-1
(čitamo: mol po kilogramu).
Molalnost
Molalnost, b(X), iskazuje se omjerom množine otopljene tvari, n(X), i mase otapala.
SI-jedinica za molalnost jest mol kg-1.
Riješeni primjer 3.
Izračunajte molalnost (b) otopine dobivene otapanjem 100 g kuhinjske soli
u 1,00 L vode ().
Zadano je:
Traži se:
Izradak:
Odgovor: Molalnost (b) otopine je 1,71 mol kg-1.
Riješeni primjer 3
Izračunajte molalnost otopine dobivene otapanjem 100 g kuhinjske soli
u 1,00 L vode ().
Zadano je:
Traži se:
Izradak:
Odgovor: Molalnost otopine je 1,71 mol kg-1
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Priprema otopina razrjeđivanjem otopina
Prilikom razrjeđivanja otopine i prilikom koncentriranja otopine dolazi do promjene volumena (V) i mase (m) otopine.
Mijenja se i koncentracija otopljene tvari.
Ne mijenja se masa (m), odnosno množina (n) otopljene tvari.
Razrjeđivanjem otopine smanjuje se koncentracija otopljene tvari.
Koncentriranjem otopine povećava se koncentracija otopljene tvari.
Množina otopljene tvari prije razrjeđivanja (n1) jednaka (=) je množini otopljene tvari nakon razrjeđivanja (n2).
n1 = n2
c1 V1 = c2 V2
γ1V1 = γ2 V2
w1 ρ1 V1= w2 ρ2 V1
Kod pripreme razrjeđenih otopina množinskih koncentracija (c) 0,1 mol/L ili manje (< ) možete uzeti da je gustoća (ρ) otopine jednaka (=) gustoći (ρ) vode (H2O) pri toj temperaturi.
Priprema otopina razrjeđivanjem otopina
Prilikom razrjeđivanja i koncentriranja otopine dolazi do promjene volumena i mase otopine, također se mijenja koncentracija otopljene tvari, ali se ne mijenja masa odnosno množina otopljene tvari.
Razrjeđivanjem otopine smanjuje se koncentracija otopljene tvari, a koncentriranjem otopine povećava se koncentracija otopljene tvari. Množina otopljene tvari prije razrjeđivanja (n1) jednaka je množini otopljene tvari nakon razrjeđivanja (n2).
Kod pripreme razrjeđenih otopina množinskih koncentracija, ili manje može se uzeti da je gustoća otopina jednaka gustoći vode pri toj temperaturi.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Na kraju…
Pronađite odgovarajuće parove i ponovite sadržaje obrađene u ovoj jedinici DOS-a.