Galvanski članci i elektrodni potencijal
- usporediti reaktivnost alkalijskih metala u reakciji s vodom
- opisati galvanski članak kao izvor električne energije
- predvidjeti kemijske reakcije koje će se dogoditi na elektrodama galvanskog članka
- izračunati napon galvanskog članka
Uvod
U galvanskom se članku energija kemijske reakcije pretvara u električnu energiju.
Reaktivnost metala
Reaktivnost metala ovisi o njihovoj sposobnosti oksidacije.
Što se atomi metala lakše oksidiraju, to je njegova reaktivnost veća (>).
Velika reaktivnosti alkalijskih metala, razlog je što ih u prirodi nema u elementarnom stanju.
Alkalijski metali, u prirodi, nalaze se samo u spojevima.
Uvod
U galvanskom se članku energija kemijske reakcije pretvara u električnu energiju.
Reaktivnost metala
Reaktivnost metala ovisi o njihovoj sposobnosti oksidacije. Što se atomi metala lakše oksidiraju, to je njihova reaktivnost veća.
Velika reaktivnosti alkalijskih metala, razlog je što ih u prirodi nema u elementarnom stanju, već se nalaze samo u spojevima.
Na slici su prikazani metali uronjeni u klorovodičnu kiselinu (HCl) iste (=) koncentracije.
Na slici su prikazani metali uronjeni u klorovodičnu kiselinu iste koncentracije.
Neki od metala ne reagiraju s klorovodičnom kiselinom (HCl).
Neki metali reagiraju manje (<) ili više (>) burno.
Metali koji reagiraju s klorovodičnom kiselinom (HCl) istiskuju vodik (H2).
Nastaje odgovarajuća sol prema općim jednadžbama:
Po intenzitetu mjehurića možete zaključiti koji od metala burnije reagiraju s klorovodičnom kiselinom (HCl).
Odnosno, možete zaključiti koji od metala su reaktivniji.
Neki od metala ne reagiraju s klorovodičnom kiselinom, a neki reagiraju manje ili više burno.
Metali koji reagiraju s klorovodičnom kiselinom istiskuju vodik i nastaje odgovarajuća sol prema općim jednadžbama:
Po intenzitetu mjehurića možete zaključiti koji od metala burnije reagiraju s klorovodičnom kiselinom, odnosno koji su reaktivniji.
Metali iz otopina soli izlučit će sve one metale koji su u nizu elemenata poredanih po reaktivnosti desno od njih.
Da bi reakcija bila moguća:
- reaktivniji metal mora biti u elementarnom stanju,
- manje reaktivan metal mora biti u ionskom obliku.
Metali čiji atomi lakše otpuštaju elektrone, imaju manju energiju ionizacije, jači su reducensi i njihova reakcija s klorovodičnom kiselinom je burnija.
Metali, osim s kiselinama mogu reagirati i s vodenim otopinama soli. Iz otopina soli metali će izlučit one metale, koji su u nizu elemenata poredanih po reaktivnosti, desno od njih. Da bi reakcija bila moguća, reaktivniji metal mora biti u elementarnom stanju, a manje reaktivan u ionskom obliku.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.

U vodenu otopinu bakrovih iona stavimo cinkovu pločicu.
U vodenu otopinu srebrovih iona stavimo bakrenu pločicu.
U vodenu otopinu željezovih (II) iona stavimo pločicu kositra.
U vodenu otopinu niklovih (II) iona stavimo bakrovu pločicu.
U kojim će čašama doći do reakcije?
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.

U vodenu otopinu bakrovih iona stavimo cinkovu pločicu, u vodenu otopinu srebrovih iona bakrenu pločicu, u vodenu otopinu željezovih(II) iona pločicu kositra, a bakrovu pločicu u vodenu otopinu niklovih(II) iona. U kojim će čašama doći do reakcije?
Želite li pokušati ponovo?
Galvanski članci i elektrodni potencijal
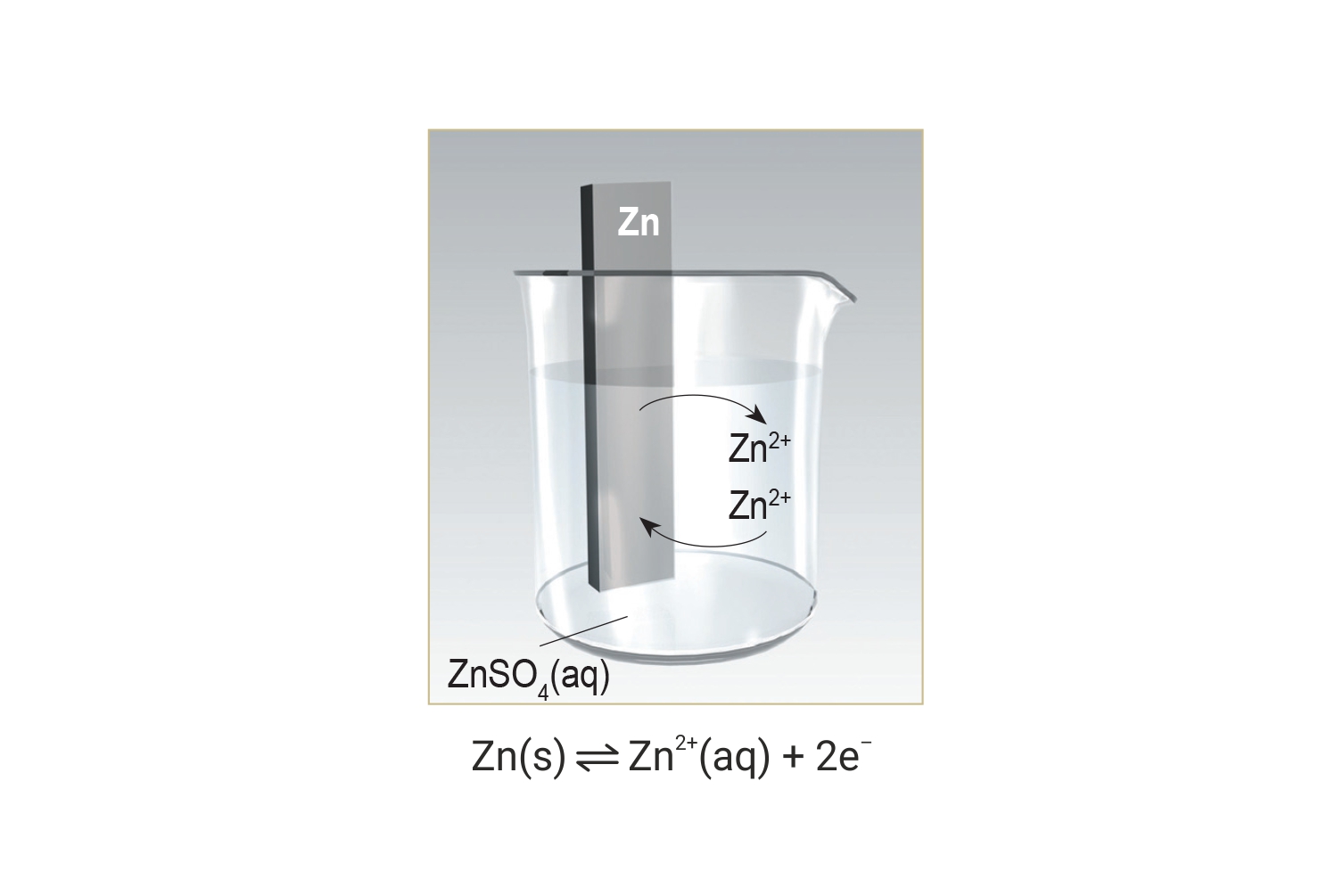
Kad se cinkova pločica stavi u vodenu otopinu cinkova sulfata ( ) uspostavlja se dinamička ravnoteža između cinkovih iona ( ) u otopini i atoma cinka ) na pločici.
Galvanski članci i elektrodni potencijal
Kad se cinkova pločica stavi u vodenu otopinu cinkova sulfata uspostavlja se dinamička ravnoteža između cinkovih iona u otopini i atoma cinka na pločici.
U stanju dinamičke ravnoteže, broj atoma cinka (Zn) koji se oksidiraju i odlaze u otopinu, jednak (=) je broju iona cinka (Zn2+) koji se reduciraju u atome i odlaze na pločicu.
Težnja metala da se oksidira mjera je za elektrodni potencijal.
Različiti metali imaju različitu težnju za oksidacijom.
Prema tome, imaju i različiti elektrodni potencijal.
Općenito, metal uronjen u otopinu vlastitih iona čini odgovarajući polučlanak.
U galvanskom članku kemijska se energija spontano pretvara u električnu energiju.
Galvanski članak se sastoji od dva različita polučlanka.
Oni su spojeni vodičem i elektrolitskim mostom .
Elektroda na kojoj se zbiva proces oksidacije zove se anoda.
Anoda je negativni (–) pol članka.
Elektroda na kojoj se zbiva proces redukcije zove se katoda.
Katoda je pozitivni (+) pol članka.
Elektrode moraju biti različitoga elektrodnoga potencijala.
Najpoznatiji galvanski članak napravljen je 1835. godine.
Naziva se Daniellov članak.
U stanju dinamičke ravnoteže broj atoma cinka koji se oksidiraju i odlaze u otopinu jednak je broju iona cinka koji se reduciraju u atome i odlaze na pločicu. Težnja metala da se oksidira mjera je za elektrodni potencijal.
Različiti metali imaju različitu težnju za oksidacijom prema tome i različiti
Općenito, metal uronjen u otopinu vlastitih iona čini odgovarajući polučlanak.
U galvanskom članku kemijska se energija spontano pretvara u električnu.
Galvanski članak se sastoji od dva različita
Elektroda na kojoj se zbiva proces oksidacije zove se anoda i negativni je pol članka.
Elektroda na kojoj se zbiva proces redukcije zove se katoda i pozitivni je pol članka.
Najpoznatiji

John Frederic Daniell (1790. – 1845.), bio je engleski kemičar, fizičar i meteorolog.
Izumio je higrometar i pirometar .
Pronašao je princip akumulatorske baterije što je po njemu nazvano Daniellov članak.

John Frederic Daniell (1790. – 1845. ), engleski kemičar, fizičar i meteorolog. Izumio je higrometar i pirometar, te galvanski članak (baterija) koji je po njemu nazvan Daniellov članak.
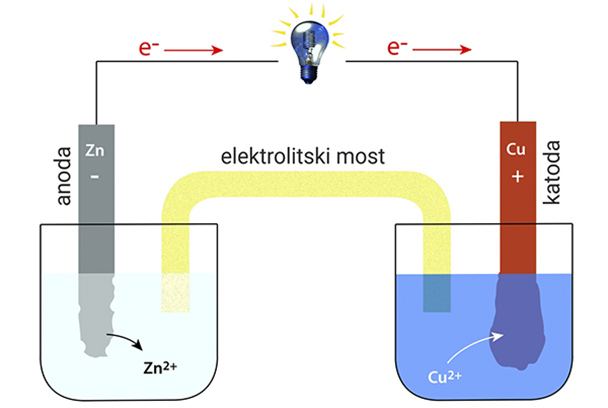
Daniellov članak
Daniellov članak napravljen je od cinkove i bakrene elektrode uronjene u otopine vlastitih iona.
Cinkova elektroda uronjena je u otopinu cinkova sulfata (ZnSO4).
Bakrova elektroda uronjena je u otopinu bakrova (II) sulfata (CuSO4).
Struja koju daje Daniellov članak posljedica je reakcija na elektrodama:
Daniellov članak
Daniellov članak napravljen je od cinkove i bakrene elektrode uronjene u vodene otopine vlastitih iona. Cinkova elektroda uronjena je u otopinu cinkova sulfata, a bakrova elektroda u otopinu bakrova(II) sulfata.
anoda (–): OKSIDACIJA
katoda (+): REDUKCIJA
Struja koju daje Daniellov članak posljedica je reakcija na elektrodama:
anoda (–):
katoda (+):
Shematski prikaz Daniellova članka
Crta | označava granicu elektroda / elektrolit.
Dvostruka crta || označava elektrolitski most.
Elektrolitski most je staklena U-cijev napunjena otopinom odgovarajućeg elektrolita.
Elektrolit omogućava nesmetan prolaz struje između dva polučlanka.
Elektrolitski most se ponekad naziva elektrolitskim ključem.
Tehnički, elektrolitski most može biti izveden na različite načine kako bi neutralizirao višak iona koji se pojavljuje u pojedinom članku.
Dogovoreno je da se u shematskom prikazu anodni proces uvijek piše na lijevoj strani.
Katodni proces uvijek se piše na desnoj strani.
Standardna vodikova elektroda
Elektrodni potencijal se za razliku od napona članka ne može mjeriti.
Vrijednost elektrodnog potencijala se određuje prema standardnoj vodikovoj elektrodi.
Standardna vodikova elektroda se sastoji od platinske pločice uronjene u otopinu klorovodične kiseline (HCl) u kojoj je koncentracija (c) vodikovih iona ( ) 1 mol dm–-3.
Čisti vodik (H2) dovodi se pod tlakom (p) od 101,3 kPa (ulazi kroz staklenu cijev (desno)) kojeg spužvasta platina adsorbira do zasićenja.
Shematski prikaz Daniellova članka
Crta označava granicu elektroda /elektrolit, a dvostruka crta označava elektrolitski most. Elektrolitski most se ponekad naziva elektrolitskim ključem, a tehnički može biti izveden na različite načine kako bi neutralizirao višak iona u pojedinom članku.
Prema dogovoru anodni proces se piše uvijek na lijevoj strani shematskog prikaza, a katodni proces na desnoj strani.
Standardna vodikova elektroda
Elektrodni potencijal se za razliku od napona članka ne može mjeriti. Vrijednost elektrodnog potencijala se određuje prema standardnoj vodikovoj elektrodi.
Standardna vodikova elektroda se sastoji od platinske pločice uronjene u otopinu klorovodične kiseline u kojoj je koncentracija vodikovih iona . Čisti vodik dovodi se pod tlakom od 100 kPa (ulazi desno kroz staklenu cijev) kojeg spužvasta platina adsorbira do zasićenja.
Prema dogovoru elektrodni potencijal standardne vodikove elektrode je nula, pri svim temperaturama.
E∘ (2H+/H2)=0,00 V
Spoji li se standardna vodikova elektroda u članak s bilo kojom drugom elektrodom može se očitavanjem napona na voltmetru odrediti redukcijski potencijal te elektrode.
Ako se redukcijski potencijal određuje pri standardnom tlaku i temperaturi (101,3 kPa i 25°C) tada je to standardni redukcijski elektrodni potencijal (E°) .
Elektrokemijski niz elemenata
Mjerenjem napona članka na opisani način određeni su potencijali drugih elektroda.
Na osnovi vrijednosti njihovih standardnih elektrodnih potencijala (E° ) načinjen je elektrokemijski niz elemenata ili Voltin niz.
Prema dogovoru elektrodni potencijal standardne vodikove elektrode je nula, pri svim temperaturama.
Spoji li se
Ako se redukcijski potencijal određuje pri temperaturi od 25 °C tada je to standardni redukcijski elektrodni potencijal ().
Elektrokemijski niz elemenata
Mjerenjem napona članka na opisani način određeni su potencijali drugih elektroda i na osnovi vrijednosti njihovih standardnih elektrodnih potencijala načinjen je elektrokemijski niz elemenata ili Voltin niz.
| elektrodna reakcija | |
|---|---|
| –2,93 | |
| –2,71 | |
| –2,37 | |
| –1,66 | |
| –0,83 | |
| –0,76 | |
| –0,74 | |
| –0,44 | |
| –0,35 | |
| –0,28 | |
| –0,25 | |
| –0,14 | |
| –0,13 | |
| –0,04 | |
| 0,00 | |
| 0,34 | |
| 0,80 |
Kako izračunati napon članka?
Potencijal galvanskog članka ili napon članka () čini razlika standardnih redukcijskih elektrodnih potencijala katode i anode.
Potencijal galvanskog članka ili napon (Ečl) uvijek ima pozitivnu (+) vrijednost.
Mjerna jedinica potencijalnog galvanskog članka ili napona je volt, V.
Kako izračunati napon članka?
Potencijal galvanskog članka ili napon članka () čini razlika standardnih elektrodnih potencijala katode i anode i uvijek ima pozitivnu vrijednost.
Mjerna jedinica: volt, V
Rješeni primjer 1.
Korak 1.
U tablici standardnih elektrodnih potencijala (E°) potrebno je pronaći vrijednosti elektrodnih potencijala zadanih elektroda

Korak 2.
Cinkova (Zn) elektroda je anoda.
Bakrova (Cu) elektroda je katoda.
Razlog tome je što cink (Zn) ima negativniji (–) redukcijski potencijal.
E čl = E katode – E anode
Korak 3.
Napon Daniellovog članka iznosi 1,10 V.
Riješeni primjer 1.
Izračunajte napon Daniellovog galvanskog članka.
Korak 1.
U tablici standardnih elektrodnih potencijala pronađu se vrijednosti elektrodnih potencijala zadanih elektroda.
 .
.
Korak 2.
Cinkova elektroda je anoda, a bakrova elektroda katoda, jer cink ima negativniji redukcijski potencijal.
Odgovor:
Napon Daniellovog članka iznosi 1,1 V.
Više informacija o električnim mjernim instrumentima možete pronaći u jedinici 4.8 Električni mjerni instrumenti u DOS-u Fizika 2.
Na kraju…
Riješite kviz!
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Otopina olova nitrata (Pb(NO3)2) neće reagirati s:
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Navedeni niz prikazuje reaktivnost nekih metala u odnosu na vodik
() (Voltin niz).
S kojim sve kovinama možemo izlučiti cink (Zn) iz otopine cinkova klorida (ZnCl2)?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
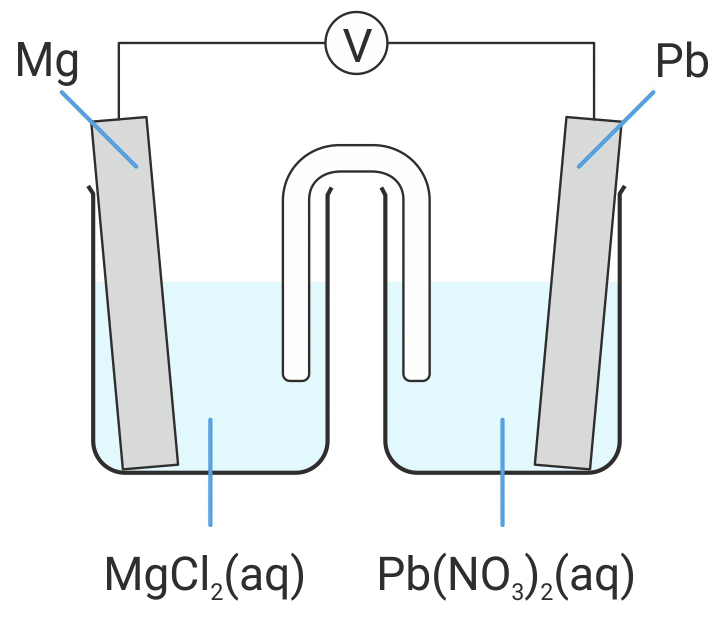
Shematski je prikazan galvanski članak sastavljen od olovnog i magnezijevog polučlanka.

Dio Voltinog niza: K, Mg, Zn, Cd, Ni, Pb, H2, Cu, A
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Vodena otopina olovova(II) nitrata, Pb(NO3)2 neće reagirati s elementarnim:
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Navedeni niz prikazuje reaktivnost nekih metala u odnosu na vodik (Voltin niz).
S kojim sve kovinama možemo izlučiti cink iz otopine cinkova klorida?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Shematski je prikazan galvanski članak sastavljen od olovnog i magnezijevog polučlanka.
Dio Voltinog niza: K, Mg, Zn, Cd, Ni, Pb, H2, Cu, Ag
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?