Redoks-reakcije
- odrediti oksidacijski broj u zadanome primjeru
- povezati pojmove oksidacije i redukcije s promjenom oksidacijskoga broja
- riješiti jednadžbe redoks-reakcija u vodenim otopinama
Uvod
Redoks reakcije su reakcije u kojima se istovremeno zbivaju reakcije oksidacije i redukcije.
U redoks reakcijama dolazi do prijelaza elektrona s jedne vrste jedinke na drugu.
Redoks reakcije
Uvod
Redoks-reakcije su reakcije u kojima se istovremeno zbivaju reakcije oksidacije i redukcije. U redoks-reakcijama dolazi do prijelaza elektrona s jedne vrste jedinke na drugu.
Redoks-reakcije
Reakcijom aluminija (Al) i joda () nastaje aluminijev jodid ().
Jednadžba kemijske reakcije:
Aluminijev jodid () je ionski spoj izgrađen od aluminijevih iona, i jodidnih iona, .
Atom aluminija () u reakciji otpušta 3 elektrona, oksidira se.
Molekula joda () u reakciji prima 2 elektrona, reducira se.
oksidacija:
redukcija:
Jednadžbe kemijskih reakcija oksidacije i redukcije nazivaju se parcijalne jednadžbe.
U navedenoj reakciji jod () je oksidirao aluminij ().
Stoga, jod () je oksidacijsko sredstvo ili oksidans.
Aluminij () u istoj reakciji reducirao jod (), aluminij () je redukcijsko sredstvo ili reducens.
Kemijska reakcija sinteze aluminijeva jodida () primjer je redoks – reakcije.
U redoks – reakcijama redukcija i oksidacija teku istovremeno.
Reakcijom aluminija i joda nastaje aluminijev jodid.
Jednadžba kemijske reakcije:
Aluminijev jodid je ionski spoj izgrađen od aluminijevih iona, i jodidnih iona .
Atom aluminija u reakciji otpušta 3 elektrona, oksidira se dok molekula joda prima 2 elektrona, reducira se.
oksidacija:
redukcija:
Jednadžbe kemijskih reakcija oksidacije i redukcije nazivaju se parcijalne jednadžbe.
U navedenoj reakciji jod je oksidirao aluminij pa je jod oksidacijsko sredstvo ili oksidans, a aluminij je reducirao jod pa je aluminij redukcijsko sredstvo ili reducens.
Kemijska reakcija sinteze aluminijeva jodida primjer je redoks-reakcije.
U redoks-reakcijama redukcija i oksidacija teku istovremeno.
Oksidacijski broj
Kako bi se olakšalo izjednačavanje jednadžbi redoks – reakcija uveden je oksidacijski broj.
Oksidacijski broj je stupanj oksidacije nekog atoma.
Prikazuje se kao rimski broj iznad simbola elementa.
On može biti:
- pozitivan (+) ,
- negativan (-),
- nula (0).
Ako je oksidacijski broj:
- pozitivan (+), predznak se ne piše
- negativan (–), piše se predznak “–” ispred oksidacijskog broja
- nula (0), koja nije rimski broj, piše se arapskom znamenkom.
Pravila za određivanje oksidacijskog broja
Oksidacijski broj može se odrediti za svaki atom u formuli spoja ako se pridržavamo određenih pravila.
Oksidacijski broj
Kako bi se olakšalo izjednačavanje jednadžbi redoks-reakcija uveden je oksidacijski broj.
Oksidacijski broj je stupanj oksidacije nekog atoma, a prikazuje se kao rimski broj iznad simbola elementa. On može biti pozitivan, negativan ili nula.
Ako je oksidacijski broj:
• pozitivan, predznak se ne piše
• negativan, piše se predznak “–” ispred oksidacijskog broja
• nula, koja nije rimski broj, piše se arapskom znamenkom.
Pravila za određivanje oksidacijskog broja
Oksidacijski broj može se odrediti za svaki atom u formuli spoja ako se pridržavamo određenih pravila.
| 1. | Oksidacijski broj atoma elementarnih tvari je 0. | |
|---|---|---|
| 2. | Oksidacijski broj atoma vodika je I u svim spojevima osim u metalnim hidridima, gdje je –I. | , , , |
| 3. | Atom kisika ima u svim spojevima oksidacijski broj –II, osim u peroksidima, gdje ima –I, a u superoksidima . |
, , , , |
| 4. | Oksidacijski broj atoma elemenata 1. skupine u spojevima je I, a atoma elemenata 2. skupine je II. | ,
, |
| 5. | Zbroj oksidacijskih brojeva atoma u molekuli ili formulskoj jedinki jednak je nuli. Atomima vodika i kisika odredi se oksidacijski broj prema pravilima, a sa X označi se oksidacijski broj atoma dušika u molekuli. Oksidacijski broj atoma dušika u dušičnoj kiselini je V. |
|
| 6. | U jednoatomnim ionima oksidacijski je broj atoma jednak nabojnom broju iona. U poliatomnim ionima zbroj oksidacijskih brojeva atoma jednak je nabojnom broju iona. | , , ,
, , |
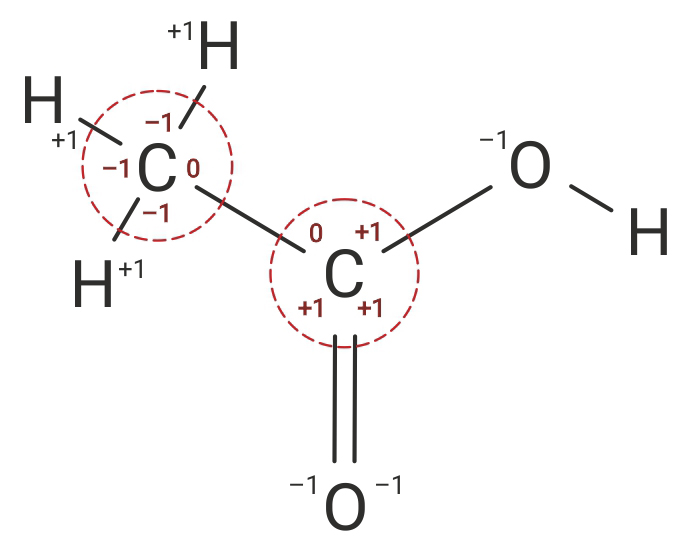
Određivanje oksidacijskih brojeva atoma ugljika u molekuli etanske kiseline
Oksidacijski broj atoma ugljika (C) treba odrediti za svaki ugljikov atom posebno, tako da napišemo strukturnu formulu molekule.
Određivanje oksidacijskih brojeva atoma ugljika u molekuli etanske kiseline
Oksidacijski broj atoma ugljika treba odrediti za svaki ugljikov atom posebno, tako da napišemo strukturnu formulu molekule.
U organskim spojevima oksidacijski broj atoma ugljika () se određuje tako da se ugljiku () za svaku vezu sa elektropozitivnijim (atom vodika) pridoda -1.
Za svaku vezu s elektronegativnijim atomom (atom kisika) ugljiku (C) se pridoda +1.
Međusobno povezanim ugljikovim () atomima napišemo nulu (0) jer između istovrsnih atoma nema razlika u elektronegativnosti.
U organskim spojevima oksidacijski broj atoma ugljika se određuje tako da se atomu ugljiku za svaku vezu s elektropozitivnijim atomom (atom vodika) pridoda –1 a za svaku vezu s elektronegativnijim atomom (atom kisika) pridoda +1. Međusobno povezanim ugljikovim atomima napišemo nulu jer između istovrsnih atoma nema razlika u elektronegativnosti.
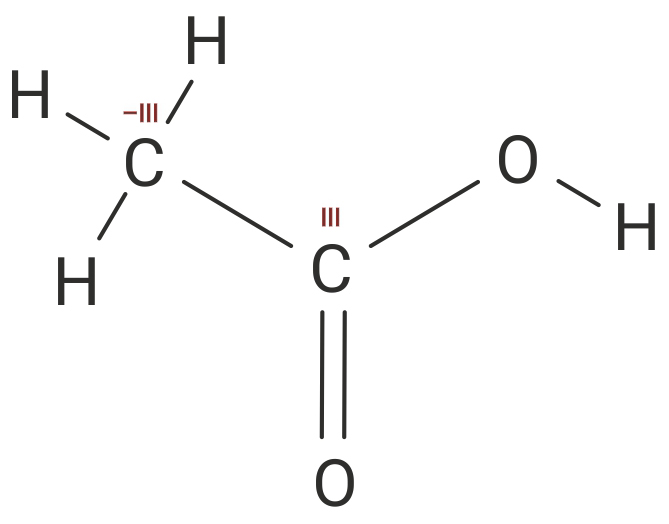
Prema tome oksidacijski brojevi atoma ugljika (C) u molekuli etanske kiseline (CH3COOH) su –III i III.
Prema tome oksidacijski brojevi atoma ugljika u molekuli etanske kiseline su –III i III.
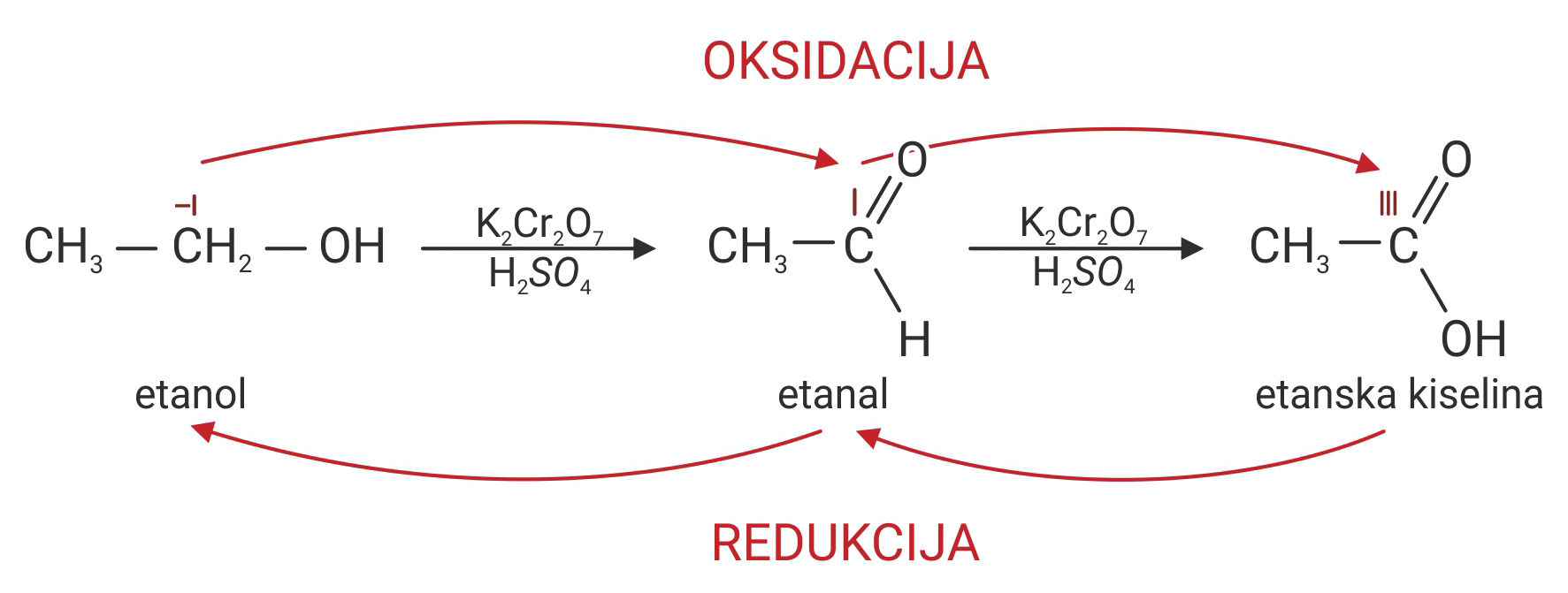
Promjena oksidacijskih brojeva atoma ugljika (C) oksidacijom etanola (C2H5OH) u etansku kiselinu (CH3COOH).
Promjena oksidacijskih brojeva atoma ugljika oksidacijom etanola u etansku kiselinu
Oksidacijom etanola () u etanal, oksidacijski broj ugljika () mijenja se od -I na I.
Oksidacijom etanala u etansku kiselinu () oksidacijski broj ugljika () mijenja se od I na III.
Oksidacijom etanola u etanal oksidacijski broj atoma ugljika mijenja se od –I na I, a oksidacijom etanala u etansku kiselinu od I na III.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Pisanje jednadžbi redoks reakcija
U reakciji cinka () i klorovodične kiseline
() nastaju cinkov klorid ( i vodik ().
Pisanje jednadžbi redoks-reakcija
U reakciji cinka i klorovodične kiseline nastaju cinkov klorid i vodik.
Da bismo odredili stehiometrijske koeficijente u jednadžbi redoks – reakcije, valja se pridržavati određenih pravila:
- Napisati reaktante i produkte reakcije.
- Odrediti oksidacijske brojeve svih sudionika u reakciji.
- Napisati jednadžbu u ionskom obliku.
Napisati samo oksidacijske brojeve koji se tijekom reakcije mijenjaju.
- Na temelju promjene oksidacijskog broja odrediti koja se tvar oksidira, a koja tvar reducira.
Napisati reakcije oksidacije i redukcije.
Ako se oksidacijski broj atoma tvari koja sudjeluje u reakciji povećava, tvar se oksidira.
Također, smanjuje li se oksidacijski broj atoma tvari, tvar se reducira.
oksidacija:
redukcija: - U reakcijama oksidacije i redukcije treba izjednačiti broj elektrona.
U ovom je primjeru broj elektrona u reakciji oksidacije i redukcije jednak (=). - Parcijalne jednadžbe zbrojimo (+):
ukupno:
Zbrajanjem (+) parcijalnih jednadžbi dobiju se koeficijenti u reakciji. - Uravnotežena jednadžba kemijske reakcije je:
Da bismo odredili stehiometrijske koeficijente u jednadžbi redoks-reakcije, valja se pridržavati određenih pravila:
1. Napisati reaktante i produkte reakcije te odrediti oksidacijske brojeve atoma svih sudionika u reakciji.
2. Napisati jednadžbu u ionskom obliku i napisati samo oksidacijske brojeve koji se tijekom reakcije mijenjaju.
3. Na temelju promjene oksidacijskog broja treba odrediti koja se tvar oksidira, a koja reducira i napisati jednadžbe reakcije oksidacije i redukcije. Ako se oksidacijski broj atoma u tvari koja sudjeluje u reakciji povećava tvar se oksidira i obratno, smanjuje li se oksidacijski broj atoma u tvari, tvar se reducira.
oksidacija:
redukcija:
4. U reakcijama oksidacije i redukcije treba izjednačiti broj elektrona.
U ovom je primjeru broj elektrona u reakciji oksidacije i redukcije jednak.
5. Parcijalne jednadžbe zbrojimo:
ukupno:
Zbrajanjem parcijalnih jednadžbi dolazi se do koeficijenata u reakciji.
6. Uravnotežena jednadžba kemijske reakcije je:
Redoks reakcija u kiseloj otopini
U redoks-reakcijama koje napreduju u kiselom mediju, prisutni su vodikovi, , odnosno oksonijevi ioni, .
Redoks-reakcija u kiseloj otopini
U redoks-reakcijama koje napreduju u kiseloj otopini, prisutni su vodikovi, , odnosno oksonijevi ioni, .
Riješeni primjer 1.
Reakcijom kalijeva permanganata () i koncentrirane klorovodične kiseline (HCl) razvija se klor (Cl).
Korak 1
Napišu se reaktanti i produkti reakcije.
Odrede se oksidacijski brojevi svih sudionika u reakciji:
Korak 2
Napisati jednadžbu u ionskom obliku i oksidacijske brojeve koji se tijekom reakcije mijenjaju.
Korak 3
Na temelju promjene oksidacijskog broja atoma odredi se koja se tvar oksidira, a koja reducira.
Napišu se jednadžbe oksidacije i redukcije.
Kad se reakcija odvija u kiseloj otopini, s lijeve strane treba dodati toliko vodikovih iona () koliko je potrebno da se atomi kisika () vežu u vodu.
oksidacija:
redukcija:
Korak 4
U svakoj redoks reakciji broj otpuštenih elektrona mora biti jednak (=) broju primljenih elektrona.
Da bismo izjednačili broj elektrona:
- prva se jednadžba pomnoži (∙) s 5
- druga se jednadžba pomnoži (∙) s 2
oksidacija:
redukcija:
Korak 5
Parcijalne jednadžbe zbrojimo (+):
Zbrajanjem (+) parcijalnih jednadžbi dobiju se koeficijenti u reakciji na temelju kojih se može napisati jednadžba kemijske reakcije.
Korak 6
Uravnotežena jednadžba kemijske reakcije je:
Napomena:
Pri zapisu uravnotežene jednadžbe kemijske reakcije potrebno je izjednačiti i brojeve atoma koji ne sudjeluju u redoks reakciji.
U riješenom primjeru 1. kalijevi ioni (K+) ne sudjeluju u redoks reakciji.
Samo dio kloridnih iona (Cl–) se oksidira.
Više o rješavanju redoks reakcija pogledajte na izvoru 2.
Riješeni primjer 1.
Reakcijom kalijeva permanganata i koncentrirane klorovodične kiseline razvija se klor. Napišite jednadžbu redoks-reakcije.
Korak 1.
Napišu se reaktanti i produkti reakcije i odrede se oksidacijski brojevi atoma svih sudionika u reakciji.
Korak 2.
Napisati jednadžbu u ionskom obliku i oksidacijske brojeve atoma koji se tijekom reakcije mijenjaju.
Korak 3.
Na temelju promjene oksidacijskog broja atoma odredi se koja se tvar oksidira, a koja reducira i napišu jednadžbe oksidacije i redukcije.
Kad se reakcija odvija u kiseloj otopini, s lijeve strane treba dodati toliko vodikovih iona koliko je potrebno da se atomi kisika vežu u vodu.
oksidacija:
redukcija:
Korak 4.
U svakoj redoks reakciji broj otpuštenih elektrona mora biti jednak broju primljenih elektrona. Da bismo izjednačili broj elektrona, prva se jednadžba pomnoži s 5, a druga s 2.
oksidacija:
redukcija:
oksidacija:
redukcija:
Korak 5.
Parcijalne jednadžbe zbrojimo.
Zbrajanjem parcijalnih jednadžbi dobiju se koeficijenti u reakciji na temelju kojih se može napisati jednadžba kemijske reakcije.
Korak 6.
Uravnotežena jednadžba kemijske reakcije je:
Napomena: Pri zapisu uravnotežene jednadžbe kemijske reakcije potrebno je izjednačiti i brojeve atoma koji ne sudjeluju u redoks reakciji. U riješenom primjeru 1 kalijevi ioni ne sudjeluju u redoks reakciji, a samo dio kloridnih iona se oksidira. Više o rješavanju redoks-reakcija pogledajte na izvoru 2.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
POMOĆ PRI RJEŠAVANJU ZADATKA:
1.
2.
3.
Kako se odnose množine , , i ?
Želite li pokušati ponovo?
Redoks reakcija u lužnatoj otopini
U redoks reakcijama u lužnatoj otopini prisutni su hidroksidni ioni, OH–(aq), koji sudjeluju u ukupnoj reakciji.
Redoks-reakcija u lužnatoj otopini
U redoks-reakcijama u lužnatoj otopini prisutni su hidroksidni ioni, , koji sudjeluju u ukupnoj reakciji.
Riješeni primjer 2.
Reakcijom otopine kalijeva permanganata (K2MnO4), sumporova (IV) oksida (SO2) i kalijeve lužine (KOH) nastaju kalijev manganat (K2MnO4), kalijev sulfat (K2SO4) i voda (H2O).
Napišite uravnoteženu jednadžbu reakcije.
Korak 1
Napišu se reaktanti i produkti reakcije.
Odrede se oksidacijski brojevi atoma svih sudionika u reakciji.
Korak 2.
Napisati jednadžbu u ionskom obliku i oksidacijske brojeve atoma koji se tijekom reakcije mijenjaju.
Korak 3.
Na temelju promjene oksidacijskog broja atoma odredi se:
- koja se tvar oksidira, a koja reducira
- napišu jednadžbe oksidacije i redukcije.
Budući se broj atoma kisika (O2) iz SO2 u SO42− poveća za dva, potrebno je dodati četiri hidroksidna iona (OH–) (dva puta više, 2·).
oksidacija:
redukcija:
oksidacija:
redukcija:
Korak 4.
Parcijalne jednadžbe zbrojimo (+).
Zbrajanjem (+) parcijalnih jednadžbi dobiju se koeficijenti u reakciji na temelju kojih se može napisati jednadžba kemijske reakcije.
Korak 5.
Uravnotežena jednadžba kemijske reakcije je:
Napomena: Pri zapisu uravnotežene jednadžbe kemijske reakcije potrebno je izjednačiti i brojeve atoma koji ne sudjeluju u redoks reakciji.
Više o rješavanju redoks-reakcija pogledajte na izvoru 2.
Riješeni primjer 2.
Reakcijom vodene otopine kalijeva permanganata, sumporova(IV) oksida i kalijeve lužine nastaju kalijev manganat, kalijev sulfat i voda. Napišite uravnoteženu jednadžbu reakcije.
Korak 1.
Napišu se reaktanti i produkti reakcije i odrede se oksidacijski brojevi atoma svih sudionika u reakciji.
Korak 2.
Napisati jednadžbu u ionskom obliku i oksidacijske brojeve atoma koji se tijekom reakcije mijenjaju.
Korak 3.
Na temelju promjene oksidacijskog broja atoma odredi se koja se tvar oksidira, a koja reducira i napišu jednadžbe oksidacije i redukcije.
Budući da se broj atoma kisika iz u poveća za dva, potrebno je dodati četiri hidroksidna iona (dva puta više).
U svakoj redoks-reakciji broj otpuštenih elektrona mora biti jednak broju primljenih elektrona.
oksidacija:
redukcija:
oksidacija:
redukcija:
Korak 4.
Parcijalne jednadžbe zbrojimo.
Zbrajanjem parcijalnih jednadžbi dobiju se koeficijenti u reakciji na temelju kojih se može napisati jednadžba kemijske reakcije.
Korak 5.
Uravnotežena jednadžba kemijske reakcije je:
Napomena: Pri zapisu uravnotežene jednadžbe kemijske reakcije potrebno je izjednačiti i brojeve atoma koji ne sudjeluju u redoks reakciji. Više o rješavanju redoks-reakcija pogledajte na izvoru 2.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Rješavanje redoks reakcija bez pisanja parcijalnih jednadžbi
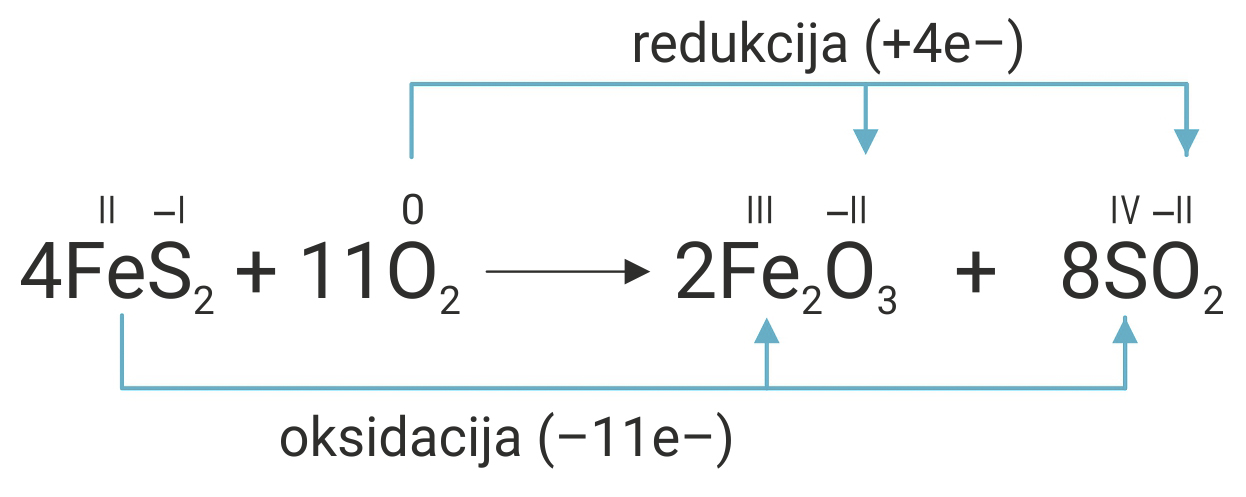
Uravnotežite reakciju prženja pirita, FeS2, bez pisanja parcijalnih jednadžbi oksidacije i redukcije.
Postupak:
- Napiše se jednadžba kemijske reakcije prženja pirita, FeS2, i odrede se oksidacijski brojevi svih atoma.
- Jedan atom željeza () otpušta 1 elektron.
- Jedan atom sumpora () otpušta 5 elektrona.
- Dakle, dva atoma sumpora () otpuštaju 10 elektrona.
Iz navedenoga proizlazi da jedna formulska jedinka pirita ( ) otpušta ukupno 11 elektrona.
Jedna molekula kisika () prima 4 elektrona.
Budući da je zajednički višekratnik 44, treba izračunati stehiometrijske koeficijente sudionika u reakciji.
Rješavanje redoks-reakcija bez pisanja parcijalnih jednadžbi
Uravnotežite reakciju prženja pirita, bez pisanja parcijalnih jednadžbi oksidacije i redukcije.
Postupak:
- Napiše se jednadžba kemijske reakcije prženja pirita i odrede se oksidacijski brojevi svih atoma.
- Jedan atom željeza iz formulske jedinke pirita otpušta 1 elektron, jedan atom sumpora 5 elektrona, dakle dva atoma sumpora otpuštaju 10 elektrona. Iz navedenoga proizlazi da jedna formulska jedinka pirita otpušta ukupno 11 elektrona, a jedna molekula kisika prima 4 elektrona. Budući da je zajednički višekratnik 44, treba izračunati stehiometrijske koeficijente sudionika u reakciji.
- U reakciji prženja pirita, FeS2, kisik ( ) je oksidacijsko, a pirit ( ) redukcijsko sredstvo.
Pogledajte pozorno videozapis Oksidacija amonijaka i potom odgovorite na pitanja.
- U reakciji prženja pirita kisik je oksidacijsko, a pirit redukcijsko sredstvo.
Pogledajte pozorno videozapis Oksidacija amonijaka i potom odgovorite na pitanja.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Na kraju…
Riješite kviz i ponovite najvažnije spoznaje o redoks-reakcijama.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Oksidacijski broj atoma dušika (N2) povećava se u sljedećem primjeru:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Ako pergamanat (MnO4–) prelazi u Mn2+, atom mangana iz MnO4– se:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Što je od navedenoga u prikazanoj kemijskoj reakciji redukcijsko sredstvo?
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Oksidacijski broj atoma dušika se povećava u sljedećem primjeru:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Ako prelazi u , atom mangana iz se:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Što je od navedenoga u prikazanoj kemijskoj reakciji redukcijsko sredstvo?
Želite li pokušati ponovo?