Korozija je neželjena redoks-reakcija
- objasniti proces korozije željeza
- poznavati neke načine zaštite željeza od korozije
Uvod
Što povezuje crvenosmeđu hrđu i plavozelenu patinu spomenika od bakra ()?
Uvod
Što povezuje crvenosmeđu hrđu i plavozelenu patinu spomenika od bakra?
Hrđa na željezu () i patina na bakru () su korozijski produkti.
Kako su nastali?
Hrđa na željezu i patina na bakru korozijski su produkti. Kako su nastali?
Na ova pitanja odgovaraju znanstvenici proučavanjem uvjeta nastajanja korozije i zaštite metala od korozije.
Što je korozija?
Korozija je štetno i nepoželjno trošenje konstrukcijskog materijala.
Uzrokovana je fizikalnim, fizikalno-kemijskim, kemijskim i biološkim agensima.
U užem smislu često se primjenjuje samo na metale.
Korozija je prirodni fenomen, uništavanje metala i njegovih svojstava djelovanjem okoliša.
Može biti kemijska i elektrokemijska.
Može zahvatiti cijelu površinu metala ili samo neke dijelove.
Zlato (Au) i platina (Pt) su samorodni metali.
Mogu se naći u prirodi isključivo u elementarnom stanju.
Većina metala nalaze se u spojevima, najčešće oksidima, sulfidima, sulfatima i karbonatima.
Za njihovo dobivanje potrebno je uložiti neku količinu energije.
Prema zakonima temodinamike tako proizvedeni metali nastoje se vratiti u prvotno stabilnije stanje.
Pri tome oslobađaju energiju.
Stabilnije stanje postiže se spontanim korozijskim procesima u kojima nastaje korozijski produkt sličan spoju od kojeg je metal dobiven.
Visoka vlažnost zraka pogoduje brzini korozije.
Vlaga djeluje kao otapalo za kisik (), druge plinove i soli.
Tako nastaje elektrolit za galvanske članke.
U gradskim i industrijskim područjima, u slučajevima većeg zagađenja okoliša, sastav plinova, bazičnost ili kiselost sredine značajno pridonose jakom korodiranju.
Industrijski i termoenergetski sustavi često koriste prirodne površinske vode.
Najčešće koriste riječne vode za rashlađivanje i ispiranje svojih postrojenja.
U tim vodama se mogu nalaziti anaerobne bakterije koje reduciraju sulfate i koje stvaraju biofilm na površini metala.
Na taj način dolazi do tzv. mikrobiološki uvjetovane korozije.
Povišenje temperature, veće (>) od one potrebne za smanjenje vlažnosti zraka, ubrzava koroziju.
Što neki metal ima negativniji (–) standardni elektrodni potencijal (E°), podložniji je koroziji.
Metali poput zlata (Au), srebra (Ag) i platine (Pt) vrlo su otporni na koroziju.
Otapanje, korozija anode, biti će intenzivnija što su metali, koji čine galvanski članak, udaljeniji u elektrokemijskom nizu elemenata.
Što su po sastavu korozijski produkti željeza, aluminija, bakra i srebra?
Vlažnost zraka, kisik (O2), kloridni ili drugi ioni, kisela sredina i viša temperatura ubrzavaju proces korozije željeza i nastajanje hrđe, hidratiziranog željezovog (III) oksida, Fe2O3 · H2O.
Na ova pitanja odgovaraju znanstvenici proučavanjem uvjeta nastajanja korozije i zaštite metala od korozije.
Što je korozija?
Korozija je štetno i nepoželjno trošenje konstrukcijskog materijala uzrokovano fizikalnim, fizikalno-kemijskim, kemijskim i biološkim agensima. U užem smislu često se primjenjuje samo na metale. Korozija je prirodni fenomen, uništavanje metala i njegovih svojstava djelovanjem okoliša. Može biti kemijska i elektrokemijska, može zahvatiti cijelu površinu metala ili samo neke dijelove.
Zlato i platina, samorodni su metali koji se u prirodi mogu naći u elementarnom stanju. Većina metala nalazi se u spojevima, najčešće oksidima, sulfidima, sulfatima i karbonatima. Za njihovo dobivanje potrebno je uložiti neku količinu energije. Prema zakonima temodinamike tako proizvedeni metali nastoje se vratiti u prvotno stabilnije stanje, i pri tome oslobađati energiju. Stabilnije stanje postiže se spontanim korozijskim procesima u kojima nastaje korozijski produkt sličan spoju od kojeg je metal dobiven.
Visoka vlažnost zraka, pogoduje brzini korozije. Vlaga djeluje kao otapalo za kisik, druge plinove i soli, pa tako nastaje elektrolit za galvanske članke. U slučajevima većeg zagađenja okoliša u gradskim i industrijskim područjima prašina, sastav plinova, bazičnost ili kiselost sredine značajno pridonose jakom korodiranju. Industrijski i termoenergetski sustavi često koriste prirodne površinske vode, najčešće riječne vode za rashlađivanje i ispiranje svojih postrojenja. U tim vodama se mogu nalaziti anaerobne bakterije koje reduciraju sulfate i koje stvaraju biofilm na površini metala, pa na taj način dolazi do tzv. mikrobiološki uvjetovane korozije. Povišenje temperature, veće od onog potrebnog za smanjenje vlažnosti zraka, ubrzava koroziju.
Što neki metal ima negativniji standardni elektrodni potencijal, podložniji je koroziji, dok su metali poput zlata, srebra i platine vrlo otporni na koroziju. Otapanje, korozija anode, biti će intenzivnija što su metali koji čine galvanski članak udaljeniji u elektrokemijskom nizu elemenata.
Što su po sastavu korozijski produkti željeza, aluminija, bakra i srebra?
Vlažnost zraka, kisik, kloridni ili drugi ioni, kisela sredina i viša temperatura ubrzavaju proces korozije željeza i nastajanje hrđe, hidratiziranog željezovog(III) oksida, .
Na istom komadu željeza (Fe), zbog različitog pristupa kisika (), može na jednom dijelu biti anoda, a na drugom katoda.
Na anodi dolazi do oksidacije željeza (Fe).
Na katodi kisik () se u reakciji s vodom reducira.
Elektroni oslobođeni oksidacijom na metalnoj površini reduciraju kisik () uz prisutnost vode.
Nastaju hidroksidni ioni (OH-).
Reakcijom željezovih (II) iona () i hidroksidnih iona () nastaje željezov (II) hidroksid ().
Oksidacijom željezova (II) hidroksida () u reakciji s kisikom () i vodom () nastaje željezov (III) hidroksid ().
hrđa
Nastali željezov (III) hidroksid (Fe(OH)3) razlaže se na stabilniji hidratizirani željezov (III) oksid formule koji se naziva hrđa.
Na površini željeza (Fe) korodiranjem nastaje hrđa koja je porozna.
Ne prijanja uz metalnu površinu i ne može zaštiti površinu željeza (Fe) od daljnje korozije.
Stoga, hrđanje prodire u dublje slojeve željeza.
Kod aluminija (Al), bakra (Cu) i srebra (Ag), korozija štiti od daljnjeg propadanja.
Na bakrenim površinama tijekom vremena nastaje zaštitni površinski sloj plavozelenog bazičnog bakrova (II) karbonata, .
Čisto srebro (Ag) (w = 99,9%) slabo oksidira.
Vremenom gubi sjaj i tamni.
Na istom komadu željeza, zbog različitog pristupa kisika, može na jednom dijelu biti anoda, a na drugom katoda. Na anodi dolazi do oksidacije željeza, a na katodi se kisik u reakciji s vodom reducira.
Elektroni oslobođeni oksidacijom na metalnoj površini reduciraju kisik uz prisutnost vode i nastaju hidroksidni ioni.
Reakcijom željezovih(II) iona i hidroksidnih iona nastaje željezov(II) hidroksid.
Oksidacijom željezova(II) hidroksida u reakciji s kisikom i vodom nastaje željezov(III) hidroksid.
Nastali željezov(III) hidroksid razlaže se na stabilniji hidratizirani željezov(III) oksid formule koji se naziva hrđa.
Na površini željeza korodiranjem nastaje hrđa koja je porozna, ne prijanja uz metalnu površinu i ne može zaštiti površinu željeza od daljnje korozije, pa hrđanje prodire u dublje slojeve željeza.
Kod aluminija, bakra i srebra, korozija štiti od daljnjeg propadanja.
Na bakrenim površinama tijekom vremena nastaje zaštitni površinski sloj plavozelenog bazičnog bakrova(II) karbonata, .
Čisto srebro (w = 99,9 %) slabo oksidira, ali vremenom gubi sjaj i tamni.
Premekano je za izradu uporabnih predmeta.
Dodaju mu se razni metali (najčešće bakar, Cu) koji utječu na nastajanje korozijskih produkata i mogu biti indikatori čistoće srebra (Ag).
Najčešći korozijski produkt je srebrov sulfid (AgS).
Srebrov sulfid (AgS) nastaje utjecajem okoliša.
Mijenja izgled srebra.
Premekano je za izradu uporabnih predmeta. Dodaju mu se razni metali (najčešće bakar) koji utječu na nastajanje korozijskih produkata i mogu biti indikatori čistoće srebra. Najčešći korozijski produkt, koji nastaje utjecajem okoliša i mijenja izgled srebra, je srebrov sulfid.
Kako zaštiti metale od korozije ?
Korozija je spontani proces koji se ne može spriječiti, ali se može usporiti.
Oksidne prevlake mogu nastati kontroliranom oksidacijom uranjanjem u odgovarajuće otopine, na primjer lužine.
Na ovaj način se često štite od atmosferskog utjecaja metalna umjetnička djela, izložena na otvorenom prostoru.
Željezo (Fe) se može zaštiti od korozije nanošenjem metalnih prevlaka elektrokemijskim postupcima.
Metalne prevlake, na ugljičnom čeliku, mogu biti:
- katodne (Au, Ag, Ni, Cr, Pb, Sn),
- anodne (Zn,Cd).
Kako zaštiti metale od korozije ?
Korozija je spontani proces koji se ne može spriječiti, ali se može usporiti zaštitom metala oksidnim prevlakama, elektrokemijskim postupcima i premazivanjem. Oksidne prevlake mogu nastati kontroliranom oksidacijom uranjanjem u odgovarajuće otopine na primjer lužine. Na ovaj način se često štite od atmosferskog utjecaja metalna umjetnička djela izložena na otvorenom prostoru.
Željezo se može zaštiiti od korozije nanošenjem metalnih prevlaka elektrokemijskim postupcima. Metalne prevlake na ugljičnom čeliku mogu biti katodne (Au, Ag, Ni, Cr, Pb, Sn) i anodne (Zn,Cd).
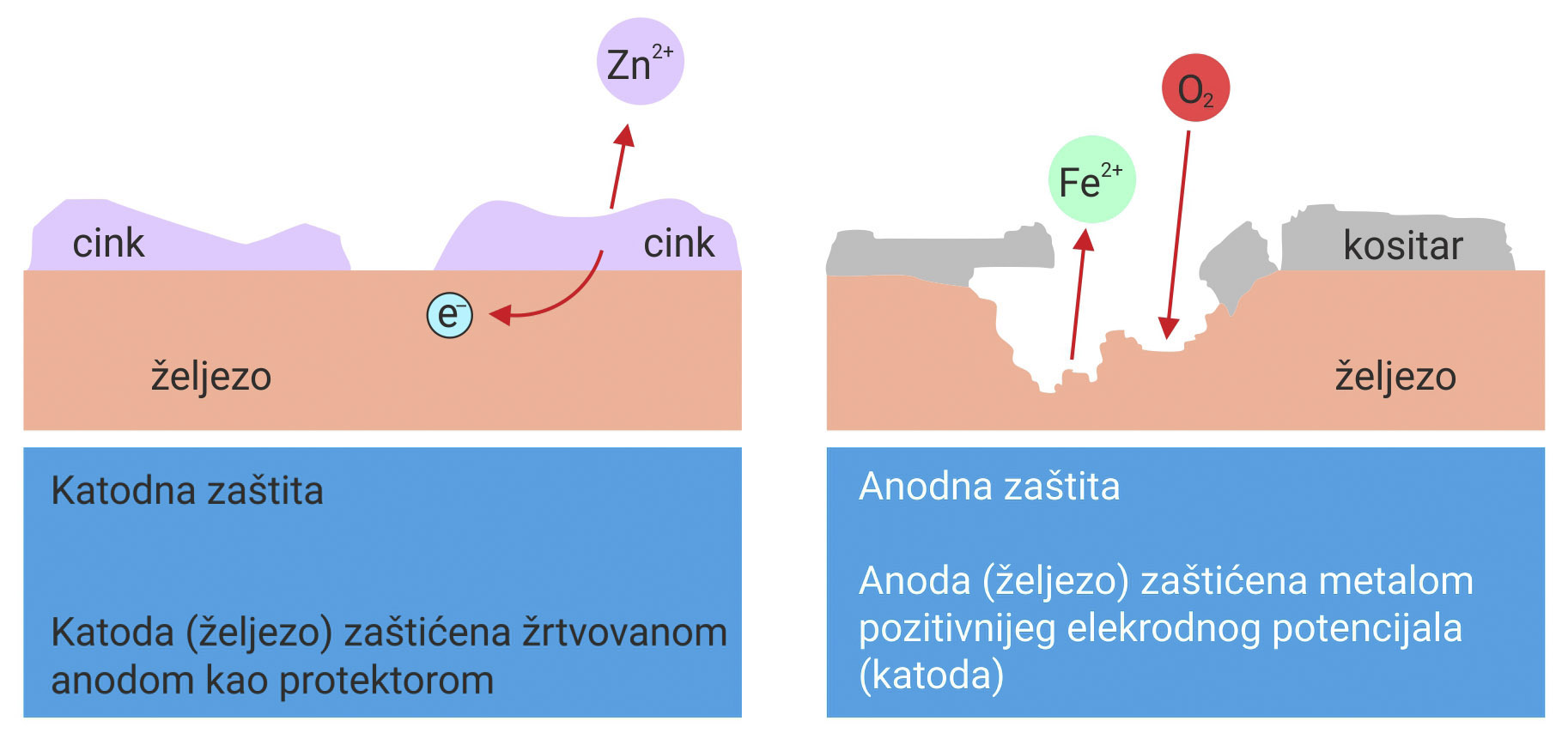
Zaštita žrtvovanom elektrodom je zaštita metala reaktivnijim metalom, metalom negativnijeg (–) elektrodnoga potencijala.
Zaštićeni metal je katoda.
Žrtvovana elektroda je anoda.
Žrtvovana elektroda, anoda, u slučaju oštećenja prevlake, korodira.
Ako se metal štiti metalom pozitivnijeg (+) elektrodnog potencijala dolazi do korozije štićenog metala, u slučaju oštećenja prevlake.
Zaštita žrtvovanom elektrodom je zaštita metala reaktivnijim metalom, metalom negativnijeg elektrodnoga potencijala. Zaštićeni metal je katoda, a žrtvovana elektroda je anoda, koja u slučaju oštećenja prevlake, korodira. Ako se metal štiti metalom pozitivnijeg elektrodnog potencijala, u slučalu oštećenja prevlake, dolazi do korozije štićenog metala.
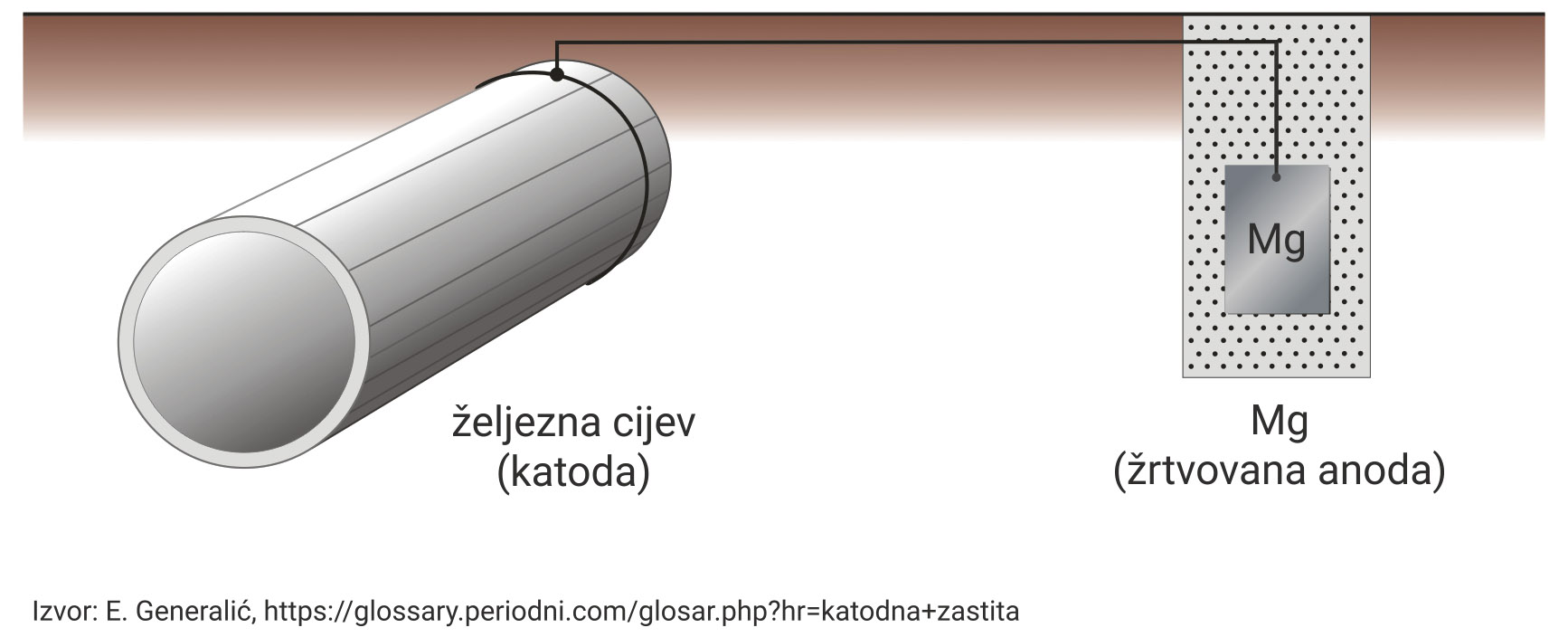
Gornji crtež prikazuje jedan od najčešćih i najjednostavnijih načina zaštite cjevovoda od korozije.
Prikazana zaštita se zasniva na namjerno napravljenom galvanskom članku u kojemu se anoda žrtvuje da bi se zaštitila katoda.
Proučite crtež.
Odgovorite na sljedeća pitanja:
a) Koji je metal katoda, a koji anoda?
b) Napišite jednadžbe polureakcija oksidacije i redukcije na elektrodama.
Odgovori:
a) Magnezijeva ploča je “žrtvovana anoda” jer magnezij (Mg) ima negativniji (–) standardni redukcijski potencijal od željeza (Fe).
b)
anoda (–):
katoda (+):

Gornji crtež prikazuje jedan od najčešćih i najjednostavnijih načina zaštite cjevovoda od korozije, koja se zasniva na namjerno napravljenom galvanskom članku u kojemu se anoda žrtvuje da bi se zaštitila katoda.
Proučite crtež i odgovorite na sljedeća pitanja:
a) Objasnite zašto je željezna cijev katoda, a magnezijeva ploča anoda?
b) Napišite jednadžbe polureakcija oksidacije i redukcije na elektrodama.
Odgovori:
a) Magnezijeva ploča je “žrtvovana anoda” jer magnezij ima negativniji standardni redukcijski potencijal od željeza.
b)
anoda(-):
katoda(+):
Za zaštitu željeznih limova najčešće se koriste kositar i cink. Mnogi predmeti u kućanstvu i postrojenja u prehrambenoj industriji zaštićeni su kositrenim prevlakama. Takva se zaštita koristi za limenke u kojima se čuva konzervirana hrana. Ako se prevlaka od kositra ošteti, hrana postaje opasna za zdravlje.
(; )
Odgovorite:
a) O kojoj se vrsti zaštite radi?
b) Koji će metal biti žrtvovana elektroda?
c) Jednadžbama polureakcija oksidacije i redukcije napišite što se događa na anodi i katodi.
Odgovori:
a) Radi se o anodnoj zaštiti.
b) Željezo, metal negativnijeg elektrodnog potencijala, bit će “žrtvovana elektroda”.
c)
anoda(-):
katoda(+):
Premazi na metalima mogu biti:
- anorganski
- organski.
Moraju prekriti cijelu površinu metala i pasivizirati je.
Sve se više koriste inhibitori koji, dodani u maloj količini, smanjuju stupanj korozije.
Sintetički organski spojevi pokazali su dobra zaštitna svojstva, ali ne i ekološka.
Razlog tome je što nisu biorazgradivi i dugo se zadržavaju u okolišu.
Uz ekonomičnost i djelotvornost potrebna je i ekološka prihvatljivost koja se očituje u sve većoj uporabi inhibitora dobivenih iz prirodnih izvora
Premazi na metalima mogu biti anorganski i organski. Moraju prekriti cijelu površinu metala i pasivizirati je.
Sve se više koriste inhibitori koji, dodani u maloj količini, smanjuju stupanj korozije. Sintetički organski spojevi pokazali su dobra zaštitna svojstva, ali ne i ekološka, jer nisu biorazgradivi i dugo se zadržavaju u okolišu.
Uz ekonomičnost i djelotvornost potrebna je i ekološka prihvatljivost koja se očituje u sve većoj uporabi inhibitora dobivenih iz prirodnih izvora.
Biljni ekstrakti i ulja prirodni su antioksidansi.
Ne štete okolišu i imaju inhibitorsko djelovanje.
U njima se nalaze spojevi poput tanina, fenolnih kiselina, vanilina.
Oni djeluju kao inhibitori.
Sve je više vodorazrjedivih premaza koji zamjenjuju tradicionalnu tehnologiju premaza s hlapivim organskim kiselinama.
Danas se ulažu veliki napori i velika novčana sredstva da bi se metalnim predmetima produžio vijek trajanja.
Teži se tome da od neprijatelja postanu prijatelji okoliša.
Štete uzrokovane korozijom su velike jer su svi konstrukcijski materijali u nepovoljnim uvjetima podložni koroziji.
Korozija je sveprisutan problem koji ima veliku važnost u širokom rasponu industrijskih primjena i proizvoda.
Prema procjeni, troškovi koji se mogu pripisati koroziji iznose oko 4 % ukupnoga bruto društvenog proizvoda (BDP) razvijenih zemalja.
Svaki od postupaka zaštite metala potencijalni je zagađivač okoliša.
Biljni ekstrakti i ulja prirodni su antioksidansi, ne štete okolišu i imaju inhibitorsko djelovanje. U njima se nalaze spojevi poput tanina, fenolnih kiselina, vanilina, koji djeluju kao inhibitori. Sve je više vodorazrjedivih premaza koji zamjenjuju tradicionalnu tehnologiju premaza s hlapivim organskim kiselinama.
Danas se ulažu veliki napori i velika novčana sredstva da bi se metalnim predmetima produžio vijek trajanja i da od neprijatelja postanu prijatelji okoliša.
Štete uzrokovane korozijom su velike jer su svi konstrukcijski materijali u nepovoljnim uvjetima podložni koroziji. Korozija je sveprisutan problem koji ima veliku važnost u širokom rasponu industrijskih primjena i proizvoda. Prema procjeni, troškovi koji se mogu pripisati koroziji iznose oko 4 % ukupnoga bruto društvenog proizvoda (BDP) razvijenih zemalja. Svaki od postupaka zaštite metala potencijalni je zagađivač okoliša.
Metoda zaštite metala mora biti ekonomična, učinkovita, ekoliški prihvatljiva, netoksična za ljude i okoliš.
Danas su za mnoge postupke zaštite od korozije doneseni zakoni koji zabranjuju uporabu toksičnih tvari.
Također, ti zakoni reguliraju emisiju otpadnih tvari iz tih procesa.
Istraživanje zaštite metala ima najvažniju zadaću produžiti uporabni vijek metalnog proizvoda, a pritom izbjeći nepovoljan utjecaj na okoliš.
To je do sada bilo još je uvijek proturječno.
S razvitkom vodorazrjedivih premaza, zaštita od korozije postaje “prijatelj okoliša”.
Metoda zaštite metala mora biti ekonomična, učinkovita i ekološki prihvatljiva, netoksična za ljude i okoliš. Danas su za mnoge postupke zaštite od korozije doneseni zakoni koji zabranjuju uporabu toksičnih tvari i reguliraju emisiju otpadnih tvari iz tih procesa. Istraživanje zaštite metala ima najvažniju zadaću produžiti uporabni vijek metalnog proizvoda, a pritom izbjeći nepovoljan utjecaj na okoliš, što je do sada bilo i još je uvijek proturječno. S razvitkom vodorazrjedivih premaza, zaštita od korozije postaje “prijatelj okoliša”.
Na kraju…
Okoliš ima veliki utjecaj na koroziju metala.
Razmislite i odgovorite na sljedeća pitanja.
Na kraju…
Okoliš ima veliki utjecaj na koroziju metala. Razmislite i odgovorite na sljedeća pitanja.
Okoliš ima veliki utjecaj na koroziju metala.
Razmislite i odgovorite na pitanja postavljena na početku teksta.
- a) Zašto željezni meteoriti nakon putovanja milijuna godina kroz Sunčav sustav dospijevaju na Zemlju kao komadići čistog metala s malo hrđe?
- b) Zašto željezni stup u Delhiu, star oko 1600 godina, težak 6,5 tona, visok 7,21 m i dalje zadržava svoj sjaj bez posljedica korozije?
Odgovori:
- a) Željezni meteoriti imaju veliki maseni udio (w) željeza (Fe), a ostatak je nikal (Ni).
Velike su mase.
Nisu porozni.
Imaju sjajnu, zaobljenu površinu.
Svemir se sastoji od vodika, H2, (w = 60,4 %) i helija, He, (w = 36,6 %).
Kisika (O2) ima manje (<) od 1 %.
Tijekom dugog puta kroz svemir, malo kisika (< O2), niske temperature i nedostatak vlažnosti prostora iz kojih dolaze meteoriti, mogli bi biti razlog njihove otpornosti na koroziju.
Na Zemlji, promjenom uvjeta okoliša, počinju korodirati.
Meteoriti mogu imati u sastavu, osim željeza (Fe) i nikla (Ni), druge spojeve koji utječu na brzinu korozije.
Jedan od njih je natrijev klorid (NaCl) koji je higroskopan.
Istražite kako se čuvaju meteoriti!
- b) Otpornost prema koroziji stupa dokaz je drevnih indijskih postignuća u načinu dobivanja i vještine kovanja željeza (Fe), koja je bila poznata indijskim kovačima. Znanstvenici istražuju i utjecaj okoliša na stup.
Ako je vlažnost zraka veća (>) od 70 %, stvara se na površini metala tanki sloj vode.
Tanki sloj vode utječe na koroziju.
Koroziju ubrzava onečešćeni zrak.
Stup u Delhiju je u području suptropske klime.
Vlažnost zraka je ispod 70 %.
Nalazi se daleko od naseljenih područja.
Stoga je zagađenost zraka vrlo mala.
Danju zagrijana, velika masa stupa, ne stigne se noću ohladiti.
Stoga, relativno malo vodene pare se kondenzira na njegovoj površini.
Veliki maseni udio (w) željeza (Fe) i njegova čistoća smanjuju mogućnost hrđanja.
Jedan od mogućih odgovora za otpornost stupa je postojanje zaštitnog mikrostrukturnog sloja.
U tom sloju se nalaze nereducirani željezovi oksidi i željezov fosfat hidrat.
Istražuje se je li nastao kao posljedica načina kovanja željeza ili utjecajem okoliša.
Svoje odgovore prodiskutirajte sa drugim učenicima u razredu. Kako bi saznali više, pročitajte tekst koji slijedi.
Odgovori:
1. Svemir se sastoji od vodika (w = 60,4 %) i helija (w = 36,6 %). Kisika u svemiru ima manje od 1 %. Željezni meteoriti tijekom dugog puta kroz svemir u kojem su neznatne količine kisika, niska temperatura i nedostatak vlažnosti prostora, mogu biti razlog njihove otpornosti na koroziju. Na Zemlji, promjenom uvjeta okoliša, meteoriti počinju korodirati. U sastavu meteorita, osim željeza, nalazi se i nikl te drugi spojevi koji mogu utjecati na brzinu korozije. Jedan od njih je natrijev klorid koji je higroskopan.
Istražite kako se čuvaju meteoriti!
2. Otpornost prema koroziji stupa dokaz je drevnih indijskih postignuća u načinu dobivanja i vještine kovanja željeza, koja je bila poznata indijskim kovačima. Znanstvenici istražuju i utjecaj okoliša na stup. Ako je vlažnost zraka veća od 70 % stvara se na površini metala tanki sloj vode koji utječe na koroziju koju ubrzava onečešćeni zrak. Stup u Delhiju u području je suptropske klime, vlažnost zraka je ispod 70 %, a nalazi se daleko od naseljenih područja, pa je zagađenost zraka vrlo mala. Danju zagrijana,velika masa stupa, ne stigne se noću ohladiti, pa relativno malo vodene pare kondenzira na njegovoj površini. Veliki maseni udio željeza i njegova čistoća smanjuju mogućnost hrđanja. Jedan od mogućih odgovora za otpornost stupa je postojanje zaštitnog mikrostrukturnog sloja u kojem se nalaze nereducirani željezovi oksidi i željezov(III) fosfat monohidrat. Istražuje se je li nastao kao posljedica načina kovanja željeza ili utjecajem okoliša.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite točan odgovor.
Koji korozijski produkti mogu nastati na metalu djelovanjem okoliša?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji korozijski produkti mogu nastati na metalu djelovanjem okoliša?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?