Fizikalna i kemijska svojstva tvari
- objasniti značajke agregacijskih stanja tvari
- analizirati fizikalne i kemijske promjene
- očitati podatke iz grafičkog ili tabličnog prikaza
- usporediti tvari po sastavu, vrsti i svojstvima.
Tvari
Tvari ili supstancije (lat. substantia) izgrađuju svijet koji nas okružuje.
Prepoznaju se po karakterističnim fizikalnim i kemijskim svojstvima.
Fizikalna su svojstva značajka svake tvari.
Promjene fizikalnih svojstava nazivamo fizikalnim promjenama.
Pri fizikalnim promjenama ne mijenja se vrsta tvari.
Mijenja se oblik i agregacijsko stanje.
Tvari
Tvari ili supstancije (lat. substantia) izgrađuju svijet koji nas okružuje, a prepoznaju se po karakterističnim fizikalnim i kemijskim svojstvima.
Fizikalna svojstva tvari očituju se prilikom fizikalnih promjena. Pri fizikalnoj promjeni ne mijenja se vrsta tvari, već samo njezin oblik i agregacijsko stanje.
Fizikalna svojstva tvari
Osim agregacijskog stanja neka fizikalna svojstva tvari su:
talište, vrelište, gustoća, topljivost,
električna i toplinska vodljivost i magnetičnost.
Ova svojstva ne ovise o veličini uzorka.
Takva svojstva nazivamo intenzivnim svojstvima.
Fizikalna svojstva tvari kao što su volumen ili masa
ovise o veličini (količini) tvari u uzorku kojeg promatramo.
Takva svojstva nazivamo ekstenzivnim svojstvima.
Ponovimo i proširimo spoznaje o nekim fizikalnim svojstvima.
Fizikalna svojstva tvari
Osim agregacijskog stanja u osnovna fizikalna svojstva ubrajaju se i talište, vrelište, gustoća, topljivost, električna i toplinska vodljivost, magnetičnost i druga. Ova svojstva ne ovise o veličini uzorka i nazivaju se intenzivnim svojstvima.
Fizikalna svojstva tvari kao što su volumen ili masa ovise o veličini (količini) tvari u uzorku kojeg promatramo. Takova svojstva nazivamo ekstenzivnim svojstvima.
Ponovimo i proširimo spoznaje o nekim fizikalnim svojstvima.
Boja
Kad svjetlost određenog dijela spektra pobudi
receptore u mrežnici oka,
nastaje osjetilni doživljaj koji se naziva boja.
Boja
Boja je osjetilni doživljaj koji nastaje kad svjetlost određene valne duljine pobudi receptore u mrežnici oka.
Agregacijska stanja tvari
Tvari se u prirodi nalaze u četiri agregacijska stanja:
- čvrstom (engl. solid, s) = čvrsta tvar
- tekućem (engl. liquid, l) = tekućina
- plinovitom (engl. gas, g) = plin
- plazmi
Stanje u kojem će se tvar nalaziti ovisi o stupnju uređenosti strukture, odnosno o privlačnim silama između čestica.
Fizikalna se svojstva tvari
u različitim agregacijskim stanjima mogu razlikovati.
Voda ima različitu gustoću
u čvrstom, tekućem i plinovitom stanju.
Fizikalna se svojstva tvari u različitim agregacijskim stanjima mogu razlikovati. Primjerice, voda ima različitu gustoću u čvrstom, tekućem i plinovitom stanju.
Čvrste tvari
Čvrste tvari imaju stalan oblik i stalan volumen.
Čvrste tvari su nestlačive.
Udaljenost između čestica čvrstih tvari je
mala, a uređenost strukture velika.
Čestice samo titraju oko središnjeg položaja
ne napuštajući karakterističnu geometrijsku strukturu.
Čvrsto se stanje označava slovom (s).
Tekućine ili kapljevine
Tekućine/tekuće tvari nemaju stalan oblik.
Tekućine imaju stalan volumen.
Poprimaju oblik posude u kojoj se nalaze.
Nestlačive su.
Udaljenost između čestica u tekućini
je nešto veća nego u čvrstom stanju.
Uređenost strukture je manja.
Čestice se u tekućim tvarima
relativno slobodno gibaju i mijenjaju položaj.
Tekuće stanje označava se slovom (ℓ).
Plinovi
Plinovite tvari nemaju stalan oblik ni stalan volumen.
Plinovi poprimaju oblik posude u kojoj se nalaze.
Plinovi su stlačivi.
Volumen plina ovisi o tlaku i temperaturi.
Udaljenost između čestica plinovitih tvari je velika.
Plinovi nemaju uređenu strukturu.
Položaj čestica brzo se mijenja u svim smjerovima u prostoru.
Plinovito stanje označava se slovom (g).
Plazma
Plazma je ionizirani plin.
Tvar u plazma-stanju dobro provodi električnu struju i reagira na električno i magnetsko polje.
Tvar u plazma-stanju nema određen oblik ni volumen.
Prvi znanstvenik koji je opisao plazmu zvao se sir William Crookes.
One je plazmu 1879. godine nazvao materijalom koji zrači.
Došao je do zaključka da je plazma četvrto agregacijsko stanje tvari.
Voda u prirodi se nalazi u sva tri agregacijska stanja, kao led, voda i vodena para.
Čvrste tvari
Čvrste tvari imaju stalan oblik i stalan volumen, nestlačive su. Udaljenost između čestica čvrstih tvari je mala, a uređenost strukture velika. Čestice samo titraju oko središnjeg položaja ne napuštajući karakterističnu geometrijsku strukturu. Čvrsto se stanje označava, prema međunarodnom dogovoru, slovom (s).
Tekućine ili kapljevine
Tekućine/tekuće tvari nemaju stalan oblik, ali imaju stalan volumen. Poprimaju oblik posude u kojoj se nalaze. Slabo su stlačive. Udaljenost između čestica u tekućini je nešto veća nego u čvrstom stanju, a uređenost strukture je manja.
Čestice se relativno slobodno gibaju i mijenjaju položaj. Tekuće se stanje označava slovom (l).
Plinovi
Plinovite tvari nemaju stalan oblik ni stalan volumen. Plinovi poprimaju oblik posude u kojoj se nalaze.
Plinovi su stlačivi, volumen plina ovisi o tlaku i temperaturi. Udaljenost između čestica plinovitih tvari je velika. Plinovi nemaju uređenu strukturu. Položaj čestica brzo se mijenja u svim smjerovima u prostoru. Plinovito se stanje označava slovom (g).
Plazma
Plazma je ionizirani plin. Tvar u plazma-stanju dobro provodi električnu energiju i reagira na električno i magnetsko polje. Kao i u plinovitom agregacijskom stanju, tvar u plazma-stanju nema određen oblik ni volumen. Prvi je na znanstveni način plazmu opisao sir William Crookes 1879. godine nazvavši je materijom koja zrači, to jest četvrtim stanjem materije.
Voda u prirodi nalazi se u sva tri agregacijska stanja, kao led, voda i vodena para.
Kako na promjenu agregacijskog stanja vode utječe promjena temperature?
Promjene agregacijskih stanja pojedine tvari ovisi o vrsti tvari, tlaku i temperaturi.
Proučite grafikon koji prikazuje promjene agregacijskih stanja vode
pri 101 kPa.
Zagrijavanjem leda na 0 °C počinje taljenje leda. Daljnjim zagrijavanjem temperatura ne raste dok sav led ne prijeđe u vodu. Zagrijavanjem na 100 °C voda vrije. Temperatura se ne mijenja dok sva voda ne ispari.
Prijelazi između pojedinih agregacijskih stanja
Taljenje je prijelaz tvari iz čvrstog u tekuće agregacijsko stanje.
Isparavanje je prijelaz tekuće tvari u plinovitu.
Kondenzacija (ukapljivanje) je prijelaz plinovite tvari u tekuću.
Kristalizacija (skrućivanje) je prijelaz tekuće tvari u čvrstu.
∗Latentna ili skrivena toplina – toplina dovedena pri taljenju i isparavanju često se naziva skrivenom ili latentnom toplinom.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Fazni dijagram
Osim zagrijavanjem ili hlađenjem,
do promjene agregacijskog stanja dolazi i promjenom tlaka.
Ako je volumen stalan,
uspostavljanje ravnoteže između pojedinih agregacijskih stanja
ili faza nekog sustava pri određenom tlaku i temperaturi može se prikazati faznim dijagramom (p, T).
Fazni dijagram
Do promjene agregacijskog stanja, osim zagrijavanjem ili hlađenjem, dolazi i promjenom tlaka. Uz pretpostavku stalnog volumena uspostavljanje ravnoteže između pojedinih agregacijskih stanja ili faza nekog sustava pri određenom tlaku i temperaturi može se prikazati faznim dijagramom (p, T).
U trojnoj točki vode, T (273,16 K i 610,6 Pa),
postignuta je ravnoteža svih triju agregacijskih stanja vode.
Ta točka je jedinstvena.
Upotrebljava se kao druga stalna točka u definciji Kelvinove temperaturne skale.
Iznad kritične temperature
tvar se iz plinovitog agregacijskog stanja ne može ukapljiti snižavanjem tlaka.
Ta točka u faznom dijagramu je kritična točka.
Iznad odgovarajuće kritične temperature para i tekućina se ne mogu razlikovati.
U trojnoj točki vode, T (273,16 K i 610,6 Pa), postignuta je ravnoteža svih triju agregacijskih stanja vode.
Kako je ta točka jedinstvena, upotrebljava se kao druga stalna točka u definciji Kelvinove temperaturne skale.
Iznad kritične temperature tvar se iz plinovitog agregacijskog stanja ne može ukapljiti snižavanjem tlaka. Ta točka u faznom dijagramu je kritična točka. Iznad odgovarajuće kritične temperature para i tekućina se ne mogu razlikovati.
Više informacija o agregacijskim stanjima možete pronaći u jedinici 2.2 Agregacijska stanja u DOS-u Fizika 2.
Talište
Talište (temperatura taljenja), tt, je temperatura na kojoj se neka tvar tali. Iskazuje se °C ili K. Talište čistih tvari uz stalan tlak se ne mijenja.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za punjenje aparata za određivanje tališta tvari po Thileu najčešće se koristi parafinsko ulje. Provjerite prema podatcima vrelišta tvari koja od navedenih tvrdnja točno opisuje ovaj postupak.
Želite li pokušati ponovo?
Vrelište
Vrelište je temperatura vrenja, tv.
To je temperatura na kojoj je tlak pare tekućine jednak vanjskom tlaku.
Vrelište se iskazuje °C ili K, pri čemu je uvijek potrebno navesti i tlak.
Temperaturu na kojoj je tlak pare tekućine
jednak normalnom atmosferskom tlaku od 101 325 Pa nazivamo normalnim vrelištem.
Vrelište čiste vode pri normalnom atmosferskom tlaku je 100 °C.
Vrelište
Vrelište (temperatura vrenja), tv, je temperatura na kojoj je tlak pare tekućine jednak vanjskom tlaku. Vrelište se iskazuje °C ili K, pri čemu je uvijek potrebno navesti i tlak. Temperaturu na kojoj je tlak pare tekućine jednak normalnom atmosferskom tlaku od 101 325 Pa nazivamo normalnim vrelištem. Vrelište čiste vode pri normalnom atmosferskom tlaku je 100 °C.
Gustoća
Gustoća je definirana omjerom mase i volumena tvari pri određenoj temperaturi. Mjerna jedinica za gustoću u SI sustavu je: kg m-3, a u kemijskom računu češće rabimo: g cm-3, g L-1, g dm-3.
Mijenja li se gustoća tvari s porastom temperature?
Prema tabličnim podatcima napravite grafikon koji će prikazati promjenu gustoće žive ovisno o temperaturi. Na temelju dobivenog grafikona zaključite ovisi li gustoća tvari o temperaturi i kako.
Za izradu linijskog grafikona možete se poslužiti digitalnim alatom Meta-Chart.
| t/°C | 0 | 20 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|
| ρ /gcm–3 | 13,59 | 13,54 | 13,49 | 13,44 | 13,40 | 13,35 |
Topljivost
Mnoge tvari kao što su šećer i kuhinjska sol su topljive u vodi.
Koliko će se neke tvari u određenoj količini vode otopiti, ovisi o vrsti tvari i temperaturi.
Topljivost čvrstih tvari u vodi se iskazuje kao
masa otopljene tvari u 100 grama vode pri određenoj temperaturi.
Danas se sve češće topljivost iskazuje pomoću masenoga udjela
otopljene tvari u zasićenoj otopini pri određenoj temperaturi.
Topljivost
Za mnoge tvari kao što su šećer i kuhinjska sol znamo da su topljive u vodi. Koliko će se neke tvari u određenoj količini vode otopiti, osim o vrsti tvari ovisi i o temperaturi.
Topljivost čvrstih tvari u vodi često se iskazuje kao masa otopljene tvari u 100 grama vode pri određenoj temperaturi.
Danas se sve češće topljivost iskazuje pomoću masenoga udjela otopljene tvari u zasićenoj otopini pri određenoj temperaturi.
Kako se mijenja topljivost saharoze s povišenjem temperature?
Prema tabličnim podatcima napravite grafikon koji će prikazati promjenu topljivosti saharoze u vodi ovisno o temperaturi. Za izradu linijskog grafikona možete se poslužiti digitalnim alatom Meta-Chart.
Na temelju dobivenog grafikona odgovorite na sljedeća pitanja.
| t/°C | m(saharoze)/g |
|---|---|
| 20 | 66,718 |
| 25 | 67,470 |
| 30 | 68,289 |
| 35 | 69,168 |
| 40 | 70,104 |
| 45 | 71,008 |
| 50 | 72,115 |
| 55 | 73,176 |
| 60 | 74,263 |
| 65 | 75,367 |
| 70 | 76,478 |
| 75 | 77,585 |
| 80 | 78,677 |
Pitanja:
- Kako se s povišenjem temperature mijenja topljivost saharoze u vodi?
- Prema krivulji topljivosti zaključite koliko se saharoze može otopiti u 300 g vode na .
- Kakva smjesa nastaje ako se na u 100 g vode otopi 96 g saharoze?
- Topljivost šećera, , pri temperaturi od je 70,104 g . Izračunajte masu zasićene otopine saharoze pri navedenoj temperaturi.
- Izračunajte maseni udio saharoze u zasićenoj otopini pri .
Odgovori na pitanja:
- Topljivost saharoze u vodi raste s porastom temperature.
- Proučite grafikon kojeg ćete izraditi prema uputama za izradu grafikona i potom samostalno odgovorite na pitanje.
- Heterogena smjesa.
- U zasićenoj otopini saharoze pri otopljeno je 70,104 g saharoze u 100,000 g vode.
Zadano je:
Traži se:
Izradak:
- Maseni udio saharoze u zasićenoj otopini pri je 41,21 %.
Električna vodljivost
Metali provode električnu energiju zbog slobodnih elektrona, a vodene otopine i taline soli provode električnu energiju pomoću iona.
Toplinska vodljivost
Toplinska vodljivost je sposobnost tvari da provodi toplinu.
Najbolji vodiči topline su metali.
Najbolji izolatori topline su zrak, staklo, stiropor…
Magnetičnost
Željezo, kobalt, nikal i njihove legure privlače magnet.
To karakteristično svojstvo tvari naziva se magnetičnost.
Toplinska vodljivost
Toplinska vodljivost je sposobnost tvari da provodi toplinu. Najbolji vodiči topline su metali, a najbolji izolatori su zrak, staklo, stiropor i dr.
Magnetičnost
Željezo, kobalt, nikal, kao i njihove legure privlače magnet. To karakteristično svojstvo nazva se magnetičnost.
Tvrdoća
Tvrdoća je otpor kojim se tvar opire prodiranju druge tvari.
Mohsova skala tvrdoće minerala je ljestvica po kojoj se određuje i izražava tvrdoća pojedinih minerala.
Napravio ju je njemački mineralog Friedrich Mohs (1773. – 1839.)
Mohsovu skalu određuje otpornost na grebanje tvrđim mineralom.
Mohs je svoju ljestvicu temeljio na deset lako dostupnih minerala.
Mohsova skala tvrdoće minerala je ljestvica po kojoj se određuje i izražava tvrdoća pojedinih minerala. Napravio ju je njemački mineralog Friedrich Mohs (1773. – 1839.), a određena je otpornošću na grebanje tvrđim mineralom. Mohs je svoju ljestvicu temeljio na deset lako dostupnih minerala.
| Tvrdoća | Mineral | Prikaz |
|---|---|---|
| 1 |  |
|
| 2 |  |
|
| 3 |  |
|
| 4 |  |
|
| 5 |  |
|
| 6 |  |
|
| 7 |  |
|
| 8 |  |
|
| 9 |  |
|
| 10 |  |
Kemijska svojstva tvari
Kemijska svojstva tvari očituju se prilikom kemijskih promjena.
Pri kemijskoj promjeni dolazi do promjene tvari.
Pri tome se fizikalna i kemijska svojstva produkta reakcije
razlikuju od fizikalnih i kemijskih svojstava reaktanata.
Kemijskom reakcijom sumpora i željeza nastaje željezov(II) sulfid.
Fizikalna i kemijska svojstva željezova(II) sulfida
razlikuju se od svojstava željeza i sumpora.
Kemijska svojstva tvari
Kemijska svojstva tvari očituju se prilikom kemijskih promjena. Pri kemijskoj promjeni dolazi do promjene tvari, pri čemu se fizikalna i kemijska svojstva produkta reakcije razlikuju od fizikalnih i kemijskih svojstava reaktanata.
Kemijskom reakcijom sumpora i željeza nastaje željezov(II) sulfid. Fizikalna i kemijska svojstva željezova(II) sulfida razlikuju se od svojstava željeza i sumpora.
Na kraju…
Prije nego li započnete rješavati zadatak Kako odrediti gustoću metala?, možete ponoviti sadržaj u jedinici 1.6 Određivanje gustoće u DOS-u Fizika 7.
Kako odrediti gustoću metala?
U sljedećem zadatku odredite gustoću bakra, aluminija i olova.
Korak 1.
Izvažite metalne grumene i upišite njihove mase u tablicu.
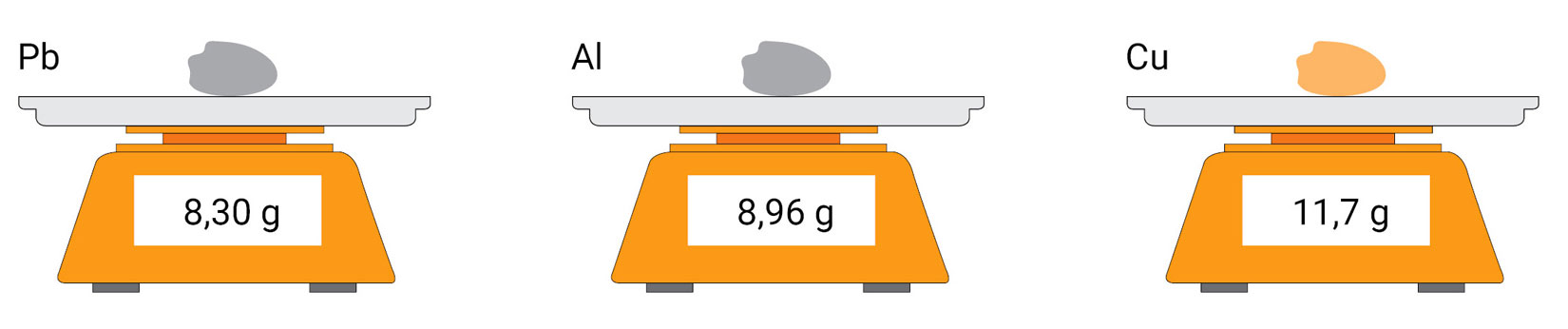
Napomena: Prepišite zadanu tablicu u bilježnicu i popunite ju traženim vrijednostima.
| Pb | Al | Cu | |
|---|---|---|---|
| m/g | |||
| 20 | 20 | 20 | |
| (literaturna gustoća) | 11,3 | 2,70 | 8,94 |
| relativna pogreška mjerenja, P |
Korak 2.
Ulijte u menzuru 15 do 20 mL vode, očitajte volumen i upišite u tablicu.
Korak 3.
Ubacite metal u menzuru, očitajte volumen metala i vode i upišite u tablicu.

Korak 4.
Iz razlike volumena V2 i V1 upišite u tablicu volumen metala V3.
Korak 5.
Iz dobivenih podataka izračunajte gustoću metala i upišite podatke u tablicu.
Korak 6.
Prema sljedećoj formuli izračunajte iz izračunate gustoće i literaturne gustoće relativnu pogrešku mjerenja.
Gdje je:
P – relativna pogreška mjerenja
ρE – eksperimentalno određena gustoća
ρL – literaturna gustoća
Odgovorite na pitanje:
Na temelju dobivenih rezultata zaključite ovisi li gustoća metala o masi uzorka.
Odgovor:
Gustoća metala ne ovisi o masi uzorka. Izvažemo li pločicu od 3,0 g olova ili 30 g olova, istisnuti volumen vode će se razlikovati, a gustoća olova će uvijek biti ista. Prema tome, gustoća je intenzivno svojstvo.
Riješite zadatak:
- Aluminijska folija za domaćinstvo duljine je 14 m i širine 30 cm. Kolika je njezina debljina ako joj masa iznosi 114 g? Gustoća aluminija je 2700 kg/m3.
Odgovor na pitanje:
- Debljina aluminijske folije iznosi 0,1 mm.









