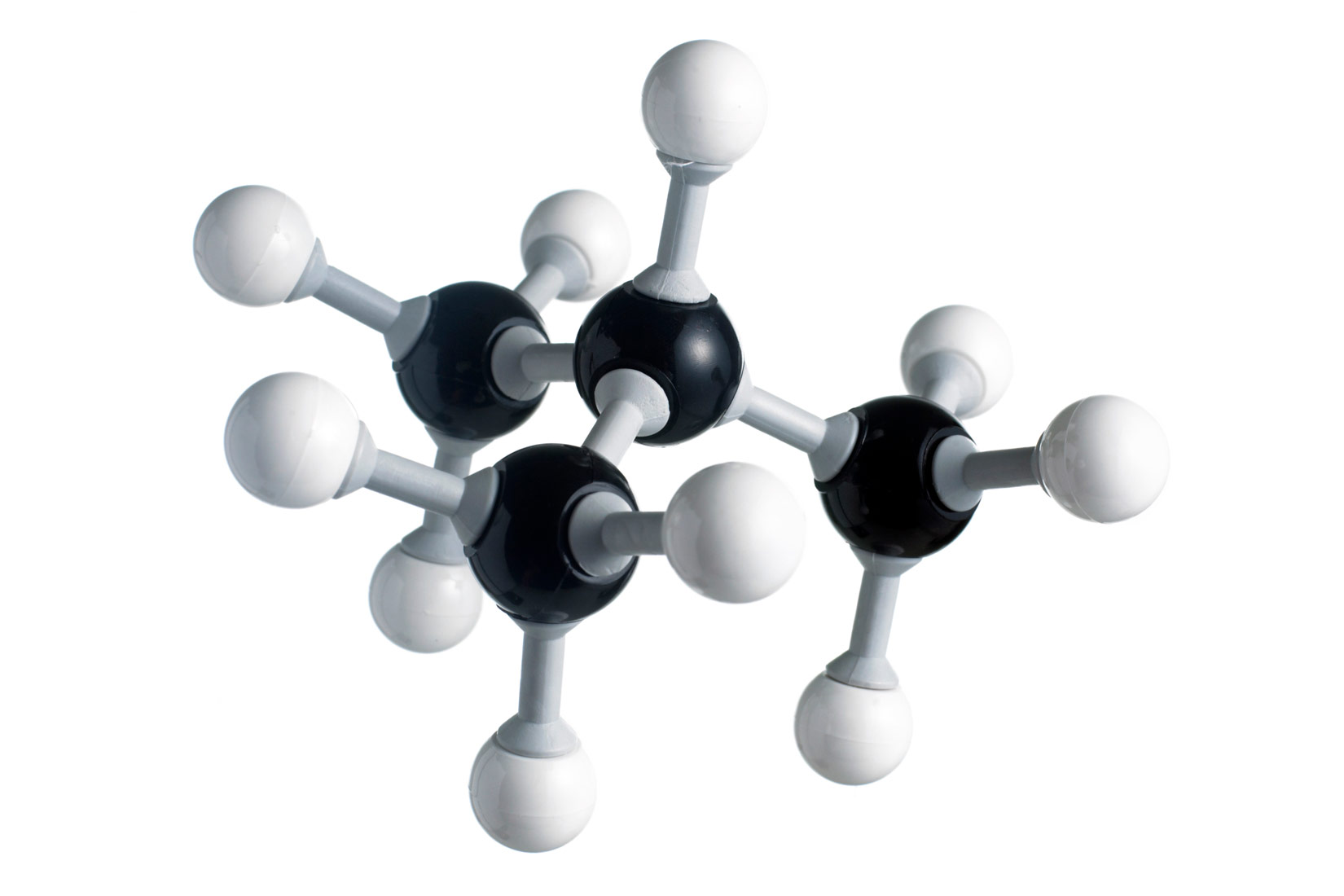
Zasićeni ugljikovodici – alkani
- navesti valenciju ugljika i vodika te na temelju toga objasniti povezivanja ugljikovih atoma u molekule ravne lančane strukture, razgranate lance i prstenaste strukture
- povezati pojam zasićenosti ugljikovodika s prisutnošću jednostrukih veza između atoma ugljika
- razlikovati strukturne i molekulske formule
- napisati primjer jednadžbe kemijske reakcije supstitucije
- napisati primjer jednadžbe kemijske reakcije gorenja alkana uz dovoljnu i uz nedovoljnu količinu kisika.
Uvod
Početkom 19. stoljeća velik je broj rudara stradao u rudnicima ugljena zbog podzemne eksplozije metana. Eksplozija je najčešće nastajala zbog svjetiljki koje su rudari tada koristili jer su svjetiljke imale otvoreni plamen. Kako se metan nije mogao namirisati, rudari su radi otkrivanja metana u rudnike nosili krletke s kanarincima, ali od toga nije bilo puno koristi.
Humphry Davy konstruirao je sigurnosnu svjetiljku koja je rudarima omogućila sigurniji rad pod zemljom. Davy-eva rudarska sigurnosna svjetiljka sadrži cilindar od tanke žičane mrežice koja spriječava eksploziju. Davy je svoj izum poklonio rudarima i odbio ga je patentirati.
Ugljikovodici su najjednostavniji organski spojevi – sastoje se samo od atoma ugljika i vodika.
Vodik je jednovalentan, što znači da se njegov atom spaja samo s jednim atomom drugog elementa.
Ugljik može imati dvije vrste valencija: (II) i (IV), što znači da se atom ugljika spaja s 2 ili 4 atoma vodika.
Ugljikovodici su najjednostavniji organski spojevi. Sastoje se samo od atoma ugljika i vodika. Vodik je jednovalentan, a ugljik može imati dvije valencije, (II) ili (IV), ovisno o spoju u kojemu se nalazi. U organskim spojevima ugljik je uvijek četverovalentan.
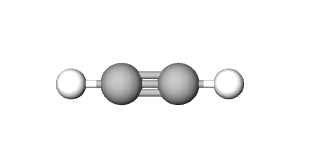
Ugljikovi atomi mogu između sebe ostvariti jednostruku, dvostruku ili trostruku vezu.
Njihove molekule mogu imati oblik lanca (ravnolančane) ili prstena (cikličke).
Ovisno o načinu međusobnog spajanja ugljikovih atoma, razlikujemo nekoliko skupina ugljikovodika:
Osim toga, vrlo zanimljiv dio organske kemije jest mogućnost povezivanja ugljikovih atoma na različite načine. Ugljikovi atomi mogu između sebe ostvariti jednostruku, dvostruku ili trostruku vezu. Molekule ugljikovodika mogu biti ravnolančane ili cikličke. Ovisno o načinu međusobnog spajanja ugljikovih atoma, razlikujemo nekoliko skupina ugljikovodika:
| zasićeni | nezasićeni | ||||
|---|---|---|---|---|---|
| ALKANI | CIKLOALKANI | ALKENI | ALKINI | ARENI | |
| primjer | 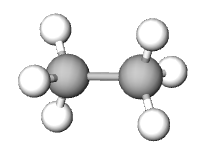 |
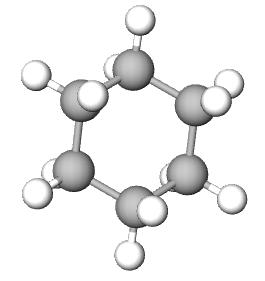 |
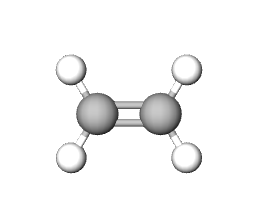 |
 |
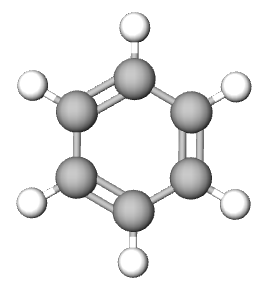 |
| ime spoja | etan | cikloheksan | eten | etin | benzen |
Zasićeni ugljikovodici – ALKANI
Skupina ugljikovodika koji između atoma ugljika imaju samo jednostruku vezu pripada zasićenim ugljikovodicima alkanima. Zanimljivo je da je oko jednostruke veze moguća rotacija skupine atoma koje su vezane za te ugljikove atome.
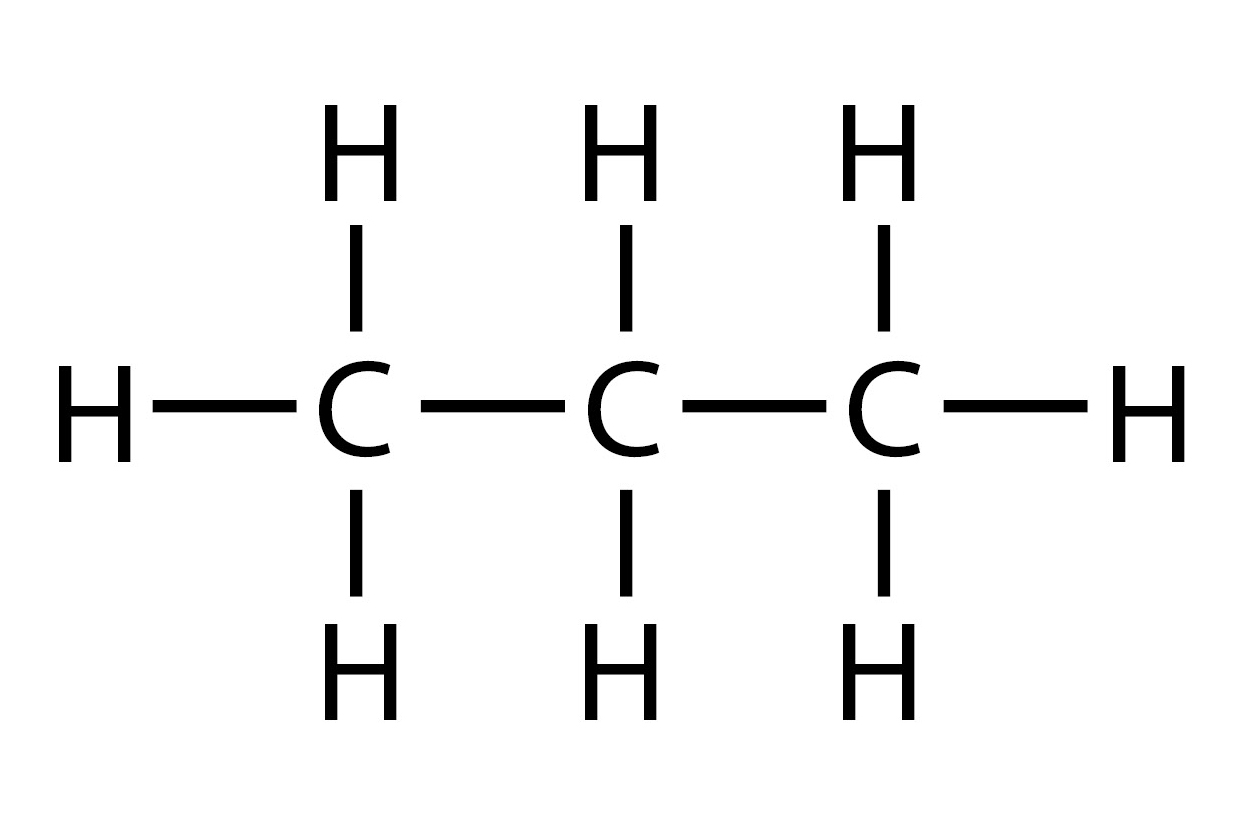
Najmanji alkan, metan, , sadrži samo jedan ugljik i četiri vodika. Svaki se alkan od prethodnog razlikuje za jedan atom ugljika i dva atoma vodika. Stoga je moguće sastav ugljikovodika alkana prikazati općom molekulskom formulom:
.
Pri tome n označava broj atoma ugljika u molekuli.
Poredani u pravilan redoslijed prema broju ugljikovih atoma, alkani čine homologni niz.
| redni broj u homolognom nizu |
ime | molekulska formula |
|---|---|---|
| 1. | METAN | |
| 2. | ETAN | |
| 3. | PROPAN | |
| 4. | BUTAN | |
| 5. | PENTAN | |
| 6. | HEKSAN | |
| 7. | HEPTAN | |
| 8. | OKTAN | |
| 9. | NONAN | |
| 10. | DEKAN |
Primjećuje se da svi nazivi spojeva završavaju nastavkom -AN. Taj nastavak označava zasićene ugljikovodike alkane. Nazivi prvih četiriju spojeva u homolognom nizu povijesna su imena. Svi ostali nazivi tvoreni su tako što je korijenu grčke riječi za broj dodan nastavak -AN.
Prva su četiri alkana plinovi. Alkani od petog do sedamnaestog člana u homolognom nizu su tekućine, dok su alkani s osamnaest i više ugljikovih atoma čvrste tvari.
Koristeći opću molekulsku formulu alkana, izračunajte molekulsku formulu ugljikovodika koji ima:
a) petnaest atoma ugljika
b) pedeset i dva atoma vodika.
Rješenje:
a)
b)
Osim molekulskom formulom, ugljikovodike možemo prikazivati na još nekoliko načina:
- strukturnom formulom – prikazani su simbolom svi atomi i sve veze između njih
- sažetom strukturnom formulom – prikazan je samo redoslijed vezanja ugljikovih atoma
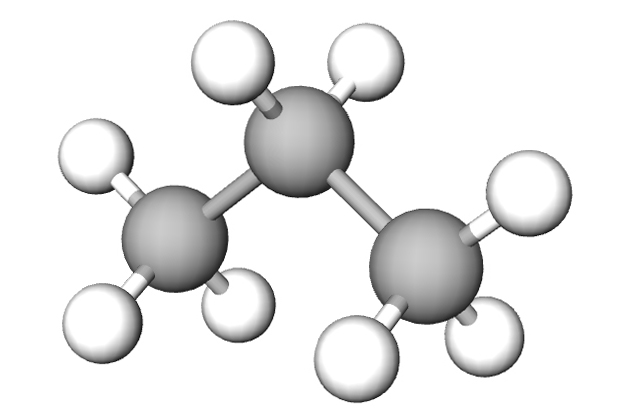
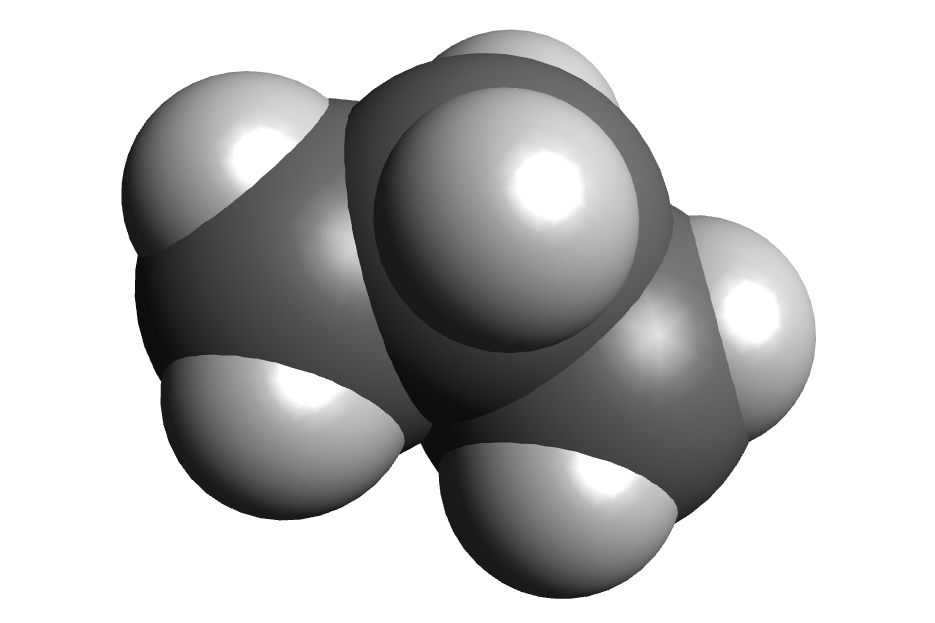
- kalotnim modelima – prikazan je oblik molekule u prostoru
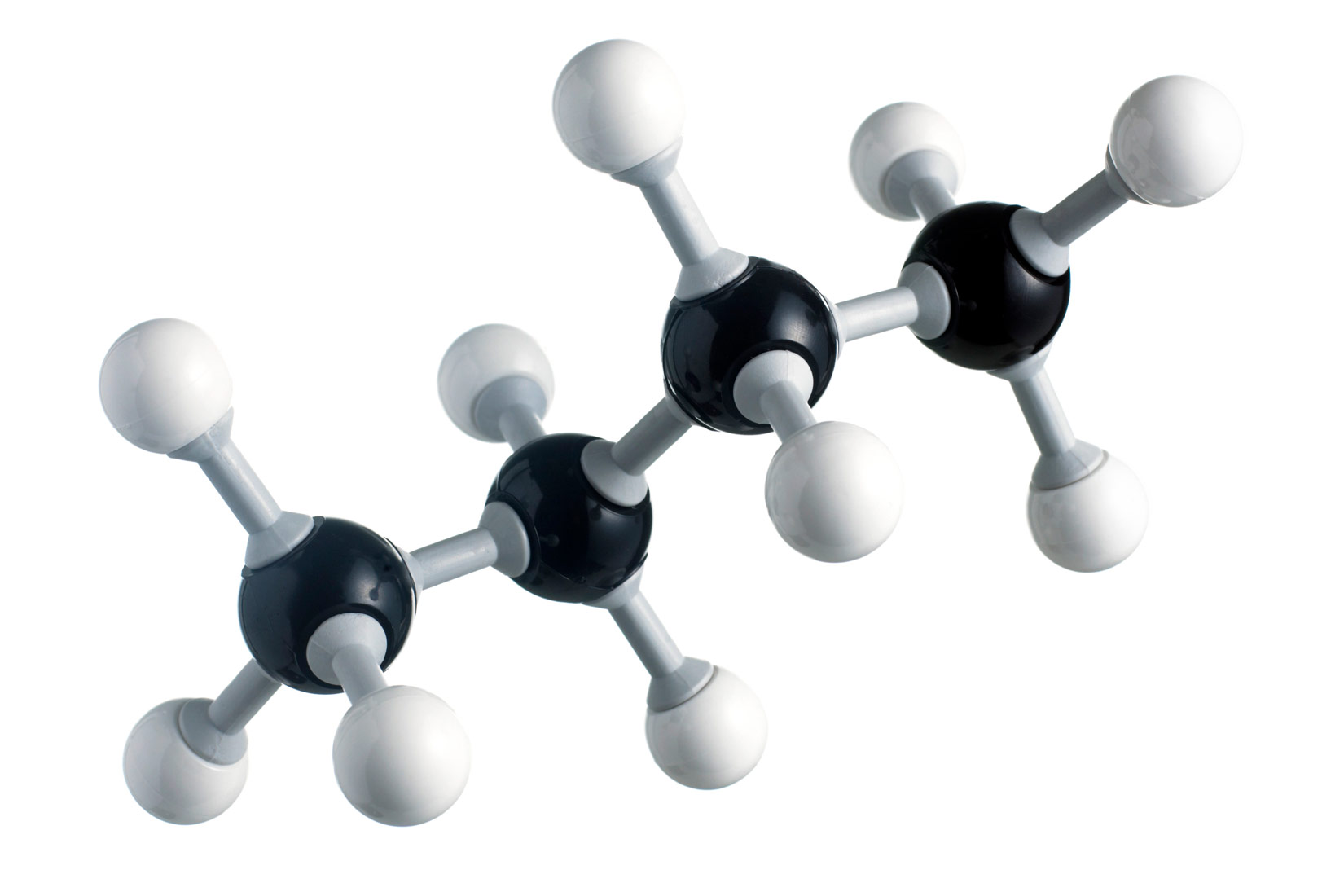
- modelima sastavljenim od kuglica i štapića – prikazan je prostorni razmještaj atoma u molekuli.
Valja znati!
- Smjesa plinovitog alkana i zraka je eksplozivna.
- Smjesa propana i butana koristi se u industriji i kućanstvu za grijanje i kuhanje. Osim te smjese plinova, u kućanstvima se za iste svrhe koristi i metan.
- Uz to što je u sastavu zemnog plina, metan nastaje i u močvarama, barama, odlagalištima otpada i rudnicima u uvjetima bez kisika i uz prisutnost mikrooganizama.
Miješa li se heksan s vodom? Pogledajte videozapis i zaključite sami!
Strukturni izomeri
Strukturni izomeri spojevi su iste molekulske formule, ali različite strukturne formule. Zbog različite strukture strukturni izomeri imaju različita fizikalna svojstva, primjerice vrelište.
U homolognom nizu alkana prva tri člana mogu se prikazati samo jednom strukturnom formulom. Butan ima dva izomera, stoga se može prikazati na dva načina, kao ravna lančana molekula i kao razgranata lančana molekula.
U homolognom nizu alkana metan, etan i propan mogu se prikazati samo jednom strukturnom formulom.
Butan se može prikazati na dva načina: kao ravna lančana molekula i kao razgranata lančana molekula.
Pentan se može prikazati na tri načina, a heksan na pet načina.
Što je veći broj ugljika u molekuli, na više se načina može prikazati strukturnom formulom.
Pentan se može prikazati na tri načina, heksan na pet načina i tako dalje. Što je veći broj ugljika u molekuli – spoj ima veći broj izomera.
Imenovanje razgranatih ugljikovodika
- Određuje se najdulji lanac ugljika u molekuli i prema njemu se izvodi ime spoja.
- Atomima ugljika pridružuje se broj (prvi, drugi, treći itd.).
- Određuje se i imenuje ogranak (radikal ili supstituent) te njegov položaj u molekuli.
Primjer 3.1.
Radeći u skupinama, nacrtajte modele pet mogućih izomera molekule heksana, , i imenujte ih. Pri tome se možete poslužiti i programom za modeliranje MolView.
Zasićeni ugljikovodici – CIKLOALKANI
Zasićeni ugljikovodici mogu imati i prstenastu strukturu.
Grčka riječ za krug jest kyklos pa te ugljikovodike nazivamo cikloalkani.
Najmanji cikloalkan ima tri ugljikova atoma, ali je najstabilniji spoj sa šest ugljika u prstenu.
Opća formula cikloalkana jest (CH2)2.
Zasićeni ugljikovodici – CIKLOALKANI
Zasićeni ugljikovodici prstenaste strukture pripadaju skupini cikloalkana (grč. kyklos – krug).
Najmanji cikloalkan ima u svojem sastavu tri ugljikova atoma i to je ciklopropan. Najstabilniji cikloalkan spoj je sa šest atoma ugljika u prstenu. U šesterokutu su kutovi između ugljikovih atoma 60°, dok se vodikovi atomi nalaze na međusobno najvećoj mogućoj udaljenosti, što odgovara tetraedarskom kutu od 109,5°.
Homologni niz cikloalkana počinje ciklopropanom, a opća formula cikloalkana jest .
Karakteristične kemijske reakcije alkana
Alkani su kemijski vrlo postojani (inertni).
Poznati reagens za ispitivanje zasićenosti ugljikovodika jest vodena otopina kalijeva permanganata koja je purpurne boje.
U dodiru sa zasićenim ugljikovodicima ta se boja tijekom reakcije ne mijenja.
U dodiru s nezasićenima ugljikovodicima boja reakcijske smjese iz purpurne se mijenja u bezbojnu.
Ostale kemijske reakcije alkana su gorenje (oksidacija) i supstitucija.
Gorenje alkana može se odvijati pri dovoljnoj i nedovoljnoj količini kisika.
Jednadžba kemijske reakcije potpuna gorenja metana – uz dovoljno kisika:
alkan oksidira → ugljikov dioksid i voda
Jednadžba kemijske reakcije nepotpuna gorenja metana – uz nedovoljno kisika:
alkan oksidira → ugljikov monoksid i voda
Karakteristične kemijske reakcije alkana
Alkani su kemijski vrlo postojani (inertni). Poznati reagens za ispitivanje zasićenosti ugljikovodika jest vodena otopina kalijeva permanganata koja je purpurne boje. U dodiru sa zasićenim ugljikovodicima ta se boja tijekom reakcije ne mijenja. U dodiru s nezasićenima ugljikovodicima boja reakcijske smjese iz purpurne se mijenja u bezbojnu.
Za alkane su još karakteristične kemijske reakcije gorenje (oksidacija) i supstitucija.
Gorenja alkana može se odvijati uz dovoljnu ili nedovoljnu količinu kisika. U slučaju dovoljne količine kisika alkan oksidira do ugljikova dioksida i vode. Ako kisika nije bilo dovoljno, produkti su gorenja ugljikov monoksid i voda.
Primjer jednadžbe kemijske reakcije potpuna gorenja metana:
.
Primjer jednadžbe kemijske reakcije nepotpuna gorenja metana:
.
Napišite jednadžbu kemijske reakcije gorenja heksana pri dovoljnoj količini kisika. Pri tome možete koristiti alat Pisanje kemijskih jednadžbi na webu.
Supstitucija je vrsta kemijske reakcije u kojoj dolazi do zamjene jednog ili više atoma vodika drugim atomima ili atomskim grupama.
Primjer jednadžbe kemijske reakcije metana i klora (supstitucija svih atoma vodika u metanu):
metan + klor → tetraklormetan
Tetraklormetan, , poznato je organsko otapalo, tekućina karakteristična mirisa, bezbojna i lako hlapljiva.
Supstitucija je vrsta kemijske reakcije u kojoj dolazi do zamjene jednog ili više atoma vodika drugim atomima ili atomskim grupama. Za primjer uzmimo halogeniranje metana.
Primjer jednadžbe kemijske reakcije metana i klora (supstitucija svih atoma vodika u metanu):
.
Tetraklormetan, , rabi se kao organsko otapalo. To je tekućina svojstvenog mirisa, bezbojna i lako hlapljiva. Danas se njegova uporaba ne preporuča – njegove pare, ako se dulje udišu, mogu izazvati teška oboljenja.
Klorovi derivati metana

Parafini
Zbog kemijske inertnosti alkani se nazivaju još i parafini. Istražite na stručnim mrežnim stranicama ili u dodatnoj literaturi što se još zove parafin.
Na kraju…
Primjenite znanje i riješite sljedeće interaktivne zadatke!
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izbaci uljeza:
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
propan
C6H14
metan
C2H6
etan
CH4
heksan
C3H8
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Odaberi dva točna odgovora.
Metan:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Među ugljikovodicima s istim brojem atoma najniže vrelište ima onaj koji je najviše razgranat. Izomer butana s najnižim vrelištem jest:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izbacite uljeza.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Maseni udio ugljika u molekuli pentana jest:
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Metan (dva su odgovora točna):
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Spojite naziv s odgovarajućom formulom.
propan
2-metilpentan
etan
heksan
Želite li pokušati ponovo?