Čimbenici koji utječu na pomak kemijske ravnoteže
- objasniti Le Chatelierovo načelo
- objasniti važnost razlikovanja početne i ravnotežne koncentracije sudionika reakcije
- objasniti utjecaj promjene temperature, tlaka i koncentracije na ravnotežno stanje kemijskoga sustava
Uvod
Poznavanje vrijednosti konstante ravnoteže (Kc) kemijskih reakcija i čimbenike kojima možemo mijenjati ravnotežno stanje sustava, omogućava nam veće (>) iskorištenje reakcije.
Uvod
Poznavanje vrijednosti konstante ravnoteže kemijskih reakcija i čimbenike kojima možemo mijenjati ravnotežno stanje sustava, omogućava nam veće iskorištenje reakcije.
Čimbenici koji utječu na pomak kemijske ravnoteže
Pomak kemijske ravnoteže je važan u industriji i biokemiji.
Naročito je važan kada je poželjno za neku reakciju da napreduje do kraja.
Na položaj ravnoteže može se djelovati promjenom:
a) koncentracije (c),
b) tlaka (p)
c) temperature (t).
Čimbenici koji utječu na pomak kemijske ravnoteže
Pomak kemijske ravnoteže je važan u industriji i biokemiji i to naročito kada je poželjno za neku reakciju da napreduje do kraja. Na položaj ravnoteže može se djelovati promjenom koncentracije, tlaka i temperature.
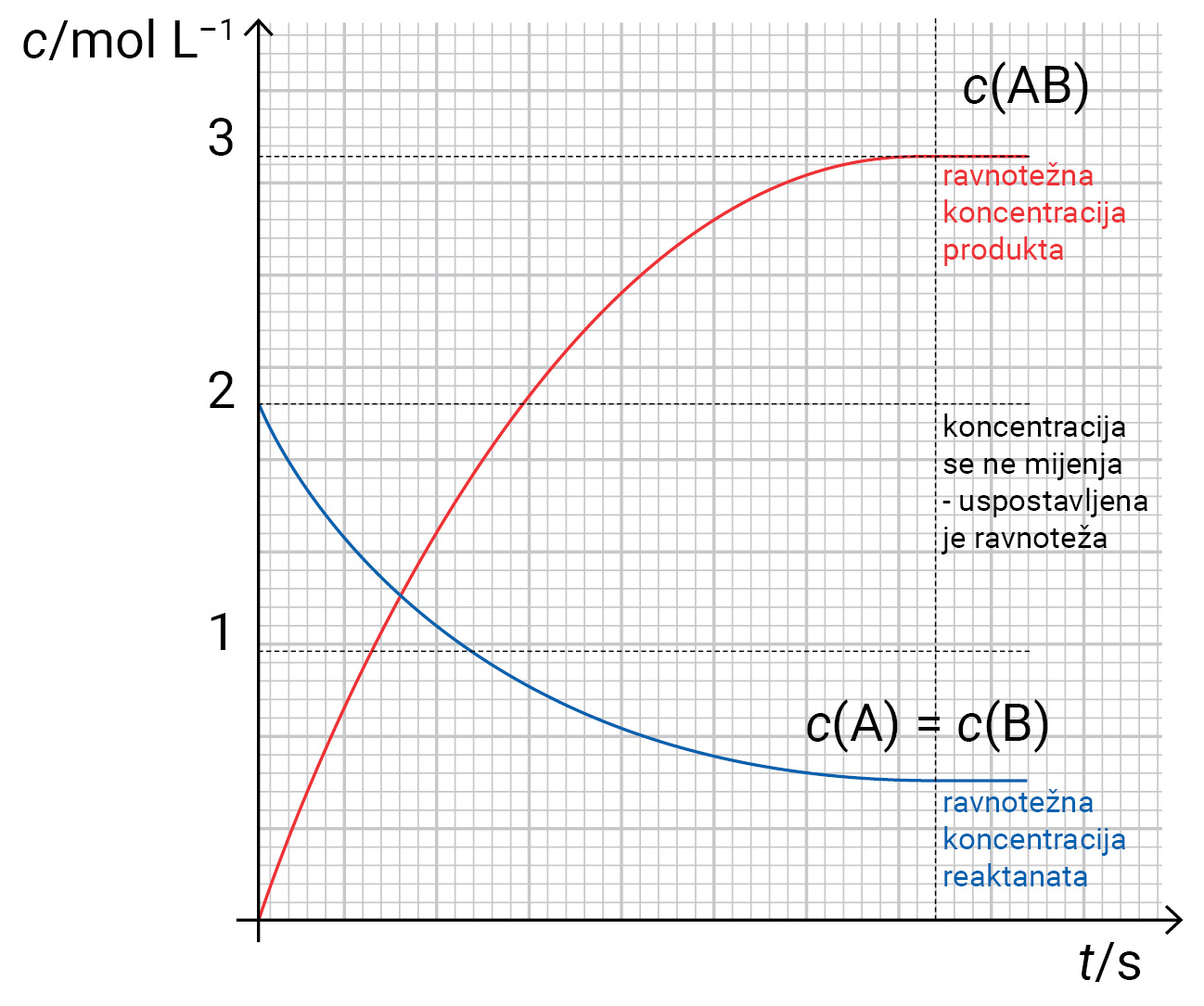
Dijagram prikazuje promjenu koncentracije (c) reaktanata i produkta u ovisnosti o vremenu i postizanje ravnotežnih koncentracija koje su eksperimentalno određene pri nekoj temperaturi za reakciju
.
Ako se promijeni jedan od uvjeta pri kojima se sustav nalazi u stanju kemijske ravnoteže onda će pomak ravnoteže biti u smjeru one reakcije koja:
- teži da se suprostavi toj promjeni
- teži da se uspostave prethodni uvjeti.
Ova zakonitost poznata je pod nazivom kao Le Chatelierovo načelo.
Kako na pomak kemijske ravnoteže utječe promjena koncentracije reaktanata ili produkata
Pogledajte animaciju i odgovorite na sljedeća pitanja.
Dijagram prikazuje promjenu koncentracije reaktanata i produkta u ovisnosti o vremenu i postizanje ravnotežnih koncentracija koje su eksperimentalno određene pri nekoj temperaturi za reakciju:
.
Ako se promijeni jedan od uvjeta pri kojima se sustav nalazi u stanju kemijske ravnoteže onda će pomak ravnoteže biti u smjeru one reakcije koja teži da se suprostavi toj promjeni i da se uspostave prethodni uvjeti. Ova zakonitost poznata je pod nazivom kao Le Chatelierovo načelo.
Kako na pomak kemijske ravnoteže utječe promjena koncentracije reaktanata ili produkata
1. Dodatkom klorovodične kiseline (HCl) u ružičastu otopinu [Co(H2O)6]2+, poveća se koncentracija Cl– iona.
Ravnoteža reakcije se pomiče u smjeru nastajanja CoCl42– i vode (H2O).
1. Dodavanjem klorovodične kiseline u ružičastu otopinu (aq), povećava se koncentracija (aq) iona. Ravnoteža reakcije se pomiče u smjeru nastajanja (aq) i vode.
2. Dodavanjem vode u istu otopinu, ravnoteža se pomiče u smjeru reaktanata.
Otopina opet poprima ružičastu boju.
Jednadžba kemijske reakcije
[Co(H2O)6]2+ (aq) + 4Cl– (aq) ⇌ [CoCl4]2- (aq) + 6H2O (l)
2. Dodavanjem vode u istu otopinu, ravnoteža se pomiče u smjeru reaktanata i otopina ponovno poprima ružičastu boju.
Jednadžba kemijske reakcije:
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
S povećanjem koncentracije (c) reaktanata ili uklanjanjem produkta iz reakcijske smjese, ravnoteža se pomiče u smjeru stvaranja produkata.
Pomak ravnoteže u smjeru reaktanata u nekoj reakcijskoj smjesi postiže se suprotnim djelovanjem tj. smanjenjem koncentracije reaktanata ili povećanjem koncentracije produkata.
Kako temperatura utječe na pomak kemijske ravnoteže
S povećanjem koncentracije reaktanata ili uklanjanjem produkta iz reakcijske smjese, ravnoteža se pomiče u smjeru stvaranja produkata. Pomak ravnoteže u smjeru reaktanata u nekoj reakcijskoj smjesi postiže se suprotnim djelovanjem tj. smanjenjem koncentracije reaktanata ili povećanjem koncentracije produkata.
Kako temperatura utječe na pomak kemijske ravnoteže
Na sobnoj temperaturi kompleksni kobaltovi (II) i kloridni ioni su u ravnoteži.
Ako se vodenoj otopini kobaltova (II) klorida (otopina ružičaste boje) dodaju kloridni ioni u suvišku (klorovodična kiselina, , ili natrijev klorid, ), dio molekula vode vezanih na kobaltove (II) ione se zamijene kloridnim ionima.
Ravnotežna smjesa je ljubičaste boje.
Zagrijavanjem te smjese nastaje heksaklorokobaltatni (II) ion.
Otopina je plave boje.
Hlađenjem nastaje heksaakvakobaltov (II) ion, a otopina je ružičasta.
Kako će na pomak ravnoteže u nekom reakcijskom sustavu utjecati promjena temperature ovisi je li to egzotermna ili endotermna reakcija.
Ako je reakcija egzotermna, hlađenjem se ravnoteža pomiče prema produktima.
Zagrijavanjem egzotermne reakcije, ravnoteža se pomiče prema reaktantima.
Za endotermne reakcije vrijedi obrnuto.
Grijanjem se ravnoteža pomiče prema produktima.
Hlađenjem se ravnoteža pomiče prema reaktantima.
U obje vrste reakcija promjenom temperature dolazi do promjene vrijednosti konstante ravnoteže, Kc
Na sobnoj temperaturi kompleksni kobaltovi(II) i kloridni ioni su u ravnoteži. Ako se vodenoj otopini kobaltova(II) klorida (otopina ružičaste boje) dodaju kloridni ioni u suvišku (klorovodična kiselina ili natrijev klorid), dio molekula vode vezanih na kobaltove(II) ione se zamijene kloridnim ionima i ravnotežna smjesa je ljubičaste boje. Zagrijavanjem te smjese nastaje heksaklorokobaltatni(II) ion, a otopina je plave boje. Hlađenjem nastaje heksaakvakobaltov(II) ion, a otopina je ružičasta.
Kako će na pomak ravnoteže u nekom reakcijskom sustavu utjecati promjena temperature, ovisi je li to egzotermna ili endotermna reakcija.
Ako je reakcija egzotermna, hlađenjem se ravnoteža reakcije pomiče prema produktima, dok se zagrijavanjem egzotermne reakcije ravnoteža pomiče prema reaktantima.
Za endotermne reakcije vrijedi obrnuto. grijanjem se ravnoteža pomiče prema produktima, a hlađenjem prema reaktantima.
U obje vrste reakcija promjenom temperature dolazi do promjene vrijednosti konstante ravnoteže, Kc.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Kako tlak utječe na pomak kemijske ravnoteže
Pogledajte animaciju.
Odgovorite na sljedeća pitanja.
Kako tlak utječe na pomak kemijske ravnoteže
Pogledajte animaciju i odgovorite na sljedeća pitanja.
Animacija prikazuje promjenu kemijske ravnoteže (Kc) u smjesi plinova dušikova dioksida (NO2,g) i didušikov tetroksid (N2O4,g).
Promjenom volumena (V) dolazi do promjene tlaka (p) pri čemu se mijenja sastav ravnotežne smjese.
Jednadžba kemijske reakcije:
2NO2 (g) ⇌ N2O4 (g) ΔrH < 0
Animacija prikazuje promjenu kemijske ravnoteže u smjesi plinova (g) i (g).
Promjenom volumena dolazi do promjene tlaka pri čemu se mijenja sastav ravnotežne smjese.
Jednadžba kemijske reakcije:
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Promjena tlaka (p) utječe na pomak ravnoteže u reakcijskoj smjesi plinova.
S povećanjem ukupnog tlaka (p) u plinovitoj reakcijskoj smjesi ravnoteža se pomiče u smjeru koji dovodi do smanjenja broja molekula.
Sa smanjenjem tlaka (p) ravnoteža se pomiče u smjeru koji dovodi do povećanja broja molekula.
Promjena tlaka tlaka (p) ne utječe na pomak ravnoteže kada je broj molekula reaktanata jednak (=) broju molekula produkata.
Promjena tlaka utječe na pomak ravnoteže u reakcijskoj smjesi plinova.
S povećanjem ukupnog tlaka u plinovitoj reakcijskoj smjesi ravnoteža se pomiče u smjeru koji dovodi do smanjenja broja molekula.
Sa smanjenjem tlaka ravnoteža se pomiče u smjeru koji dovodi do povećanja broja molekula.
Promjena tlaka ne utječe na pomak ravnoteže kada je broj molekula reaktanata jednak broju molekula produkata.
Kakva je uloga katalizatora na položaj ravnoteže i konstantu ravnoteže?
Katalizatori ne utječu na položaj ravnoteže.
To znači da ne utječu ni na vrijednost konstante ravnoteže (Kc).
Naime, dodanim katalizatorom pokreće se jedna druga reakcija s manjom (<) energijom aktivacije (Ea) kod koje je ubrzan proces uspostavljanja ravnoteže.
Na kraju…
Kakva je uloga katalizatora na položaj ravnoteže i konstantu ravnoteže?
Katalizatori ne utječu na položaj ravnoteže, što znači da niti ne utječu na vrijednost konstante ravnoteže. Naime, dodanim katalizatorom pokreće se jedna druga reakcija s manjom energijom aktivacije kod koje je ubrzan proces uspostavljanja ravnoteže.
Na kraju…
Rješavanjem interaktivnog zadataka, usustavite pojmove obrađene u ovoj jedinici DOS-a te potom riješite i interaktivni kviz.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za jednadžbu ravnotežne kemijske reakcije:
tlačna konstanta ravnoteže je :
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite točnu izjavu:
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Za navedenu reakciju
vrijedi:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za jednadžbu ravnotežne kemijske reakcije:
tlačna konstanta ravnoteže je :
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite točnu izjavu:
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Za navedenu reakciju
vrijedi:
Želite li pokušati ponovo?
Procijenite (dakle bez uporabe kalkulatora) je li ravnotežna konstanta za reakciju sinteze vodika i joda u jodovodik manja ili veća od 50, ako je poznata vrijednost konstante ravnoteže pri 490 °C za sljedeću reakciju:
Ravnotežna konstanta za reakciju sinteze vodika i joda u jodovodik je ______ (manja/veća).
Odgovor:
Poznato je da je vrijednost konstante ravnoteže tražene reakcije jednaka recipročnoj vrijednosti konstante ravnoteže zadane reakcije.
Tada se može lako procijeniti da je , a budući da je nazivnik veći od 2 (t.j. 2,2), rezultat će biti manji od 50.



![Promjena ravnoteže u otopinama \(\ce{[Co(H2O)6]Cl2}\) pri zagrijavanju (lijevo) i hlađenju (desno).](../../../content/uploads/kemija-2/m03/j04/C0194826-Cobalt_chloride_equilibrium.jpg?v=20180727)