Usustavljivanje gradiva o energiji i kemijskim promjenama
- izračunati reakcijsku entalpiju na temelju promjene entalpije tijekom kemijske reakcije i množine utrošenog reaktanta/nastalog produkta
- prikazati entalpijskim dijagramom odnose entalpija reaktanata i produkata te smjer reakcijske promjene
- povezati potencijalnu i kinetičku energiju čestica s unutarnjom energijom sustava.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Oznakama za standardne entalpije pridružite pojam.
entalpija isparavanja
entalpija taljenja
entalpija kondenzacije
entalpija kristalizacije
entalpija sublimacije
reakcijska entalpija
entalpija nastajanja elementarnih tvari
entalpija izgaranja
Želite li pokušati ponovo?
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Fizikalnim veličinama pridružite odgovarajuću mjernu jedinicu.
c
J
C
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Riješeni primjer 1.
Izračunajte koliko je topline potrebno da se komad leda mase 55,5 g na temperaturi od –5,00 °C prevede u vodenu paru temperature 115 °C.
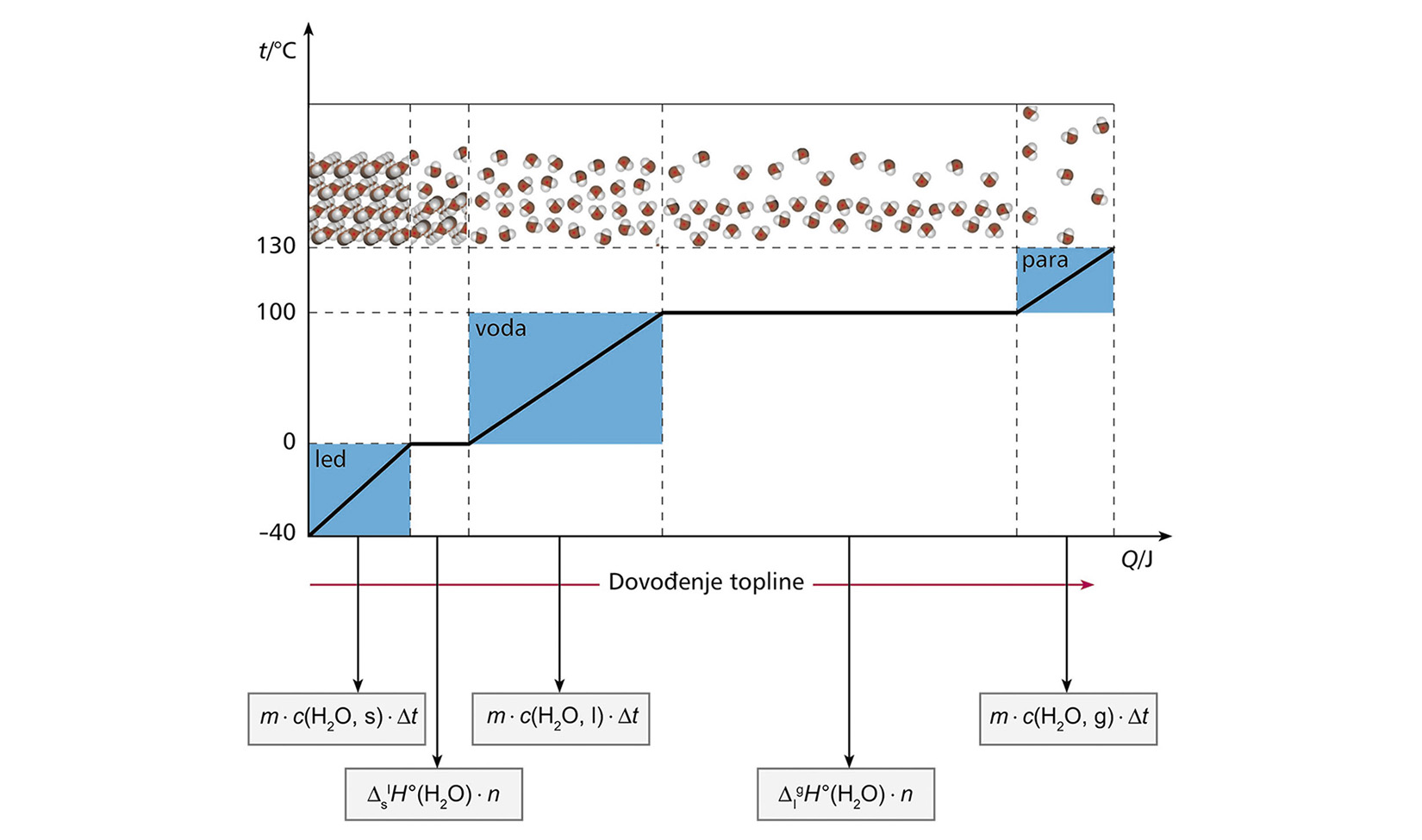
Zadano je:
m (led) = 55,5 g
t(led) = –5,00 °C
t(para) = 115 °C
Traži se:
Q = ?
Korak 1.
Korak 2.
Korak 3.
Korak 4.
Korak 5.
Korak 6.
Korak 7.
(Rezultat je iskazan na tri značajne znamenke.)
Odgovor:
Da se komad leda mase 55,5 g pri temperaturi –5 °C prevede u vodenu paru na temperaturu 115 °C, potrebno je dovesti toplinu od 169 kJ.
Riješeni primjer 2.
Izračunajte masu butana koja će potpunim izgaranjem osloboditi toplinu od 169 kJ, toplinu potrebnu da se komad leda mase 55,5 g na temperaturi od –5,00 °C prevede u vodenu paru temperature 115 °C.
Zadano je:
m (led) = 55,5 g
t(led) = –5,00 °C
t(para) = 115 °C
Q = 169 kJ
Traži se:
m (C4H10) = ?
Korak 1.
Izgaranjem dva mola butana oslobodit će se toplina od .
Korak 2.
Odgovor:
Potpunim izgaranjem 3,70 g butana osobađa se toplina od 169 kJ koja je potrebna da se komad leda mase 55,5 g prevede u paru.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Više informacija o termodinamičkim procesima možete pronaći u modulu 2. Termodinamički sustavi i procesi u DOS-u Fizika 2.