Izotopi i izobari
- objasniti pojmove: nuklid, izotop i izobar
- usporediti strukture i svojstva izotopa i izobara
- opisati princip rada spektrometra masa
- na temelju brojevnog udjela i relativne atomske mase pojedinoga izotopa izračunati prosječnu relativnu atomsku masu atoma elementa
Uvod
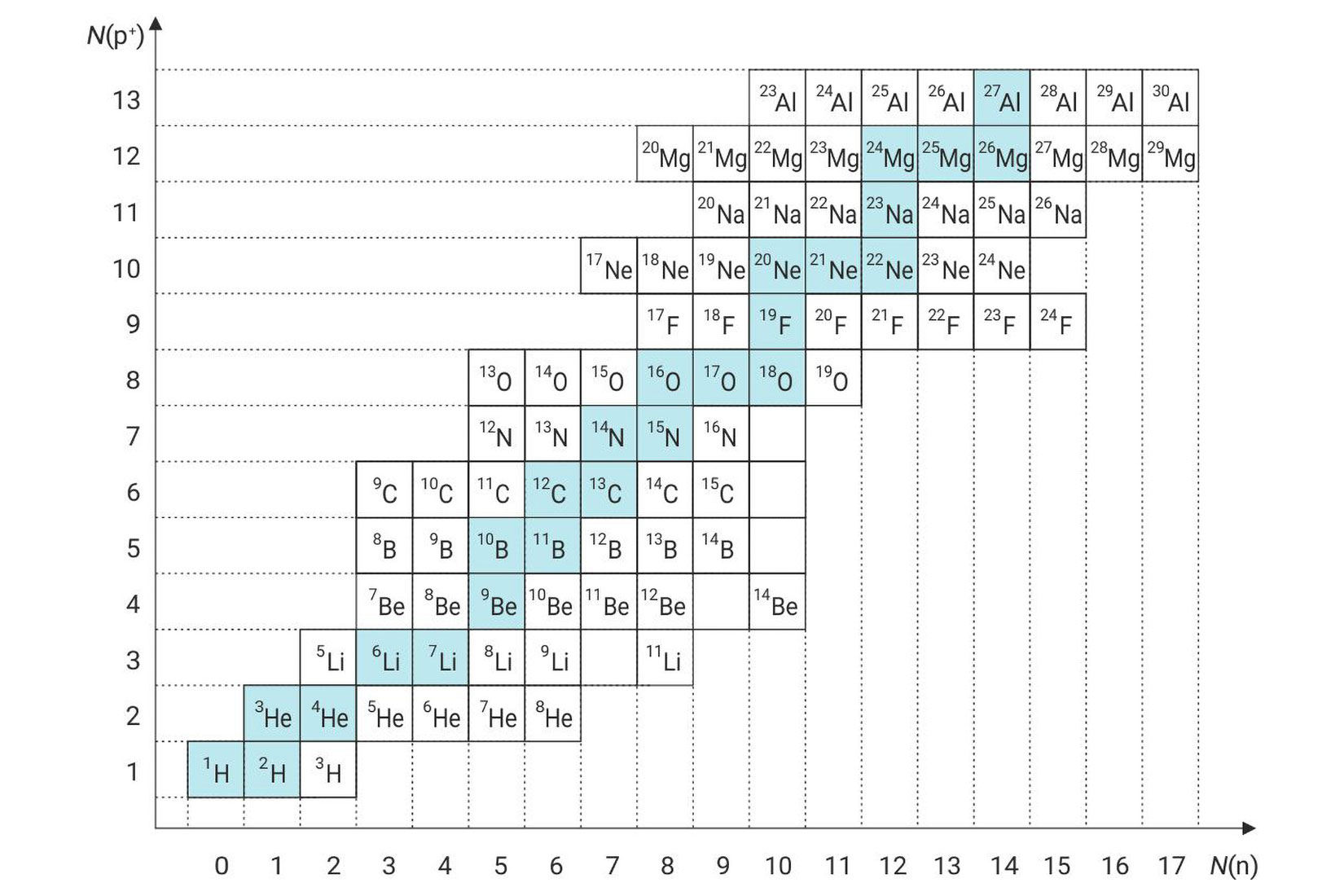
Atome određenog sastava jezgre, tj. određenog protonskoga broja, Z, i određenog nukleonskog broja, A, nazivamo nuklidima.
Primjerice, ugljik-12 je nuklid elementa ugljika čija jezgra ima šest protona i šest neutrona.
Kemijski element čine nuklidi s jednakim protonskim brojem: , , i . Elementi mogu biti mononuklidni i polinuklidni.
Tablica 1. Dio tablice nuklida; plavo naznačeni izotopi su stabilni
Natrij je mononuklidni kemijski element.
U jezgrama atoma natrija uvijek nalazi 11 protona i 12 neutrona, .
Element ugljik sastoji se od dva stabilna nuklida i .
Različiti nuklidi istog kemijskog elementa
nalaze na istom mjestu u periodnom sustavu elemenata.
Zovu se izotopni nuklidi
ili jednostavno izotopi (iso – isti, topos – mjesto).
Izotopi
Izotopi su atomi s istim brojem protona,
a različitim brojem neutrona u jezgri.
Izotopi su atomi kemijskog elementa,
s istim protonskim, a različitim nukleonskim brojem.
Primjerice, klor je smjesa dvaju izotopa; i .
Budući da se protonski broj atoma kemijskog elementa ne mijenja,
pri označavanju elementa ga često izostavljamo.
Tako, primjerice, pišemo: ili , odnosno, ili .
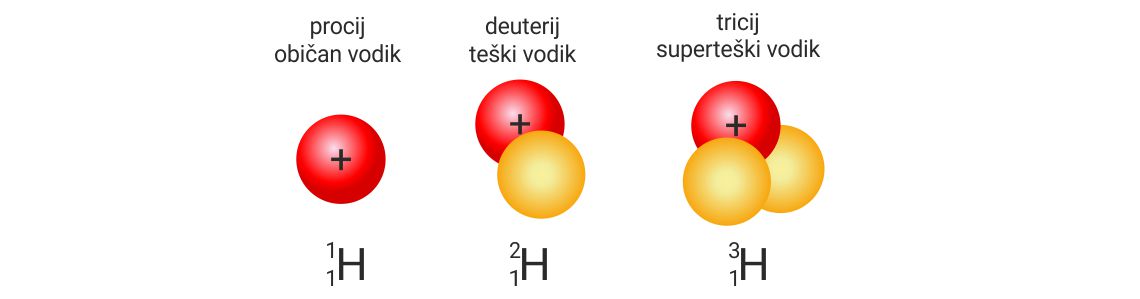
Izotopi vodika
| izotopi vodika | proton | elektron | neutron |
|---|---|---|---|
| ; procij, običan vodik |
1 | 1 | 0 |
| ; deuterij, teški vodik |
1 | 1 | 1 |
| ; tricij, superteški vodik |
1 | 1 | 2 |
Natrij je na primjer mononuklidni kemijski element jer se u jezgrama atoma natrija uvijek nalazi 11 protona i 12 neutrona, .
Element ugljik sastoji se od dva stabilna nuklida i .
Budući da se različiti nuklidi istog kemijskog elementa nalaze na istom mjestu u periodnom sustavu elemenata, zovu se izotopni nuklidi ili jednostavno izotopi (iso – isti, topos – mjesto).
Prisjetite se što ste u osnovnoj školi učili o izotopima (vidite jedinicu 3.3 Izotopi i relativna atomska masa u DOS-u Kemija 7).
Izotopi
Izotopi su atomi s istim brojem protona, a različitim brojem neutrona u jezgri. Prema tome, izotopi su atomi kemijskog elementa, s istim protonskim, a različitim nukleonskim brojem.
Primjerice, klor je smjesa dvaju izotopa; i . Budući da se protonski broj atoma kemijskog elementa ne mijenja, pri označavanju elementa ga često izostavljamo. Tako, primjerice, pišemo: ili , odnosno, ili .
Izotopi vodika
| izotopi vodika | proton | elektron | neutron |
|---|---|---|---|
| ; procij, običan vodik |
1 | 1 | 0 |
| ; deuterij, teški vodik |
1 | 1 | 1 |
| ; tricij, superteški vodik |
1 | 1 | 2 |
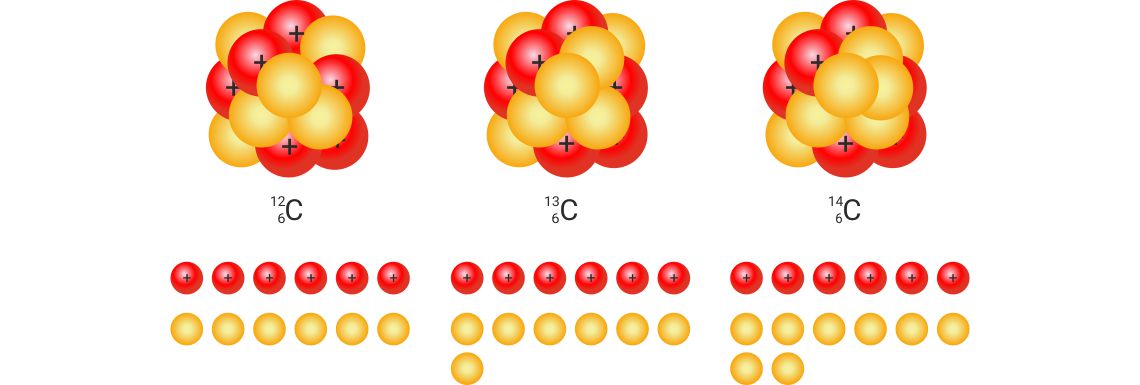
Izotopi ugljika
Prirodni ugljik ima dva stabilna izotopa: i
i radioaktivni izotop .
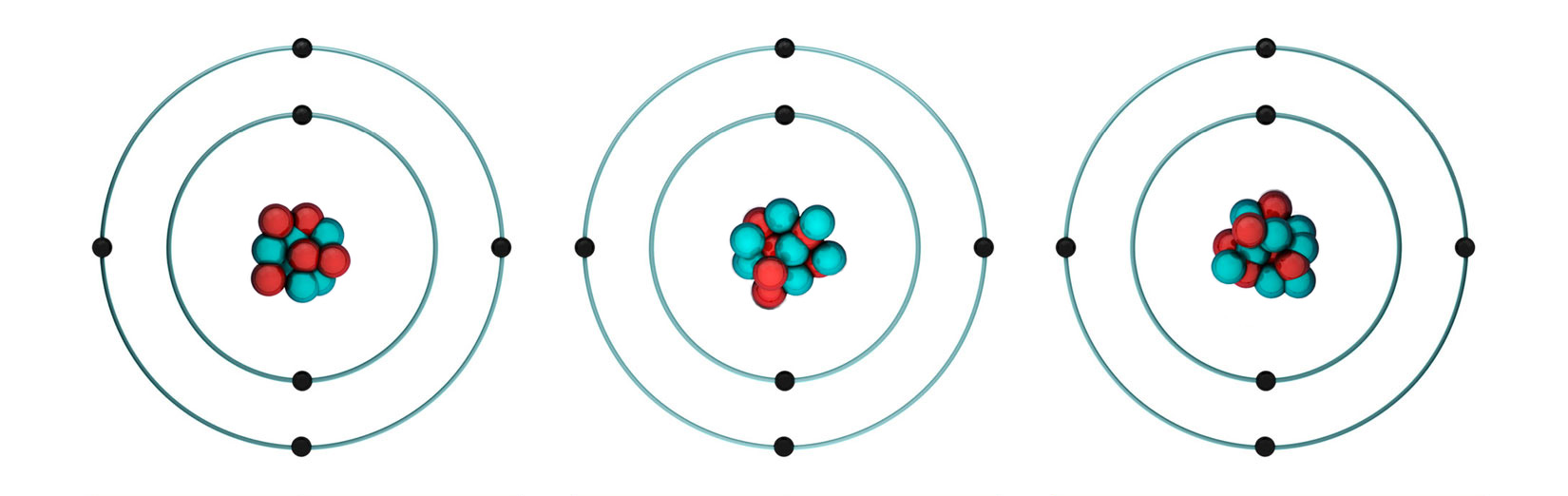
| ugljik-12 | ugljik-13 | ugljik-14 | |||
|---|---|---|---|---|---|
| 6 protona | 6 protona | 6 protona | |||
| 6 neutrona | 7 neutrona | 8 neutrona | |||
| 6 elektrona | 6 elektrona | 6 elektrona | |||
| w = 98,93 % | w = 1,07 % | w = 10–10 % | |||
| Ar = 12(po definiciji) | Ar = 13,00335 | Ar = 14,00324 | |||
Udio ugljikovih izotopa u svim živim organizmima
kao i u atmosferi je stalan.
Fotosintezom i disanjem živi organizmi izmjenjuju ugljikov(IV) oksid.
Iako je maseni udio izotopa svega 10-10 % ,
on se kao i ostali ugljikovi izotopi unosi u žive organizme hranom.
Ugljikov(IV) oksid sudjeluje u izmjeni tvari s okolinom
te je njegov udio u tkivima živih bića je stalan.
Uginućem biljaka i životinja prestaje izmjena tvari s okolinom.
Radioaktivno raspadanje nastavlja.
Određivanjem udjela izotopa u pojedinim uzorcima
može se odrediti njihova starost.
Ljudska kosa iz dobro očuvanih ostataka, pougljenjeni ili drveni fragmenti
nekad živućeg drveća i pamuk iz nekad živućih biljaka
vrlo su korisni izvori za određivanje arheološke starosti ovom metodom.
Udio ugljikovih izotopa u svim živim organizmima kao i u atmosferi je stalan, jer fotosintezom i disanjem živi organizmi izmjenjuju ugljikov(IV) oksid. Iako je maseni udio izotopa svega 10–10 % , on se kao i ostali ugljikovi izotopi unosi u žive organizme hranom. Budući da sudjeluje u izmjeni tvari s okolinom njegov udio u tkivima živih bića je stalan. Uginućem biljaka i životinja prestaje izmjena tvari s okolinom, ali se radioaktivno raspadanje nastavlja. Određivanjem udjela izotopa u pojedinim uzorcima može se odrediti njihova starost. Ljudska kosa iz dobro očuvanih ostataka, pougljenjeni ili drveni fragmenti nekad živućeg drveća i pamuk iz nekad živućih biljaka vrlo su korisni izvori za određivanje arheološke starosti ovom metodom.
Nakon uginuća količina u kosti ostaje konstantna, ali se raspada. Mjerenjem količine u usporedbi s u uzorku pokazuje koliko je vremena prošlo od uginuća (smrti) organizma. Na sljedećoj poveznici pronađite nešto više o ovoj temi.
Atomska jedinica mase i relativna atomska masa
Mase protona, elektrona, neutrona ali i mase atoma (ma) i molekula (mf) izuzetno su male pa s njima nije praktično računati.
Na primjer, ;
Zbog toga razloga javila se potreba odabiranja neke osnovne mase u odnosu na koju bi se mogle iskazivati mase svih atoma.
Početkom 19. st. prvi je to učinio J. Dalton uspoređujući mase svih atoma s masom najlakšeg atoma – atoma vodika.
Godine 1961. uvedena je atomska jedinica mase (znak: u ili mu). Umjesto naziva atomska jedinica mase danas se sve češće rabi naziv dalton (Da).
Atomska jedinica mase jednaka je jednoj dvanaestini mase atoma izotopa ugljika-12. Masa atoma izotopa ugljika-12 iznosi .
Relativna atomska masa
Relativna atomska masa, Ar, omjer je mase atoma (ma) i atomske jedinice mase, u.
Relativna atomska masa je broj koji pokazuje koliko puta je masa atoma nekog elementa veća od atomske jedinice mase.
Relativna molekulska masa
Relativna molekulska masa, Mr, je broj koji pokazuje koliko puta je masa molekule (mf) ili iona prikazanih formulskom jedinkom veća od atomske jedinice mase.
XY = molekula ili formulska jedinka
Relativnu molekulsku masu možemo izračunati i zbrajanjem relativnih atomskih masa atoma u molekuli.
Unesite odgovore na pripadajuća mjesta.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Pridružite odgovarajuću vrijednost relativne atomske ili molekulske mase atomima i molekulama navedenih jedinki.
46,07
283,88
159,80
55,85
172,18
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Princip određivanja atomskih masa elemenata
Masa atoma izuzetno je mala.
Nema vage kojom bismo mogli izvagati masu jednog atoma.
Početkom 20. stoljeća pronalazak masenog spektrografa
koji se danas naziva spektrometrom masa.
Spektrometar masa je omogućio određivanje mase atoma,
a time i broj te relativnu zastupljenost izotopa prirodnih elemenata.
Na taj je način utvrđeno da neon ima 3 stabilna izotopa.
ti izotopi se u prirodi javljaju u sljedećim udjelima:
90,48 % , 0,27 % i 9,25 % .
Tek primjenom masenog spektrometra moglo se dokazati
da je većina prirodnih elemenata smjesa nuklida.
Poznavajući brojevni udio pojedinog izotopa
u prirodnom elementu i relativnu atomsku masu izotopa,
moguće je izračunati prosječnu
relativnu atomsku masu prirodnog elementa.
Ona je navedena u periodnom sustavu elemenata
i vrlo je često koristimo pri kemijskom računu.
Princip određivanja atomskih masa elemenata
Masa atoma izuzetno je mala, pa ne iznenađuje da nema vage kojom bismo mogli izvagati masu jednog atoma. Početkom 20. stoljeća pronalazak masenog spektrografa (danas se naziva spektrometrom masa) omogućio je određivanje mase atoma, kao i broja izotopa i njihovu zastupljenost u prirodnom kemijskom elementu. Tek primjenom masenog spektrometra moglo se dokazati da je većina prirodnih elemenata smjesa nuklida.
Poznavajući brojevni udio pojedinog izotopa u prirodnom elementu i relativnu atomsku masu izotopa, moguće je izračunati prosječnu relativnu atomsku masu prirodnog elementa. Ona je navedena u periodnom sustavu elemenata i vrlo je često koristimo pri kemijskom računu.
Riješeni primjer 1.
Spektrometrijskom je analizom utvrđeno da je neon smjesa triju izotopa:
, brojevnog udjela 90,48 %; , brojevnog udjela 0,27 % i , brojevnog udjela 9,25 %.
Izračunajte prosječnu relativnu atomsku masu neona ako su Ar (20 Ne) = 19,992;
Ar (21 Ne) = 20,993; Ar (22 Ne) = 21,991.
| izotop | brojevni udio, | |
|---|---|---|
| 90,48 % | 19,992 | |
| 0,27 % | 20,993 | |
| 9,25 % | 21,991 |
Izradak:
Odgovor:
Prosječna relativna atomska masa neona iznosi 20,18.
Masena spektrometrija
Masena spektrometrija je skupni naziv za niz eksperimentalnih metoda
kojima se određuju mase atoma, molekula, i njihovih fragmenata.
Osnovni dijelovi svakog spektrometra masa je komora za ionizaciju, ubrzivač iona i analizator masa.
Svaki od tih dijelova se može jako razlikovati.
To ovisi o specifičnosti metode.
Pri odabiru eksperimentalnog postava važno je dobro poznavati
funkciju i karakteristike svakog dijela spektrometra.
Kako bi se omogućilo odvajanje čestica po masama,
najprije atomima ili molekulama treba izbiti elektrone.
Na taj način se dobiju pozitivno nabijene čestice.
Taj proces se zove ionizacija.
Ionizacija se može izvesti na mnogo različitih načina.
Odabir ionizacijske metode znatno utječe na konačni ishod mjerenja.
Taj korak je vrlo važnan u svakoj spektrometriji masa.
Kod atomske spektrometrije masa
pojedinačne molekule se najprije atomiziraju.
To znači da se rastavljaju u pojedinačne atome.
Pojedinačni atomi se zatim ioniziraju.
Ioni se nakon toga ubrzavaju razlikom potencijala
i ulaze u analizator masa.
Analizator masa se sastoji od separatora i detektora.
U separatoru masa, ioni se gibaju u magnetskom polju.
Ioni se pri tom gibanju se oni različito otklanjaju.
Otklon ovisi o masi i naboju pojedinačnih iona.
Ovo je određeno Lorentzovim zakonom.
Pojedinačni ioni se međusobno razlikuju po masama.
Odnos polumjera njihovih putanja
je u jednostavnoj direktnoj vezi s masom.
To se očitava na detektoru.
Suvremeni spektrometri masa imaju vrlo veliku moć razlučenja.
Možemo uočavati i vrlo male razlike u masama.
Tako razdvojene vrste čestica mogu se onda uočiti na spektrogramu.
Na apscisi spektrograma su prikazane mase iona.
Na ordinati je prikazan intenzitet.
Intenzitet je u direktnoj vezi s brojnošću pojedinačnih čestica u uzorku.
Prema tome, iz spektrograma masa jednostavno očitavamo mase.
Iz spektrograma očitavamo zastupljenost
pojedinačnih atoma ili molekulskih fragmenata.
Iz istog razloga nam taj eksperiment daje direktnu informaciju
o brojnosti i zastupljenosti pojedinačnih izotopa.
Masena spektrometrija
Masena spektrometrija je skupni naziv za niz eksperimentalnih metoda kojima se određuju mase atoma, molekula, ali i njihovih fragmenata. Osnovni dijelovi svakog spektrometra masa je komora za ionizaciju, ubrzivač iona i analizator masa. Svaki od tih dijelova se može jako razlikovati ovisno o specifičnosti metode, tako da je pri odabiru eksperimentalnog postava izuzetno važno dobro poznavati funkciju i karakteristike svakog dijela spektrometra.
Kako bi se omogućila separacija čestica po masama, u samom spektrometru masa najprije atomima ili molekulama treba izbiti elektrone, tako da se dobiju pozitivno nabijene čestice. Taj proces zovemo ionizacijom, a ona se može izvesti na mnogo različitih načina. Odabir ionizacijske metode znatno utječe na konačni ishod mjerenja, pa je zato taj korak od ključne važnosti u svakoj spektrometriji masa. Kod atomske spektrometrije masa pojedinačne molekule se najprije atomiziraju, tj. rastavljaju u pojedinačne atome, koji se zatim ioniziraju. Ioni se nakon toga ubrzavaju razlikom potencijala i ulaze u analizator masa.
Analizator masa se sastoji od separatora i detektora. U separatoru masa, ioni se gibaju u magnetskom polju, pri čemu se oni različito otklanjaju, a otklon ovisi o masi i naboju pojedinačnih iona, što je određeno Lorentzovim zakonom.
S obzirom na to da se pojedinačni ioni međusobno razlikuju po masama, odnos polumjera njihovih putanja je u jednostavnoj direktnoj vezi s masom, što se očitava na detektoru. Suvremeni spektrometri masa imaju vrlo veliku moć razlučenja, tako da možemo uočavati i vrlo male razlike u masama. Tako razdvojene vrste čestica mogu se onda uočiti na spektrogramu, na čijoj su apscisi mase iona, a na ordinati je intenzitet, koji je u direktnoj vezi s brojnošću pojedinačnih čestica u uzorku. Prema tome, iz spektrograma masa jednostavno očitavamo mase, ali i zastupljenosti pojedinačnih atoma ili molekulskih fragmenata. Iz istog razloga nam taj eksperiment daje direktnu informaciju o brojnosti i zastupljenosti pojedinačnih izotopa.
Spektrometrom masa mogu se identificirati nepoznati kemijski spojevi.
Zbog toga se spektrometar masa koristi u sudskoj medicini.
Koristi se za identifikaciju droga
ili pri analizi urina, za provjeru prisutnosti nedozvoljenih supstancija (dopping).
Na mrežnim stranicama potraži priču
o sportašu koji je koristio/koristila doping.
Istraži koje sredstvo je korišteno, s kojim ciljem.
Izvuci zaključak o zdravstvenim
i moralnim aspektima takvog postupanja.
Spektrometrom masa mogu se identificirati nepoznati kemijski spojevi. Zbog toga se spektrometar masa, primjerice, koristi u sudskoj medicini za identifikaciju droga ili pri analizi urina, za provjeru prisutnosti nedozvoljenih supstancija (doping).
Na mrežnim stranicama potražite priču o sportašu/sportašici koji/koja je koristio/koristila doping. Istražite koje sredstvo je korišteno, s kojim ciljem te iznesite zaključke o zdravstvenim i moralnim aspektima takvog postupanja.
Potražite značenje skraćenice WADA?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Izobari
Izobari su atomi koji imaju jednak nukleonski broj A, a različit protonski broj Z. Primjerice, i . Prema tome, izobari su atomi različitih kemijskih elemenata.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Za kraj
Riješite dopunjaljku u kojoj ćete ponoviti pojmove u ovoj jedinici DOS-a.
Klikom miša odaberite broj.
Pročitajte pitanje.
Upišite odgovor u prostor pored broja koji ste odabrali.
Na kraju…
Riješite dopunjaljku i ponovite pojmove obrađene u cjelini Izotopi i izobari.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Relativna atomska masa kisika je:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Masa jednog atoma broma je:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Atom kisika je teži od atoma vodika:
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?