Soli
- navesti što su soli
- pojedinoj soli pridružiti odgovarajući naziv
- prikazati različite načine dobivanja soli jednadžbama kemijskih reakcija
- izračunati ravnotežnu konstantu otapanja soli
- na temelju vrijednosti ravnotežne konstante otapanja soli zaključiti je li sol dobro ili slabo topljiva u vodi
- predvidjeti pH-vrijednost različitih vodenih otopina soli
Soli
Soli su vrlo važni kemijski spojevi.
Čvrste su tvari.
Sastoje većinom od kationa metala i aniona kiselinskog ostatka.
Nemetalni kation je primjerice amonijev ion, NH4+.
Zbog raznovrsne uporabe soli su dobivale i različita trivijalna imena primjerice:
vapnenac, gips, soda bikarbona, modra galica, salmijak i druge.
Uvod
Soli su vrlo važni kemijski spojevi. To su čvrste tvari koje se sastoje većinom od kationa metala i aniona kiselinskog ostatka. Nemetalni kation je primjerice, amonijev ion, .
Zbog raznovrsne uporabe soli su dobivale i različita trivijalna imena primjerice: vapnenac, gips, soda bikarbona, modra galica, salmijak i druge.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
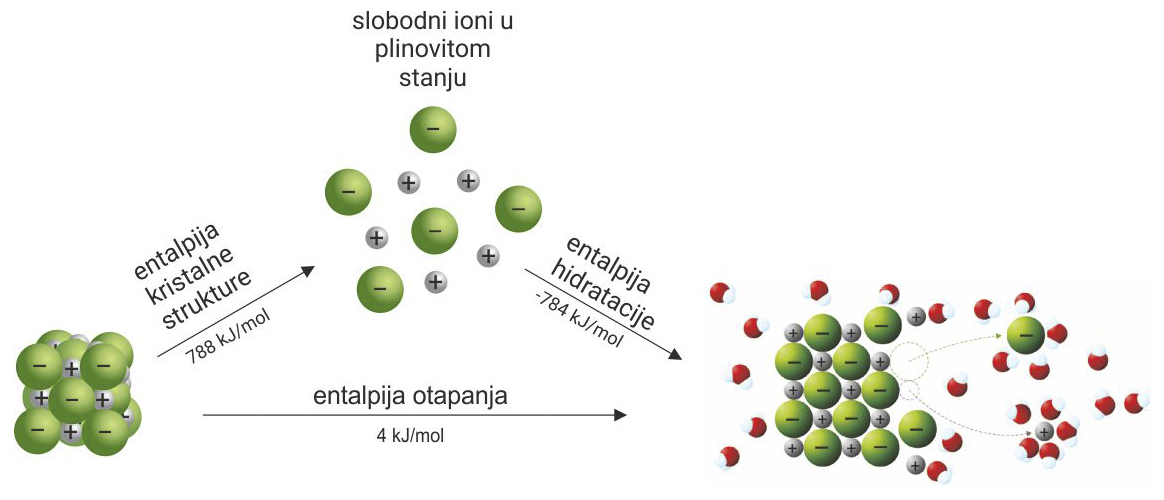
Topljivost soli
Prilikom otapanja
u vodi razara se ionska kristalna rešetka.
Dolazi do hidratacije nastalih iona, ion – dipolnih interakcija.
Soli su elektrolitne otopine zbog slobodnih iona.
Topljivost soli
Prilikom otapanja
Jednadžba disocijacije natrijeva klorida (NaCl):
Natrijev kolrid (NaCl) je dobro topljiva u vodi.
Barijev sulfat (BaSO4) je vrlo slabo topljiv u vodi.
Za soli slabo topljive u vodi uspostavlja se ravnoteža između:
- iona na koje sol disocira u vodenoj otopini
- netopljive soli.
Jednadžba disocijacije barijeva sulfata (BaSO4):
Izraz za koncentracijsku konstantu ravnoteže otapanja barijeva sulfata je:
Zbog slabe topljivosti soli pretpostavlja se da je koncentracija barijeva sulfata (BaSO4) konstanta.
Umnožak (∙) koncentracijske konstante ravnoteže (Kc) i množinske koncentracije (c) barijeva sulfata ()) daje ravnotežnu konstantu otapanja soli Ks (engl. solubility product constant).
Ravnotežna konstanta otapanja soli, Ks, pri danoj temperaturi, ovisi o umnošku (∙) koncentracije (c) pojedinih iona u otopini, potencirane brojem iona u formuli spoja.
To je razlog zbog kojeg mjerne jedinice ravnotežnih konstanti otapanja (Ks) navedenih soli, nisu jednake.
Primjerice;
Ks
Ks
Iz ravnotežne konstante otapanja soli (Ks) mogu se izračunati:
- koncentracije (c) disociranih iona
- topljivost soli pri određenoj temperaturi.
Poveznica za Tablica topljivosti soli
Što je manja (<) vrijednost ravnotežne konstante otapanja soli (Ks) to je manja njena (<) topljivost.
Jednadžba disocijacije natrijeva klorida:
Za razliku od natrijeva klorida koji je dobro topljiv u vodi, barijev sulfat je vrlo slabo topljiv u vodi.
Za soli slabo topljive u vodi uspostavlja se ravnoteža između iona na koje sol disocira u vodenoj otopini i netopljive soli.
Jednadžba disocijacije barijeva sulfata:
Izraz za koncentracijsku konstantu ravoteže otapanja barijeva sulfata je:
Zbog slabe topljivosti barijeva sulfata pretpostavlja se da je njegova koncentracija konstantna.
Umnožak koncentracijske konstante ravnoteže i množinske koncentracije barijeva sulfata, daje ravnotežnu konstantu otapanja soli, (engl. solubility product constant) .
Ravnotežna konstanta otapanja soli, , pri danoj temperaturi ovisi o umnošku koncentracije pojedinih iona u otopini potencirane brojem iona u formuli spoja. To je razlog zbog kojih mjerne jedinice ravnotežnih konstanti otapanja navedenih soli, nisu jednake.
Primjerice;
Iz ravnotežne konstante otapanja soli, , mogu se izračunati koncentracije disociranih iona i topljivost soli pri određenoj temperaturi.
Poveznica za Tablicu topljivosti soli.
Što je manja vrijednost ravnotežne konstante otapanja soli, , to je njena topljivost manja.
Riješeni primjer 1
Koja je sol topljivija u vodi, barijev sulfat (BaSO4) ili barijev fluorid (BaF2)?
Ravnotežna konstanta otapanja (Ks) barijeva sulfata je 1,08×10−10mol2dm−6 pri 25 °C.
Ravnotežna konstanta otapanja (Ks) barijeva fluorida je 1,84×10−7mol3dm−9 pri 25 °C.
Zadano je:
Ks
Ks
Traži se:
c1
c1 – koncentracija barijevih iona u otopini barijeva sulfata
c2
c2 – koncentracija barijevih iona u otopini barijeva flourida
Izradak:
Iz vrijednosti ravnotežne konstante otapanja može se izračunati koncentracija (c1 i c2) barijevih iona (Ba2+) u vodenoj otopini jedne i druge soli.
Korak 1
Jednadžba disocijacije barijeva sulfata (BaSO4) u vodi.
Ravnotežne koncentracije barijevih (Ba2+) i sulfatnih iona (SO42–) označe se sa x.
Korak 2
Iz izraza za ravnotežnu konstantu otapanja soli može se izračunati množinska koncentracija (c) barijevih iona (Ba2+):
Ks
Ks
Ks
Korak 3
Odgovor:
Koncentracija (c) barijevih iona (Ba2+) u zasićenoj otopini barijeva fluorida (BaF2) je veća (>) od koncentracije (c) barijevih iona (Ba2+) u zasićenoj otopini barijeva sulfata (BaSO4).
Stoga, veća (>) je topljivost barijeva fluorida (BaF2).
Riješeni primjer 1
Koja je sol topljivija u vodi, barijev sulfat ili barijev fluorid?
Ravnotežna konstanta otapanja barijeva sulfata je , a barijeva fluorida je pri 25 °C.
Zadano je:
Traži se:
c1– koncentracija barijevih iona u otopini
c2 – koncentracija barijevih iona u otopini
Izradak:
Iz vrijednosti ravnotežne konstante otapanja soli može se izračunati koncentracija barijevih iona u vodenoj otopini jedne i druge soli.
Korak 1
Jednadžba disocijacije barijeva sulfata u vodi: , a ravnotežne koncentracije barijevih i sulfatnih iona označe se sa .
Ravnotežne koncentracije barijevih i sulfatnih iona su jednake i označe se sa .
Korak 2
Iz izraza za ravnotežnu konstantu otapanja soli može se izračunati množinska koncentracija barijevih iona:
Korak 3
Koncentracija u ravnoteži:
Odgovor:
S obzirom na to da je koncentracija barijevih iona, u zasićenoj vodenoj otopini barijeva fluorida, veća od koncentracije barijevih iona, u zasićenoj vodenoj otopini barijeva sulfata, topljivost barijeva fluorida je veća.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izračunajte ravnotežnu konstantu otapanja (Ks) olovova (II) jodida (PbI2).
Množinska koncentracija (c) olovovih (II) iona (Pb2+) u otopini iznosi 1,27×10−3 mol dm−3.
c
Ks
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izračunajte ravnotežnu konstantu otapanja olovova(II) jodida ako je množinska koncentracija olovovih(II) iona u otopini .
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Dobivanje soli
Soli se mogu dobiti na različite načine:
Primjer:
1. Dobivanje soli izravnom sintezom iz elemenata:
metal + nemetal sol
Primjer:
Dobivanje soli
Soli se mogu dobiti na različite načine.
1. Dobivanje soli izravnom sintezom iz elemenata:
metal + nemetal sol
Primjer:
2. Dobivanje soli reakcijom metala i kiseline:
metal + kiselina sol + vodik
Primjer:
2. Dobivanje soli reakcijom metala i kiseline:
metal + kiselina sol + vodik
Primjer:
3. Dobivanje soli reakcijom neutralizacije:
a) baza + kiselina sol + voda
Primjer:
Sumporna kiselina (H2SO4) je diprotonska kiselina, ionizira u dva stupnja.
Stoga se i reakcija neutralizacije sumporne kiseline (H2SO4) s natrijevom lužinom (NaOH) odvija u dva stupnja:
I. stupanj
| ↓ | ||
| natrijev hidrogensulfat |
II. stupanj
| ↓ | ||||
| natrijev sulfat | ||||
Zbirna reakcija:
U vodenim otopinama neutralizacija je reakcija oksonijevih i hidroksidnih iona:
.
3. Dobivanje soli reakcijom neutralizacije:
a) baza + kiselina sol + voda
Primjer:
Sumporna kiselina je diprotonska kiselina, ionizira u dva stupnja pa se i reakcija neutralizacije sumporne kiseline s natrijevom lužinom odvija u dva stupnja:
I. stupanj
| ↓ | ||
| natrijev hidrogensulfat |
II. stupanj
| ↓ | ||||
| natrijev sulfat | ||||
Zbirna reakcija:
U vodenim otopinama neutralizacija je reakcija oksonijevih i hidroksidnih iona:
.
Kiselo-bazne titracije
Kiselo-bazna titracija je volumetrijska metoda kvantitativne kemijske analize kojom se može odrediti koncentracija neke kiseline ili lužine.
Kiselo-bazne titracije
Kiselo-bazna titracija je volumetrijska metoda kvantitativne kemijske analize kojom se može odrediti koncentracija neke kiseline ili lužine.
Određivanje se izvodi na način da se biretom otopina poznate koncentracije dodaje otopini nepoznate koncentracije kojoj je dodan indikator.
Ovaj postupak naziva se titracija.
Otopina koja se dodaje biretom naziva se titrans.
Titrirana otopina naziva se analit.
Točka ekvivalencije označava trenutak kad je u otopinu, koja se titrira, dodana ekvivalentna množina tvari kojom titriramo.
Promjena boje indikatora ne događa se točno u točki ekvivalencije.
Promjena boje indikatora određuje točku završetka titracije.
Određivanje se izvodi na način da se biretom dodaje otopina poznate koncentracije otopini nepoznate koncentracije kojoj je dodan indikator.
Otopina u bireti naziva se titrant, a titrirana otopina analit.
Točka ekvivalencije označava trenutak kad je u otopinu, koju se titrira, dodana ekvivalentna množina tvari kojom titriramo.
Promjena boje indikatora ne događa se točno u točki ekvivalencije i određuje točku završetka titracije.
Iz titracijske je krivulje vidljivo da se pH-vrijednost naglo mijenja u blizini točke ekvivalencije.
Za titraciju jakih kiselina i jakih baza kao indikator se najčešće koriste:
- fenolftalein,
- metiloranž,
- metilno crvenilo.
Iz titracijske je krivulje vidljivo da se pH-vrijednost naglo mijenja u blizini točke ekvivalencije. Za titraciju jakih kiselina i jakih baza kao indikator se najčešće koriste fenolftalein, metiloranž i metilno crvenilo.
Riješeni primjer 2.
Odpipetira se 20 mL otopine klorovodične kiseline nepoznate koncentracije koja se ispusti u Erlenmeyerovu tikvicu i nakon toga se doda nekoliko kapi fenolftaleina. U kiselinu se zatim, polagano, kap po kap, iz birete dodaje kalijeva lužina množinske koncentracije 0,10 mol L –1 do promjene boje indikatora. Ako se za titraciju utroši 20 mL kalijeve lužine, izračunajte množinsku koncentraciju klorovodične kiseline.
Zadano je:
Traži se:
Izradak:
Titracija se temelji na reakciji neutralizacije jake lužine s jakom kiselinom prema sljedećoj jednadžbi kemijske reakcije:
Na temelju jednadžbe kemijske reakcije može se zaključiti da su množine klorovodične kiseline i kalijeve lužine jednake.
Odgovor:
Množinska koncentracija klorovodične kiseline je 0,10 mol L–1.
Odredite koncentracije otopina klorovodične kiseline (HCl) na isti način u sljedećim primjerima tako da riješite interaktivni zadatak.
Odredite koncentracije otopina klorovodične kiseline na isti način u sljedećim primjerima tako da riješite interaktivni zadatak.
Neutralizacija je i reakcija bazičnog oksida i kiseline, kiselog oksida i baze, kao i bazičnog i kiselog oksida:
b) bazični oksid + kiselina sol + voda
c) kiseli oksid + baza sol + voda
d) bazični oksid + kiseli oksid sol
4. Dobivanje soli reakcijom dvostruke izmjene iona:
sol1 + sol2 sol3 + sol4
Soli vrlo slabe
Primjer:
Hidroliza soli
Jesu li vodene otopine soli neutralne otopine?
Pogledajte sljedeći videozapis.
Donesite zaključak o pH-vrijednosti vodenih otopina nekih soli.
Hidroliza soli
Jesu li vodene otopine soli neutralne otopine? Pogledajte sljedeći videozapis i potom donesite zaključak o pH-vrijednosti vodenih otopina nekih soli.
U navedenim reakcijama ioni soli reagiraju s molekulama vode pa takvu vrstu protolitičkih reakcija nazivamo hidroliza soli.
S vodom reagiraju samo kiselinski anioni slabih kiselina (konjugirane jake baze) ili kationi slabih baza (konjugirane jake kiseline).
Anioni jakih kiselina i kationi jakih baza ne reagiraju s molekulama vode.
Dolazi samo do hidratacije navedenih iona.
Otopina natrijeva klorida (NaCl) je neutralna jer otapanjem u vodi nastaju hidratizirani natrijevi (Na+) i kloridni (Cl–) ioni.
Ti ioni ne reagiraju s vodom.
U vodi se ne mijenja koncentracija (c) oksonijevih, H3O+ i hidroksidnih, OH– iona.
Prema tome, pH nastale otopine je 7.
S vodom reagiraju samo anioni slabih kiselina (konjugirane jake baze) ili kationi slabih baza (konjugirane jake kiseline).
Otapanjem natrijeva cijanida (NaCN) u vodi, nastaju natrijevi (Na+) i cijanidni (CN–) ioni koji u reakciji s vodom povećavaju koncentraciju (c) hidroksidnih (OH–) iona.
Vodena otopina je lužnata, .
Otapanjem amonijeva acetata (CH3COONH4) u vodi nastaju amonijevi (NH4+) i acetatni (CH3COO–) ioni.
Amonijevi ioni u reakciji s vodom povećavaju koncentraciju (c) oksonijevih iona (H3O+).
Acetatni ioni u reakciji s vodom povećavaju koncentraciju (c) hidroksidnih iona (OH–).
Prema tome je pH vodene otopine približno 7.
Točna vrijednost pH ovisi o vrijednostima konstanti disocijacije octene kiseline, Ka i amonijaka, Kb.
U navedenim primjerima ioni soli reagiraju s molekulama vode pa takvu vrstu protolitičkih reakcija nazivamo hidroliza soli.
Anioni jakih kiselina i kationi jakih baza ne reagiraju s molekulama vode, već dolazi samo do hidratacije navedenih iona.
Otopina natrijeva klorida je neutralna jer otapanjem u vodi nastaju hidratizirani natrijevi, (), i kloridni, (), ioni. Ti ioni ne reagiraju s vodom, pa se u vodi ne mijenja koncentracija oksonijevih, , i hidroksidnih, , iona. Stoga je pH-vrijednost nastale otopine 7.
S vodom reagiraju samo anioni slabih kiselina (konjugirane jake baze) ili kationi slabih baza (konjugirane jake kiseline).
Otapanjem natrijeva cijanida u vodi osim natrijevih nastaju i cijanidni ioni, jake konjugirane baze. Prema tome cijanidni ioni su proton akceptori te u reakciji s vodom povećavaju koncentraciju hidroksidnih iona.
Vodena otopina natrijeva cijanida je lužnata, .
Otapanjem amonijeva acetata u vodi nastaju amonijevi i acetatni ioni. Amonijevi ioni u reakciji s vodom povećavaju koncentraciju oksonijevih iona, a acetatni hidroksidnih iona.
Prema tomu pH-vijednost vodene otopine amonijeva acetata približno je 7.
Riješeni primjer 3
Izračunajte množinsku koncentraciju (c) amonijeva klorida ().
pH otopine iznosi 4,83.
Konstanta disocijacije baze, Kb () iznosi .
Zadano je:
pH = 4,83
Traži se:
Izradak:
Korak 1.
Amonijev klorid () je topljiva sol koja u vodi disocira na amonijeve, NH4+, i kloridne, Cl– ione.
Nastali ioni protolitički reagiraju s vodom.
Hidroliza amonijeva iona:
| + | + | |||||
| ↓ | ↓ | ↓ | ↓ | |||
| kiselina 1 | baza 1 | baza 2 | kiselina 2 |
natrijev hidrogensulfatnatrijev hidrogensulfat
U reakciji hidrolize amonijev ( ) ion je kiselina.
Stoga je konstanta Ka(( \ce{NH4+} \) ) :
Budući je zadana , slijedi:
Iz vrijednosti pH otopine soli izračuna se koncentracija oksonijevih iona, c( ):
Ravnotežne koncentracije amonijaka ( ) i oksonijevih iona ( ) unesu se u tablicu:
| početna koncentracija/ mol dm–3 | ? | 0 | 0 |
|---|---|---|---|
| promjena | |||
| ravnotežna koncentracija/ mol dm–3 | ? |
Iz izraza za konstantu Ka sada se može izračunati koncentracija (c) amonijevih iona ( ).
Budući da je amonijev klorid () sol dobro topljiva u vodi, koncentracija (c) amonijevih iona () jednaka (=) je koncentraciji (c) amonijeva klorida ().
Odgovor: Množinska koncentracija (c) amonijeva klorida () u otopini, čiji je pH = 4,83 je .
Riješeni primjer 3
Izračunajte množinsku koncentraciju amonijeva klorida ako je pH-vrijednost vodene otopine 4,83, a konstanta ionizacije baze, .
Zadano je:
pH = 4,83
Traži se:
Izradak:
Korak 1.
Amonijev klorid je topljiva sol koja u vodi disocira na amonijeve, i kloridne, ione.
Nastali ioni protolitički reagiraju s vodom.
Hidroliza amonijeva iona:
| + | + | |||||
| ↓ | ↓ | ↓ | ↓ | |||
| kiselina 1 | baza 1 | baza 2 | kiselina 2 |
U reakciji hidrolize ion je kiselina, pa je konstanta :
Budući je zadana , slijedi:
Ravnotežne koncentracije amonijaka i oksonijevih iona unesu se u tablicu:
| početna koncentracija/
mol dm–3 |
? | 0 | 0 |
|---|---|---|---|
| promjena | |||
| ravnotežna koncentracija/
mol dm–3 |
? |
Iz izraza za konstantu sada se može izračunati koncentracija amonijevih iona.
Budući da je amonijev klorid sol dobro topljiva u vodi, koncentracija amonijevih iona jednaka je koncentraciji amonijeva klorida.
Odgovor: Množinska koncentracija amonijeva klorida u otopini čiji je pH = 4,83 je .
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Na kraju…
Razmislite i odgovorite na pitanja!
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja vodena otopina soli ima najmanju pH-vrijednost?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
U kojim otopinama nastane bijeli talog?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odredite je li otopina amonijeva fluorida , kisela, bazična ili neutralna, ako je:
,
.
Otopina amonijeva fluorida kisela, jer je:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja vodena otopina soli ima najmanju pH-vrijednost?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
U kojim otopinama nastane bijeli talog?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za otopina amonijeva fluorida, vrijedi da je , a . Otopina amonijeva fluorida je stoga kisela, jer je:
Želite li pokušati ponovo?