

Kako biste bolje razumjeli pojam unutarnje energije plina i ovisnosti unutarnje energije o termodinamičkoj temperaturi samog plina, ponovite ono što ste naučili u jedinici 1.9 Tlak idealnog plina.
Molekule u termičkom gibanju imaju kinetičku energiju, a zbog međusobnih privlačenja odnosno odbijanja imaju i potencijalnu energiju. Ukupan zbroj kinetičkih i potencijalnih energija molekula nekog čvrstog tijela, tekućine ili plina naziva se unutarnja energija i označava s .
Međutim, kod jednoatomnih idealnih plinova neke od navedenih činjenica mogu se pojednostavniti.
Jednoatomni plinovi sastavljeni su od molekula koje čini samo jedan atom. Kod idealnih jednoatomnih plinova najveći dio njihove unutarnje energije potječe od kinetičke energije molekula koje se gibaju. Međusobna privlačenja odnosno odbijanja molekula idealnog plina zanemariva su, stoga je i potencijalna energija zanemariva u usporedbi s kinetičkom energijom gibanja molekula.
Unutarnja energija idealnog plina jednaka je ukupnoj kinetičkoj energiji svih čestica plina:
Unutarnja energija jednoatomnog idealnog plina jednaka je zbroju kinetičkih energija svih molekula u plinu i izračunava se pomoću formule:
Prisjetimo li se oblika jednadžbe stanja plina iz jedinice 1.7. Jednadžba stanja plina
i
te ih usporedimo s formulom za unutarnju energiju idealnog jednoatomnog plina, dolazimo do još dvaju načina zapisa te formule. (
Veličina N označava broj čestica u plinu.)
Dakle, ako je unutarnja energija idealnog jednoatomnog plina dana formulom:
onda vrijedi:
i
pri čemu je
opća plinska konstanta koja iznosi
termodinamička temperatura plina koja se mjeri u kelvinima
tlak plina koji se mjeri u paskalima
volumen plina koji se mjeri u kubnim metrima
Na sljedećoj animaciji istražite što se događa s unutarnjom energijom plina
u ovisnosti o broju čestica plina, masi čestica i temperaturi plina.
Simulacija prikazuje toplinsko gibanje čestica idealnog plina. U ovoj simulaciji vidjet ćemo kako unutarnja energija ovisi o toplinskom gibanju čestica idealnog plina.
Idealni plin početno se sastoji od
čestica, svaka mase
Plin se nalazi na temperaturi od tri stotine kelvina.
Kolika je unutarnja energija argona na temperaturi Molarna masa argona iznosi
Pomoć:
Prisjetite se formule za računanje unutrašnje energije.
Postupak:
Treba paziti da sve mjerne jedinice budu odgovarajuće. Masa je izražena u gramima tako da i molarna masa može biti u
Uvrštavajući ispravno podatke u jednadžbu, rješenje ovog zadatka iznosi:
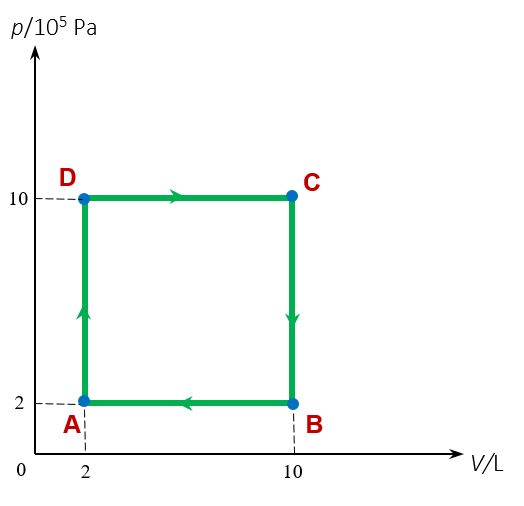
U dijagramu je prikazan kružni proces kroz koji prolazi idealni plin.
Odredite unutarnju energiju plina u stanju A, B, C i D.
Napomena: Promjena unutarnje energije između bilo koja dva stanja plina jednaka je razlici energija tih dvaju stanja. Očito je kako je razlika unutarnje energije dviju istih točaka dijagrama jednaka nuli.
Unutarnja energija u točki A iznosi
u točki B iznosi
u točki C iznosi
i u točki D iznosi
Najvažniji pojmovi koje smo naučili u ovoj jedinici jesu srednja kinetička energija čestica plina i unutarnja energija plina.
Srednja kinetička energija jedne čestice plina proporcionalna je s termodinamičkom temperatutom plina , a njihova veza dana je formulom:
Ukupan zbroj kinetičkih i potencijalnih energija molekula nekog čvrstog tijela, tekućine ili plina naziva se unutarnja energija i označava s .
Unutarnja energija jednoatomnog idealnog plina jednaka je zbroju srednjih kinetičkih energija svih molekula u plinu i izračunava se pomoću formule: .
Što čini unutarnju energiju idealnog plina?
Razvrstajte o kojim fizikalnim veličinama ovisi unutarnja energija plina, a o kojima ne ovisi.
Unutarnja energija je temperaturi tog plina.