


U prirodi se tvari nalaze u četiri agregacijska stanja: čvrstom, tekućem, plinovitom ili stanju plazme.
U ovoj ćemo jedinici prijelaze kroz agregacijska stanja proučavati na primjeru vode. Voda u prirodi prolazi kroz tri agregacijska stanja, ovisno o okolnim uvjetima.
Pri određenom tlaku i temperaturi tvari mogu prelaziti iz jednog agregacijskog stanja u drugo.
Voda se pri atmosferskom tlaku do temperature
nalazi u čvrstom agregacijskom stanju koje nazivamo led. Između
i
pri atmosferskom tlaku voda je u tekućem stanju. Iznad
također pri atmosferskom tlaku, voda prelazi u plinovito agregacijsko stanje, odnosno vodenu paru.
Led, voda i vodena para tri su agregacijska stanja iste tvari te se prema sastavu ne razlikuju.
Prijelaz tvari kroz agregacijska stanja pod određenim uvjetima moguć je u svim smjerovima. Prijelaz iz tekućeg agregacijskog stanja u plinovito naziva se isparavanje, iz plinovitog u tekuće kondenzacija, iz čvrstog u tekuće taljenje, iz tekućeg u čvrsto kristalizacija, iz čvrstog u plinovito sublimacija, a iz plinovitog u čvrsto resublimacija.
Promjene agregacijskih stanja tvari proučit ćemo na primjeru prijelaza vode kroz sva tri agregacijska stanja pri atmosferskom tlaku.

Temperatura pri kojoj voda prelazi iz čvrstog agregacijskog stanja u tekuće, odnosno temperatura pri kojoj se led pretvara u vodu naziva se temperatura tališta.
Temperatura pri kojoj voda prelazi iz tekućeg agregacijskog stanja u plinovito, odnosno temperatura pri kojoj se voda pretvara u vodenu paru naziva se temperatura vrelišta.
Kao što je ranije spomenuto, temperatura tališta vode pri atmosferskom tlaku iznosi a temperatura vrelišta vode pri atmosferskom tlaku iznosi
Osobito je važan tlak pri kojemu dolazi do promjene agregacijskih stanja. Promjenom tlaka promijenit će se i temperatura tališta, odnosno temperatura vrelišta.
Postoje tvari koje se prijelazom iz tekućeg u čvrsto agregacijsko stanje stežu. Kod tih tvari povećanjem tlaka raste temperatura tališta. Jedna je od tih tvari živa. Temperatura tališta žive veća je pri višem tlaku.
Nekim se tvarima prijelazom iz tekućeg agregacijskog stanja u čvrsto povećava volumen. Na primjer, kada voda prelazi iz tekućeg agregacijskog stanja u čvrsto, nastali led imat će veći volumen nego voda od koje je nastao. Kod vode se povećanjem tlaka smanjuje temperatura tališta.
Pažljivo proučite dijagram ovisnosti termodinamičke temperature o dovedenoj toplini!
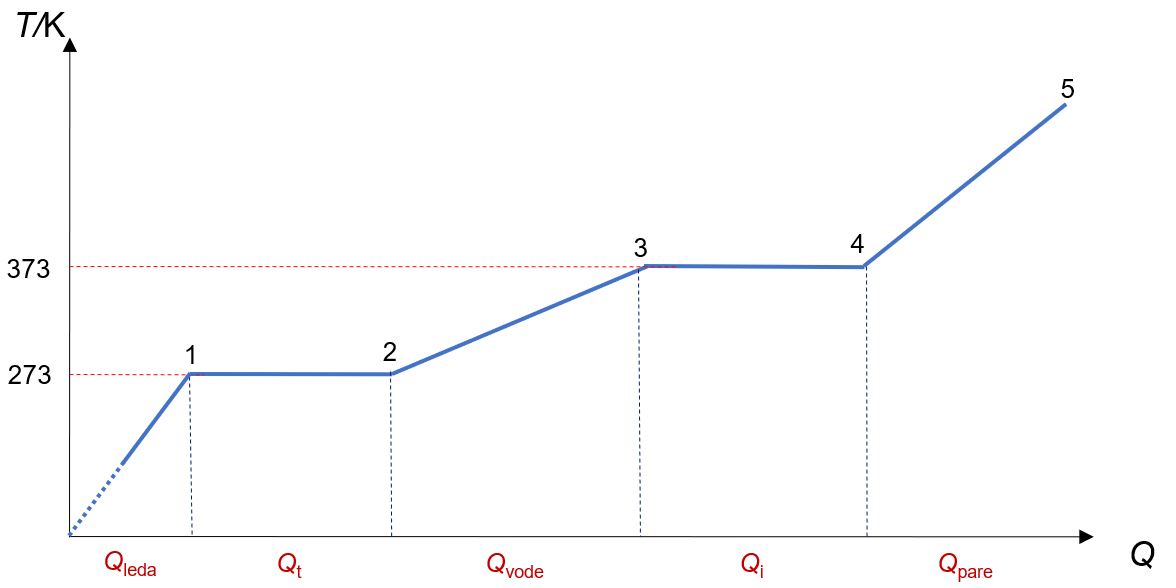
Dijagram prikazuje ovisnost termodinamičke temperature o količini dovedene topline za prijelaz vode kroz sva tri agregacijska stanja.
ishodište - 1
Ovaj dio dijagrama pokazuje ovisnost temperature o količini dovedene topline dok se voda nalazi u čvrstom stanju. Iz dijagrama je vidljivo da je ta ovisnost proporcionalna.
Količina topline kojom se zagrijava led dobije se pomoću izraza za toplinu koju smo naučili u jedinici 2.1. Unutarnja energija i toplina.
1 - 2
U ovom dijelu dijagrama vidljivo je da se dovođenjem topline ne povećava temperatura. Do sada ste možda pretpostavljali kako dovođenje topline nekom tijelu uvijek uzrokuje povećanje njegove temperature. No, tomu nije uvijek tako. Pri prijelazu vode iz čvrstog agregacijskog stanja u tekuće, dovođenje topline NE UZROKUJE povećanje temperature leda.
Toplina koju neka količina tvari mora primiti iz okoline kako bi iz čvrstog agregacijskog stanja prešla u tekuće naziva se latentna toplina taljenja.
Sva dovedena toplina utroši se na promjenu agregatnog stanja, pri čemu temperatura ostaje nepromijenjena.
Ako se proces događa u obrnutom smjeru, ta će se energija osloboditi.
Zašto je tomu tako?
Poznato je da se dovođenjem topline čvrstim tijelima povećava i njihova unutarnja energija. Titranje molekula u tijelima postaje brže i samim time temperatura tijela sve je veća. Međutim, u jednom trenutku titranje molekula postane toliko jako da se molekule "izvuku" izvan dometa privlačnih međumolekulskih sila. Pritom je brzina molekula, kao i temperatura, ostala nepromijenjena jer se sva dovedena toplina utrošila na svladavanje privlačnih sila među molekulama.
Latentna toplina taljenja dana je jednadžbom:
Veličina
je masa leda, a
je specifična latentna toplina taljenja.
Mjerna jedinica za specifičnu latentnu toplinu taljenja jest
ili
Specifična latentna toplina taljenja jest energija potrebna da masa čvrste tvari pri stalnom tlaku i temperaturi u potpunosti prijeđe u tekućinu.
Koliko je topline potrebno da se komad leda mase
potpuno pretvori u vodu?
Pomoć:
Za rješavanje ovog zadatka treba koristiti formulu za latentnu toplinu taljenja. Pri rješavanju zadatka valja paziti na temperaturu leda. Led se nalazi na i spreman je za taljenje.
Postupak:
2 - 3
Ovaj dio dijagrama prikazuje ovisnost temperature
o količini dovedene topline
vodi. Vidljivo je iz dijagrama da je ta ovisnost proporcionalna.
Količina topline kojom se zagrijava voda dobije se pomoću formule:
3 - 4
Dijagram u ovom dijelu prikazuje dovođenje topline bez promjene temperature. Sva toplina utrošena je na promjenu agregacijskog stanja vode iz tekućeg u plinovito stanje, odnosno u vodenu paru, i ta se toplina naziva latentna toplina isparavanja.
Latentna toplina isparavanja može se objasniti na sličan način kao i latentna toplina taljenja.
Toplina koju neka količina tvari mora primiti iz okoline kako bi iz tekućeg agregacijskog stanja prešla u plinovito naziva se latentna toplina isparavanja i dana je formulom:
Oznaka
predstavlja masu tvari, a
specifičnu latentnu toplinu isparavanja.
Mjerna jedinica za specifičnu latentnu toplinu isparavanja jest
ili
Specifična latentna toplina isparavanja jest energija potrebna kako bi masa
neke tekućine pri stalnom tlaku i temperaturi u potpunosti isparila.
4 - 5
Dijagram u ovom dijelu prikazuje ovisnost temperature o količini dovedene topline za vodenu paru. Vidljivo je iz dijagrama kako je ta ovisnost proporcionalna.
Količina topline kojom se zagrijava vodena para izračunava se pomoću formule:
Tablica tališta i latentnih toplina taljenja nekih tvari
| Tvar | Talište pri normiranom tlaku | |
|---|---|---|
| aluminij | ||
| kositar | ||
| olovo | ||
| led | ||
| željezo | ||
| živa |
Tablica vrelišta i latentnih toplina isparavanja nekih tvari
| Tvar | Vrelište pri normiranom tlaku |
|
|---|---|---|
| alkohol | ||
| dušik | ||
| eter | ||
| kisik | ||
| voda | ||
| živa |
Prisjetite se iz Fizike 1 što je normirani tlak i koliko iznosi!
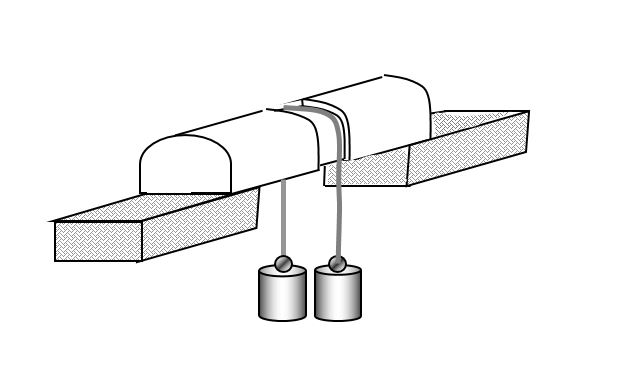
Regelacija leda
Preko komada leda prebaci se žica koja je s obiju strana opterećena utegom. Zbog promjene u tlaku ispod same žice, dolazi do taljenja leda koji se potom iznad žice pri atmosferskom tlaku ponovo kristalizira.
U ovoj jedinici naučili smo nazive prijelaza agregacijskih stanja i definirali pojmove latentne topline taljena i isparavanja.
Prijelaz iz tekućeg agregacijskog stanja u plinovito naziva se isparavanje, iz plinovitog u tekuće kondenzacija, iz čvrstog u tekuće taljenje, iz tekućeg u čvrsto kristalizacija, iz čvrstog u plinovito sublimacija, a iz plinovitog u čvrsto resublimacija.
Toplina koju neka količina tvari mora primiti iz okoline kako bi iz čvrstog agregacijskog stanja prešla u tekuće naziva se latentna toplina taljenja i dana je formulom:
Toplina koju neka količina tvari mora primiti iz okoline kako bi iz tekućeg agregacijskog stanja prešla u plinovito naziva se latentna toplina isparavanja i dana je formulom:
Ispravno razvrstajte nazive prijelaza agregacijskih stanja.
| Prijelaz iz tekućeg u plinovito naziva se | |
| Prijelaz iz plinovitog u tekuće naziva se | |
| Prijelaz iz čvrstog u plinovito naziva se | |
| Prijelaz iz plinovitog u čvrsto naziva se | |
| Prijelaz iz tekućeg u čvrsto naziva se |
Latentna toplina jest toplina koju dovodimo tijelu: