Alkalijski metali i halogeni elementi
- usporediti fizikalna i kemijska svojstva metala, polumetala i nemetala s njihovim položajem u periodnom sustavu elemenata
- imenovati glavne skupine elemenata u periodnom sustavu elemenata
- opisati i objasniti neka zajednička fizikalna i kemijska svojstva metala, posebice natrija i njegovih spojeva
- opisati i objasniti neka zajednička fizikalna i kemijska svojstva nemetala, posebice klora i njegovih spojeva
- istražiti uporabu spojeva alkalijskih metala i halogenih elemenata te njihov utjecaj na okoliš
- objasniti ulogu biogenih elemenata u organizmu
- navesti metode zbrinjavanja i odlaganja štetnih tvari.
Rasprostranjenost elemenata u prirodi
Kemijski su elementi različito rasprostranjeni u prirodi.
Od svih kemijskih elemenata u svemiru su najzastupljeniji vodik i helij.
Tako je i naše Suncem kao i druge zvijezdem sastavljeno uglavnom od vodika.
Planeti imaju drukčiji kemijski sastav od zvijezda.
U Zemljinoj kori najviše ima kisika i silicija, a u zraku dušika i kisika.
U živim organizmima najviše ima kisika, ugljika i vodika.
Takve elemente koji izgrađuju živa bića nazivamo biogenim elementima.
Oni su nužni za nastanak i opstanak života.
Ostali biogeni elementi su klor, natrij, sumpor, kalcij, fosfor, kalij, magnezij, dušik i željezo.
Neki su elementi prisutni u vrlo malim količinama (bakar, brom, cink, fluor i jod), ali njihov nedostatak u tijelu uzrokuje razne bolesti.
Rasprostranjenost elemenata u prirodi
Kemijski su elementi različito rasprostranjeni u prirodi. Od svih kemijskih elemenata u svemiru su najzastupljeniji vodik i helij. Tako je i naše Sunce, kao i druge zvijezde, sastavljeno uglavnom od vodika, a planeti imaju drukčiji kemijski sastav. U Zemljinoj kori najviše ima kisika i silicija, a u zraku dušika i kisika.
U živim organizmima najviše ima kisika, ugljika i vodika. Takve elemente koji izgrađuju živa bića nazivamo biogenim elementima. Oni su nužni za nastanak i opstanak života. Ostali su biogeni elementi klor, natrij, sumpor, kalcij, fosfor, kalij, magnezij, dušik i željezo. Neki su elementi prisutni u vrlo malim količinama (bakar, brom, cink, fluor i jod), ali njihov nedostatak u tijelu uzrokuje razne bolesti.
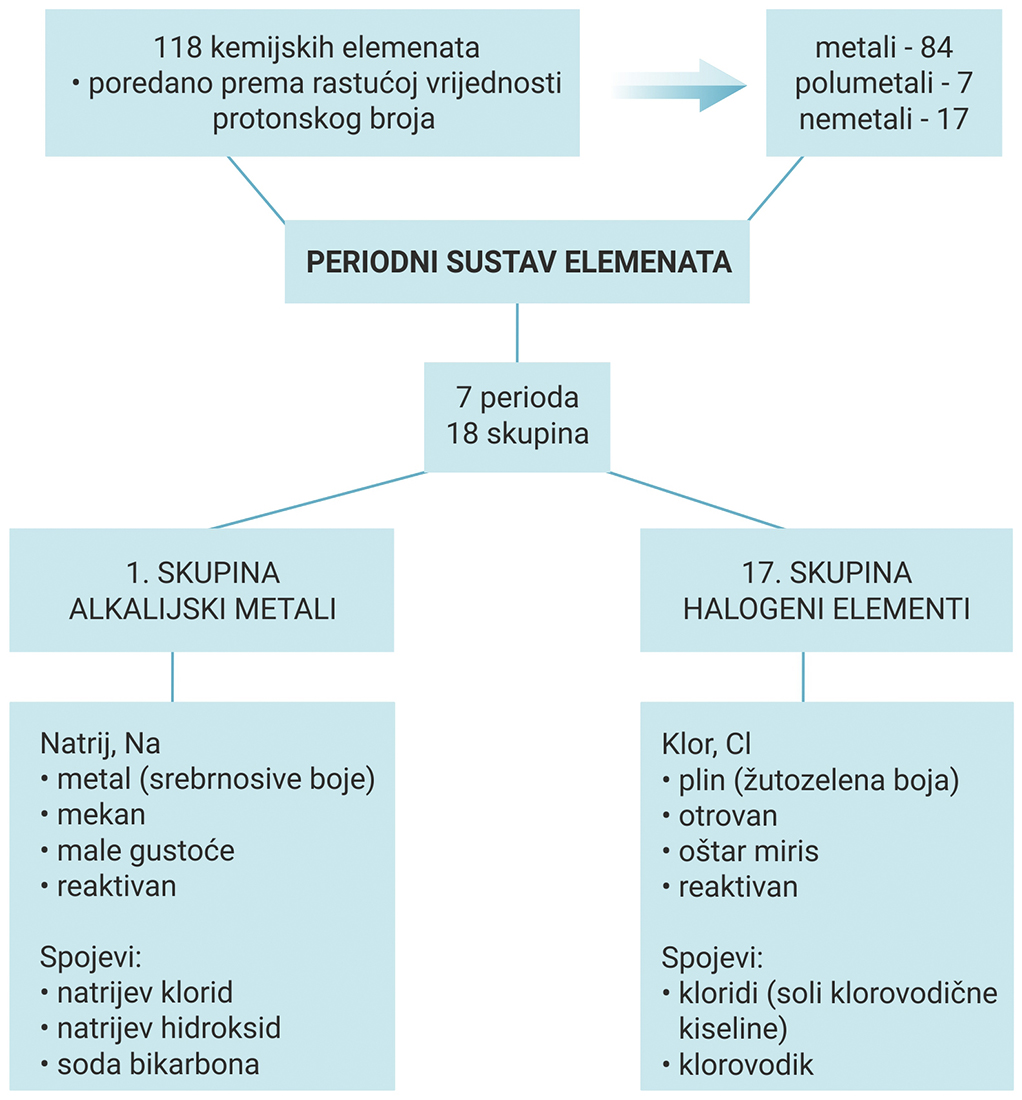
Položaj elemenata u periodnom sustavu
U periodni sustav elemenata poredano je 118 kemijskih elementa.
Od toga su u prirodi nađena 93 elementa, a ostali su dobiveni umjetnim putem u laboratoriju.
Periodni sustav elemenata sastoji se od 7 perioda (vodoravni redovi)
i 18 skupina (uspravni stupci).
Istražite i proučite sadržaje o kemijskim elementima u digitalnoj inačici periodnog sustava elemenata dostupnoj na mrežnoj stranici EdTED.
Položaj elemenata u periodnom sustavu
U periodni sustav elemenata poredano je 118 kemijskih elementa. Od toga su u prirodi nađena 93, a ostali su elementi dobiveni umjetnim putem u laboratoriju.
Periodni sustav elemenata sastoji se od 7 perioda (vodoravni redovi) i 18 skupina (uspravni stupci). Istražite i proučite sadržaje o kemijskim elementima u digitalnoj inačici periodnog sustava elemenata dostupnoj na mrežnoj stranici EdTED.
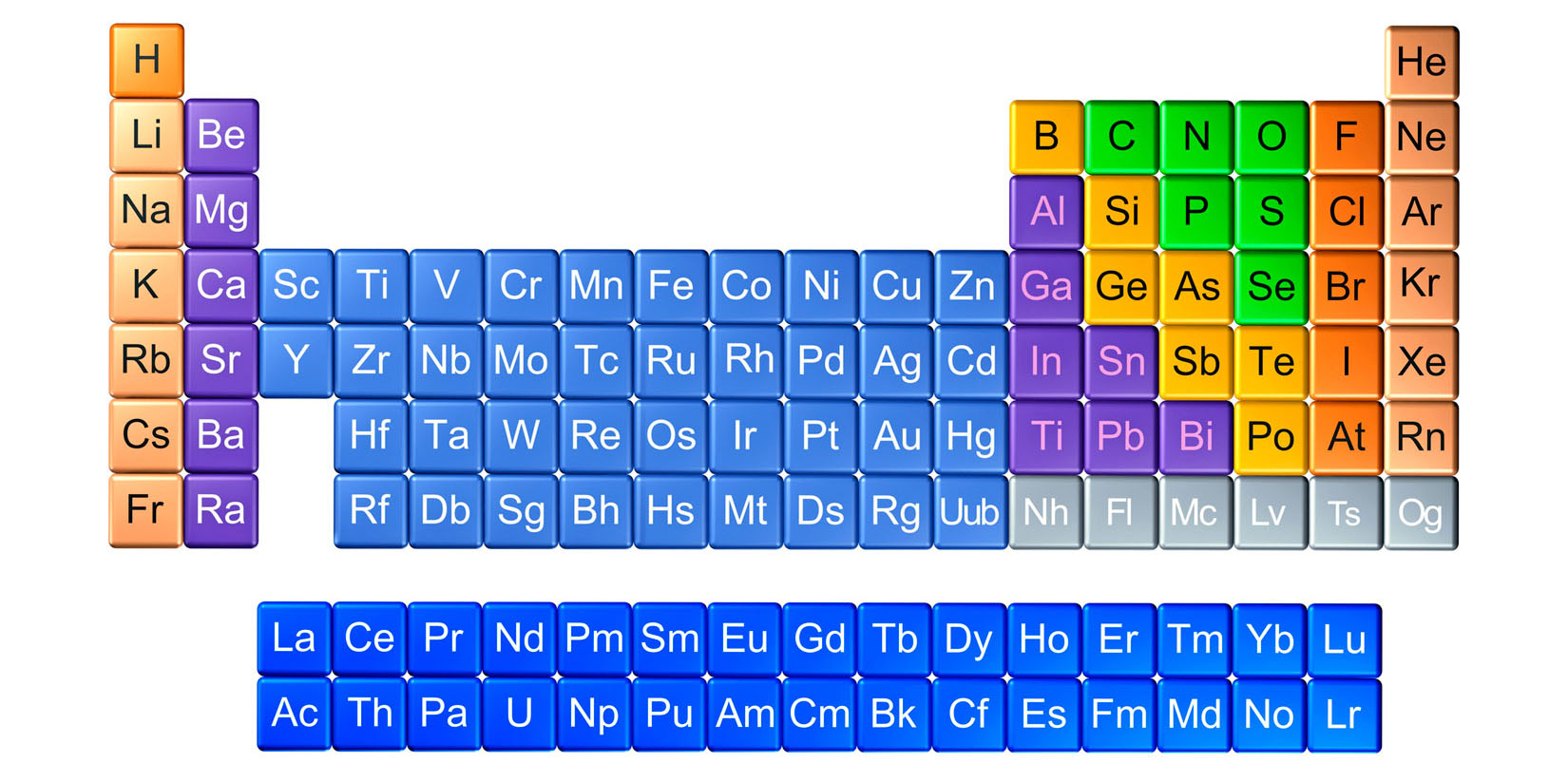
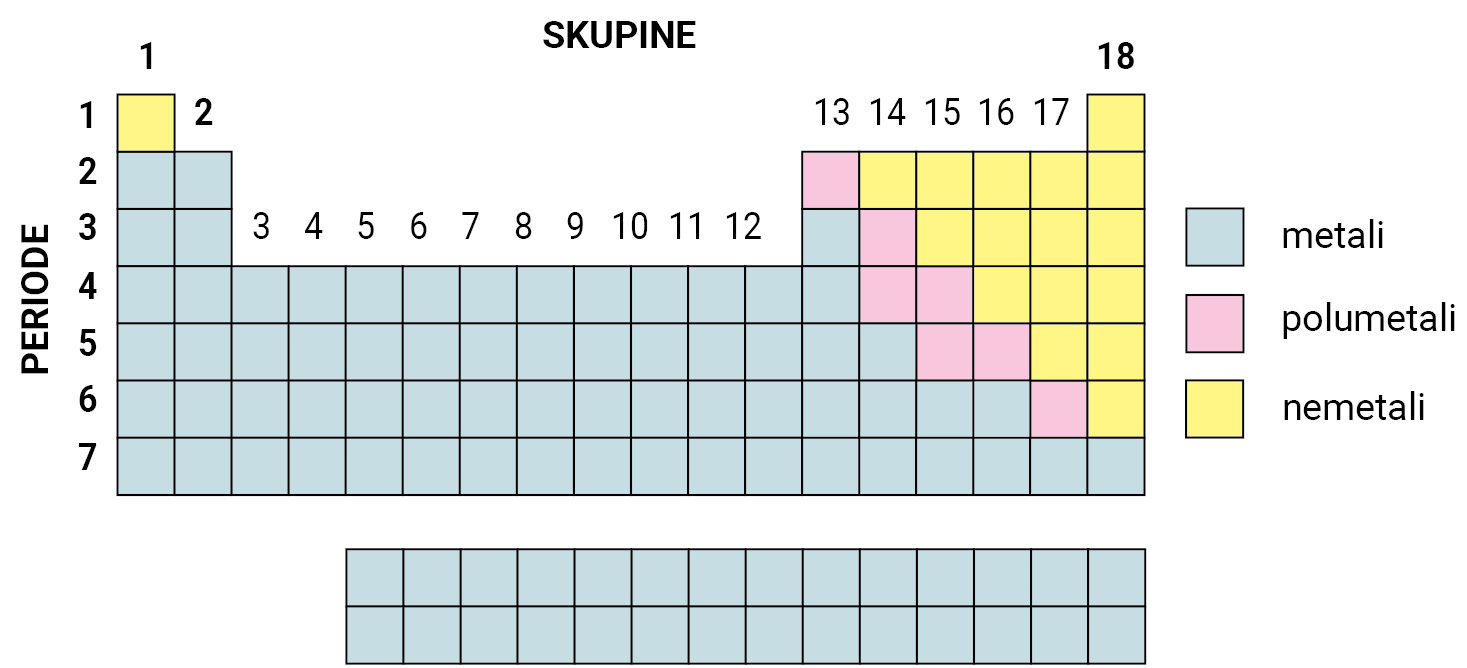
Unutar periodnog sustava elemente dijelimo na metale ili kovine
koji se nalaze na lijevoj strani i u sredini periodnog sustava,
na nemetale ili nekovine na desnoj strani periodnog sustava,
na polumetale ili polukovine koji su smješteni na granici između metala i nemetala.
Unutar periodnog sustava elemente dijelimo na metale ili kovine koji se nalaze na lijevoj strani i u sredini periodnog sustava, na nemetale ili nekovine na desnoj strani periodnog sustava i na polumetale ili polukovine koji su smješteni na granici između metala i nemetala.
Svojstva elemenata poredanih u periodnom sustavu periodički se ponavljaju,
što znači da unutar iste periode elementi pravilno mijenjaju svoja svojstva od izrazito metalnih do izrazito nemetalnih svojstava.
Tako se u svakoj skupini elementi sličnih svojstava nalaze jedan ispod drugog.
Zbog toga elementi iste skupine periodnog sustava imaju slična kemijska svojstva.
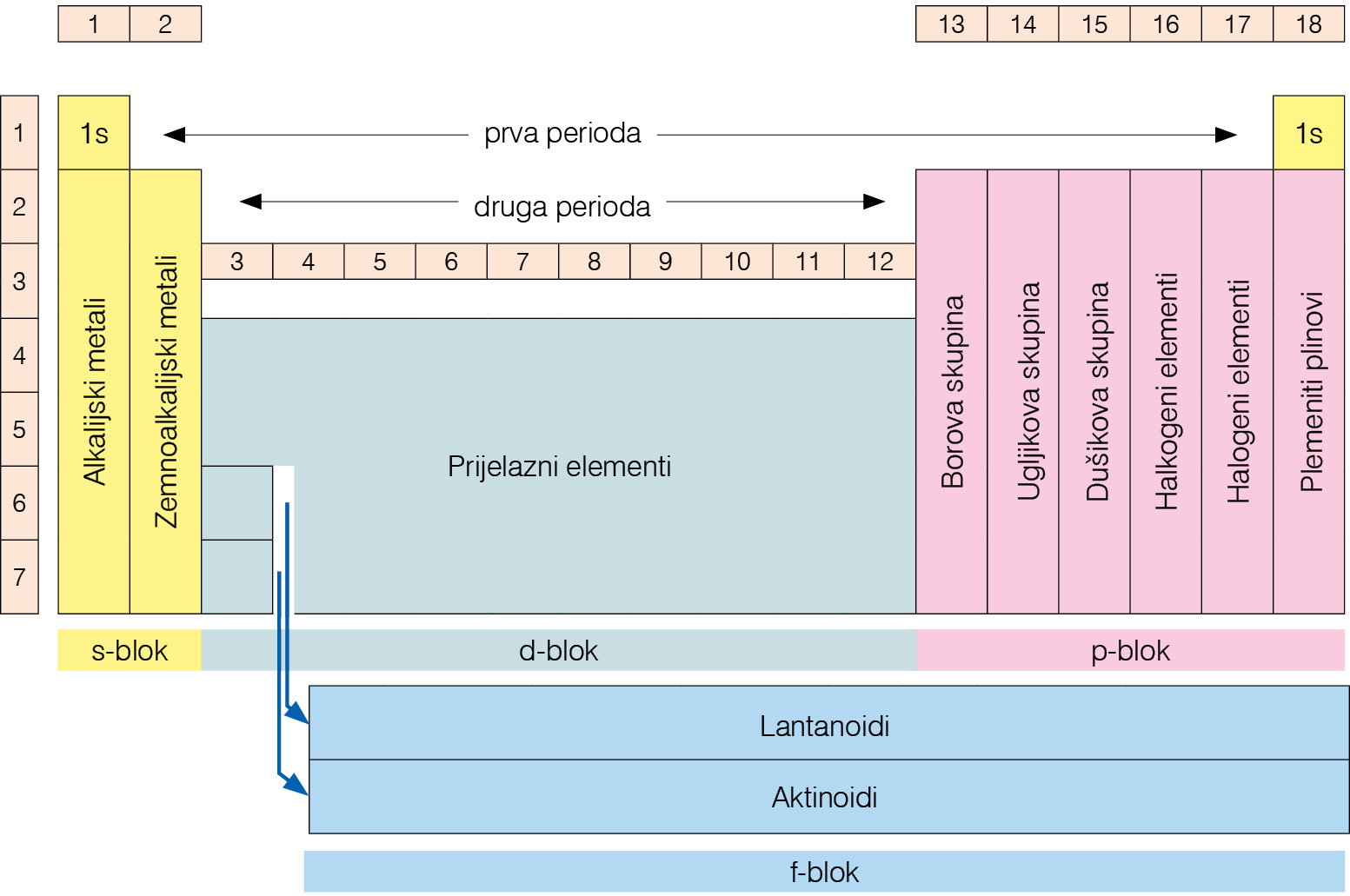
Skupine su označene brojevima od 1 do 18. Uz označavanje brojevima neke skupine imaju i posebna imena.
Svojstva elemenata poredanih u periodnom sustavu periodički se ponavljaju, što znači da unutar iste periode elementi pravilno mijenjaju svoja svojstva od izrazito metalnih do izrazito nemetalnih. Tako se u svakoj skupini elementi sličnih svojstava nalaze jedan ispod drugog. Zbog toga elementi iste skupine periodnog sustava imaju slična kemijska svojstva. Skupine su označene brojevima od 1 do 18. Uz označavanje brojevima neke skupine imaju i posebna imena.
Imena pojedinih skupina elemenata u periodnom sustavu:
- Alkalijski metali su elementi 1. skupine.
Ime su dobili po tome što s vodom daju jake lužine (alkalije). - Zemnoalkalijski metali su elementi 2. skupine.
Također čine jake lužine (alkalije),
a s obzirom na to da su njihovi spojevi česti sastojci Zemljine kore,
nazivaju se zemnoalkalijski elementi. - Prijelazni metali su elementi od 3. do 11. skupine.
Nemaju ujednačena svojstva pa su neki vrlo reaktivni,
a neki inertni (plemeniti metali). - Elementi 13., 14. i 15. skupine dobili su ime po prvom elementu u skupini i nazivamo ih borova, ugljikova i dušikova skupina elemenata.
- Halkogeni elementi su elementi 16. skupine.
Ime upućuje na to da ulaze u sastav ruda. - Halogeni elementi su elementi 17. skupine.
Naziv halogen upućuje na to da s metalima tvore soli. - Plemeniti plinovi su elementi 18. skupine.
Pri standardnim uvjetima svi su u plinovitom stanju.
Ime su dobili prema svojstvu da, u pravilu, ne reagiraju s drugim elementima.
Imena pojedinih skupina elemenata u periodnom sustavu:
- Alkalijski metali elementi su 1. skupine. Ime su dobili po tome što s vodom daju jake lužine (alkalije).
- Zemnoalkalijski metali elementi su 2. skupine. Također čine jake lužine (alkalije), a s obzirom na to da su njihovi spojevi česti sastojci Zemljine kore, nazivaju se zemnoalkalijski elementi.
- Prijelazni metali elementi su od 3. do 11. skupine. Nemaju ujednačena svojstva pa su neki vrlo reaktivni, a neki inertni (plemeniti metali).
- Elementi 13., 14. i 15. skupine dobili su ime po prvom elementu u skupini i nazivamo ih borova, ugljikova i dušikova skupina elemenata.
- Halkogeni elementi jesu elementi 16. skupine. Ime upućuje na to da ulaze u sastav ruda.
- Halogeni elementi jesu elementi 17. skupine. Naziv halogen upućuje na to da s metalima tvore soli.
- Plemeniti plinovi elementi su 18. skupine. Pri standardnim uvjetima svi su u plinovitom stanju. Ime su dobili prema svojstvu da, u pravilu, ne reagiraju s drugim elementima.
Alkalijski metali
Alkalijski metali jesu metali prve skupine, a obuhvaćaju metale litij, natrij, kalij, rubidij, cezij i francij.
Francij je radioaktivni kemijski element, posljednji u skupini alkalijskih metala.
Svi su male gustoće i vrlo mekani pa se mogu rezati nožem.
Kemijski su izrazito reaktivni i u prirodi ne postoje u elementarnom stanju.
Na zraku nisu postojani.
Alkalijski metali
| elementarna tvar | litij | natrij | kalij | rubidij | cezij |
|---|---|---|---|---|---|
| kemijski simbol | |||||
| talište | 180 °C | 98 °C | 63 °C | 39 °C | 28 °C |
| vrelište | 1370 °C | 883 °C | 776 °C | 696 °C | 708 °C |
| gustoća | 0,53 g/cm3 | 0,97 g/cm3 | 0,86 g/cm3 | 1,53 g/cm3 | 1,87 g/cm3 |
| boja plamena | crvena | žuta | svijetlo ljubičasta | ljubičasta | plava |
Alkalijski metali čuvaju se u petroleju.
Čuvaju se u petroleju ili čak u zataljenim ampulama
da ne bi došli u kontakt sa zrakom.
Ne mogu se čuvati u vodi jer s vodom burno reagiraju.
Reakcija je burnija što je alkalijski metal niže u skupini.
Zbog toga je cezij najreaktivniji metal u prirodi.
S vodom daju jake lužine ili alkalije zbog čega se i zovu alkalijski metali.
Jake lužine nagrizaju kožu i u radu s njima treba biti oprezan.
Čuvaju se u petroleju ili čak u zataljenim ampulama da ne bi došli u kontakt sa zrakom. Ne mogu se čuvati u vodi jer s vodom burno reagiraju. Reakcija je burnija što je alkalijski metal niže u skupini. Zbog toga je cezij najreaktivniji metal u prirodi. S vodom daju jake lužine ili alkalije zbog čega se i zovu alkalijski metali. Jake lužine nagrizaju kožu pa pri radu s njima treba biti oprezan.
Alkalijski metali su u kemijskim spojevima uvijek jednovalentni
i grade mnoge soli s nemetalima.
Alkalijski i zemnoalkalijski metali imaju zajedničko svojstvo da boje plamen.
Alkalijski su metali u kemijskim spojevima uvijek jednovalentni i grade mnoge soli s nemetalima.
Zajedničko svojstvo alkalijskih i zemnoalkalijskih metala jest da boje plamen.
Natrij
Ispitajmo pokusom neka svojstva alkalijskih metala.
Natrij je rasprostranjen u prirodi.
U Zemljinoj kori maseni udio natrija iznosi 3 %.
Najrasprostranjeniji spojevi natrija u prirodi jesu:
- natrijev klorid –
- natrijev –
- i natrijev nitrat – , poznat i kao čilska salitra.
Natrij se u elementarnom stanju dobiva elektrolizom taljevine natrijeva klorida.
Natrijev hidroksid ili kaustična soda, NaOH, bijela je, čvrsta neprozirna tvar
koja na zraku upija vlagu.
U dodiru s kožom nagriza je i stvara opekline.
Zato se natrijev hidroksid ne smije hvatati rukama.
Dobro se otapa u vodi, a vodena je otopina jaka lužina.
Ubraja se u najvažnije proizvode kemijske industrije.
Najčešće se proizvodi u obliku granula.
Koristi se u proizvodnji sapuna, deterdženata, boja i drugdje.
Natrij je rasprostranjen u prirodi. U Zemljinoj kori maseni udio natrija
iznosi 3 %.
Najrasprostranjeniji spojevi natrija u prirodi su natrijev klorid, , natrijev sulfat, , i natrijev nitrat, , poznat i kao čilska salitra. Natrij se u elementarnom stanju dobiva elektrolizom taljevine natrijeva klorida.
Natrijev hidroksid ili kaustična soda, , bijela je, čvrsta neprozirna tvar koja na zraku upija vlagu. U dodiru s kožom nagriza je i stvara opekline, stoga se natrijev hidroksid ne smije hvatati rukama. Dobro se otapa u vodi, a vodena je otopina jaka lužina. Ubraja se u najvažnije proizvode kemijske industrije. Najčešće se proizvodi u obliku granula. Koristi se u proizvodnji sapuna, deterdženata, boja i drugdje.
Natrijev hidrogenkarbonat ili soda bikarbona, NaHCO3, čvrsta je, bijela tvar,
dobro topljiva u vodi.
Njezina je vodena otopina slaba lužina.
Koristi se u proizvodnji praška za pecivo, za ublažavanje žgaravice, u proizvodnji gaziranih pića i dr.
Natrijev hidrogenkarbonat ili soda bikarbona, , čvrsta je, bijela tvar, dobro topljiva u vodi. Njezina je vodena otopina slaba lužina. Koristi se u proizvodnji praška za pecivo, za ublažavanje žgaravice, u proizvodnji gaziranih pića i dr.
Natrijev nitrat ili čilska salitra, NaNO3,
čvrsta je, bijela tvar,
dobro topljiva u vodi.
Javlja se u prirodi, a najveća su nalazišta u Čileu.
Koristi se u proizvodnji gnojiva te za dobivanje dinamita, baruta, stakla i dr.
Natrijev nitrat ili čilska salitra, NaNO3, čvrsta je, bijela tvar,
dobro topljiva u vodi. Javlja se u prirodi, a najveća su nalazišta u Čileu.
Koristi se u proizvodnji gnojiva te za dobivanje dinamita, baruta, stakla i dr.
Egipćani su koristili sodu u postupku mumificiranja
i to za čuvanje tijela od raspadanja.
Soda, salitra i potaša narodna su imena za neke kalijeve i natrijeve soli.
Smatra se da su ih ljudi poznavali još od drevnih vremena.
Istražite na mrežnim stranicama koji je sastav tih soli, za što se danas koriste i gdje su se koristile u prošlosti.

Postupak mumificiranja
Egipćani su koristili sodu u postupku mumificiranja i to za čuvanje tijela od raspadanja.
Soda, salitra i potaša narodna su imena nekih kalijevih i natrijevih soli. Smatra se da su ih ljudi poznavali još od drevnih vremena.
Istražite na mrežnim stranicama koji je sastav tih soli, za što se danas koriste i u koje su se svrhe koristile u prošlosti.
Halogeni elementi
Halogeni elementi jesu elementi 17. skupine i u periodnom sustavu nalaze se odmah pored plemenitih plinova.
Ovoj skupini pripadaju: fluor, klor, brom, jod i slabo ispitani radioaktivni element astat.
Halogeni elementi su tipični nemetali i unutar skupine vrlo je izražena sličnost kemijskih svojstava.
Fluor je svjetložuti plin, klor je žutozeleni plin, brom je crvenosmeđa tekućina, a jod čvrsta sivocrna tvar.
U elementarnom stanju grade dvoatomne molekule.
Halogeni elementi
Halogeni su elementi tipični nemetali i unutar skupine vrlo je izražena sličnost kemijskih svojstava.
Fluor je svjetložuti plin, klor je žutozeleni plin, brom je crvenosmeđa tekućina, a jod čvrsta sivocrna tvar. U elementarnom stanju grade dvoatomne molekule.
| elementarna tvar | fluor | klor | brom | jod |
|---|---|---|---|---|
| kemijski simbol | ||||
| talište | –219 °C | –101 °C | –7 °C | 113,5 °C |
| vrelište | –188 °C | –34 °C | 58,8 °C | 184,4 °C |
| gustoća | 0,0016 g/cm3 | 0,0029 g/cm3 | 3,1 g/cm3 | 4,9 g/cm3 |
Zbog velike reaktivnosti halogene elemente u prirodi nalazimo isključivo u spojevima. Reaktivnost im se smanjuje kroz skupinu.
Fluor je najreaktivniji nemetal u prirodi.
Spojevi fluora sastavni su dio zubne cakline i kostiju.
Svi se halogeni elementi izravno spajaju s metalima i daju soli halogenide.
Klor
Klora, kao ni ostalih halogenih elemenata, nema u prirodi u slobodnom stanju zbog njegove velike reaktivnosti.
Nalazi se najčešće u kloridima (natrijev korid – NaCl, kalijev klorid – KCl i magnezijev klorid – MgCl2) kojih ima u morskoj vodi.
Klor je biogeni element, pa se u obliku iona nalazi u svim živim bićima.
Nalazi se u sastavu želučane kiseline u obliku klorovodične kiseline.
Klor je žutozeleni plin oštra i bockajuća mirisa i vrlo je otrovan.
Ako je njegov volumni udio u zraku samo 0,1 %, već nekoliko udisaja može biti smrtonosno.
Klor izravno reagira s većinom metala i nemetala te daje kloride.
Koristi se kao sirovina u nizu industrijskih procesa
te za izbjeljivanje tekstila i papira.
Važna primjena klora vezana je uz dezinfekciju vode.
Natrijev klorid, NaCl, kemijski je spoj poznat pod nazivom kuhinjska sol.
Najvažniji izvor natrijeva klorida jest morska voda u kojoj je maseni udio oko 2,8 %. U Zemljinoj kori nalazi se u naslagama kao kamena sol.
Industrijski se dobiva isparavanjem morske vode u plitkim bazenima u solanama
ili kopanjem iz rudnika kamene soli.
Osim kao začin koristi se i za konzerviranje hrane te za posipavanje cesta.
Natrijev klorid važan je sastojak fiziološke otopine. Istražite što je fiziološka otopina i gdje se koristi.
Zbog velike reaktivnosti halogene elemente u prirodi nalazimo isključivo u spojevima. Reaktivnost im se smanjuje kroz skupinu. Fluor je najreaktivniji nemetal u prirodi. Spojevi fluora sastavni su dio zubne cakline i kostiju. Svi se halogeni elementi izravno spajaju s metalima te daju soli halogenide.
Klor
Klora, kao ni ostalih halogenih elemenata, nema u prirodi u slobodnom stanju zbog njegove velike reaktivnosti. Nalazi se najčešće u kloridima (natrijev korid, , kalijev klorid, , i magnezijev klorid, ) kojih ima u morskoj vodi. Klor je biogeni element pa se u obliku iona nalazi u svim živim bićima. Sastavni je dio želučane kiseline u obliku klorovodične kiseline.
Klor je žutozeleni plin oštra i bockajuća mirisa i vrlo je otrovan. Ako je njegov volumni udio u zraku samo 0,1 %, već nekoliko udisaja može biti smrtonosno.
Klor izravno reagira s većinom metala i nemetala dajući kloride. Koristi se kao sirovina u nizu industrijskih procesa te za izbjeljivanje tekstila i papira. Važna primjena klora vezana je uz dezinfekciju vode.
Natrijev klorid, NaCl, kemijski je spoj poznat i pod nazivom kuhinjska sol. Najvažniji izvor natrijeva klorida jest morska voda u kojoj je maseni udio oko 2,8 %. U Zemljinoj kori nalazi se u naslagama kao kamena sol. Industrijski se dobiva isparavanjem morske vode u plitkim bazenima u solanama ili kopanjem iz rudnika kamene soli. Osim kao začin koristi se i za konzerviranje hrane te za posipavanje cesta.
Klorovodik, HCl, bezbojan je otrovni plin, oštra mirisa.
Dobiva se izravnom reakcijom vodika i klora.
Smjesa vodika i klora u volumnom omjeru 1 : 1 naziva se klorni praskavac i eksplozivna je.
Klorovodik je dobro topljiv u vodi.
Dobivena vodena otopina je jaka kiselina i naziva se klorovodična kiselina.
U svakodnevnom životu nazivamo je i solna kiselina
jer se može dobiti posebnim kemijskim postupkom iz kuhinjske soli.
Klorovodik, , bezbojan je otrovni plin, oštra mirisa. Dobiva se izravnom reakcijom vodika i klora. Smjesa vodika i klora u volumnom omjeru 1 : 1 naziva se klorni praskavac i eksplozivna je.
Klorovodik je dobro topljiv u vodi. Dobivena vodena otopina jaka je kiselina i naziva se klorovodična kiselina. U svakodnevnom životu nazivamo je i solnom kiselinom jer se može dobiti posebnim kemijskim postupkom iz kuhinjske soli.