Zakon o očuvanju mase i jednadžbe kemijskih reakcija
- pokusom dokazati zakon o očuvanju mase
- primijeniti pravila pisanja kemijske jednadžbe (odrediti mjesto pisanja reaktanata i produkata, funkciju strelice, oznake agregacijskih stanja)
- primijeniti zakon o očuvanju mase za izjednačavanje kemijskih jednadžbi
- odrediti kvantitativno i kvalitativno značenje kemijske jednadžbe.
Uvod
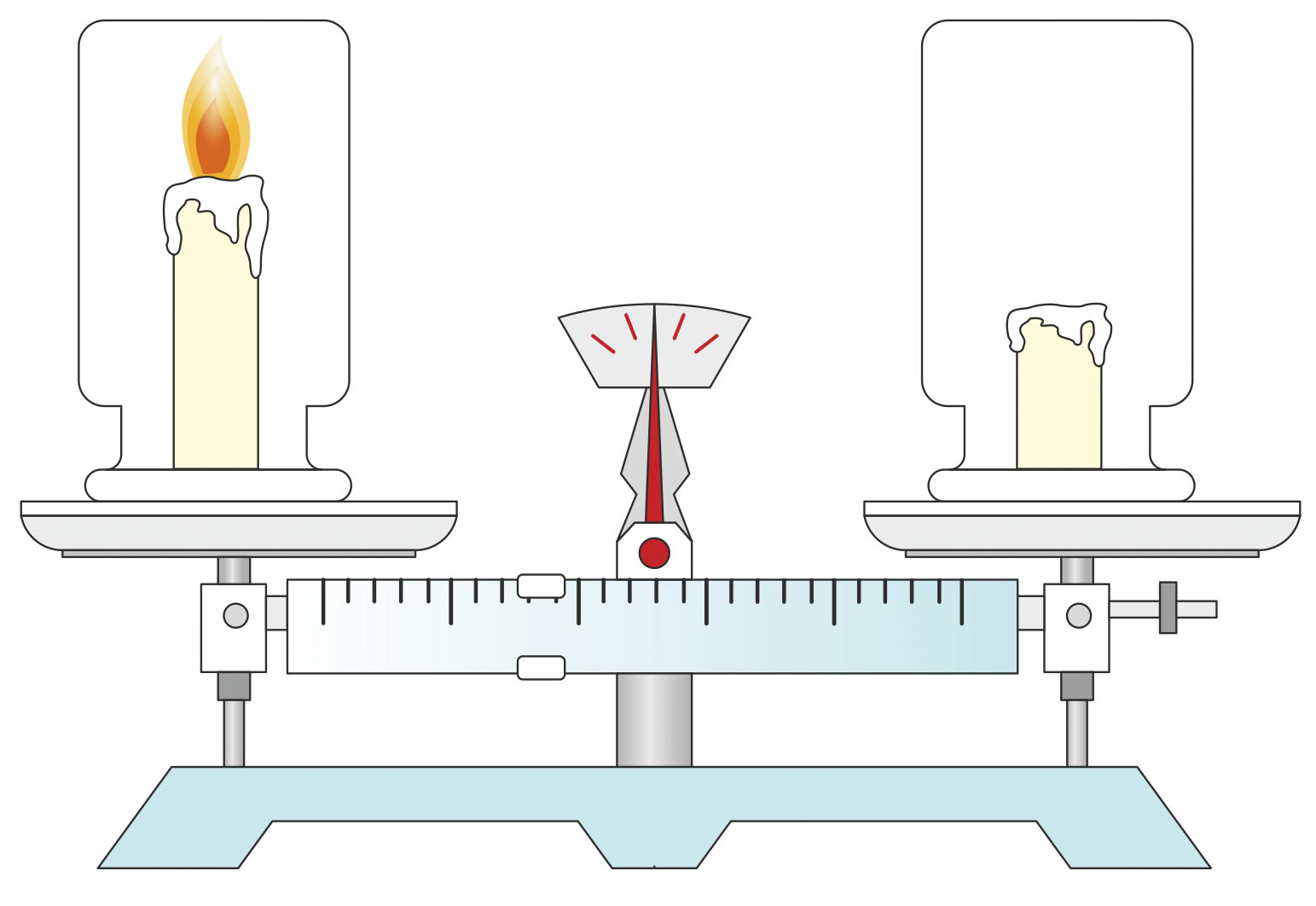
Zašto se tijekom gorenja svijeća smanjuje?
Zakon o očuvanju mase
Zašto se tijekom gorenja svijeća smanjuje?
Svijeća je napravljena od voska.
Sastojci voska su ugljik i vodik.
Kada svijeća gori, ugljik i vodik
kemijski se spajaju s kisikom iz zraka.
Pritom nastaju plinoviti ugljikov dioksid
i vodena para.
Tijekom gorenja svijeće količina voska se smanjuje.
Nastaju i oslobađaju se plinoviti produkti.
Na temelju vidljivih promjena mogli bismo reći
da tom reakcijom dolazi do gubitka mase.
Ali je li to istina?
Provjerit ćemo pokusom.
Poznato nam je da plinovite tvari imaju masu.
Stavimo stakleni cilindar sa svijećom prije gorenja na vagu.
Opet ga izvažimo nakon gorenja.
Vidjet ćemo da se masa cilindra nije promijenila.
Svijeća se smanjila.
Možemo zaključiti da je gorenjem svijeće masa ostala ista
(ostatak svijeće i plinovite tvari).
Zakon o očuvanju mase
Svijeća je napravljena od voska, a sastojci su voska ugljik i vodik. Kada svijeća gori, ugljik i vodik od kojih se sastoji vosak kemijski se spajaju s kisikom iz zraka i pritom nastaju plinoviti ugljikov(IV) oksid i vodena para.
Tijekom gorenja svijeće količina se voska smanjuje, a nastaju i oslobađaju se plinoviti produkti.
Na temelju vidljivih promjena mogli bismo reći da tom reakcijom dolazi do gubitka mase, ali je li to istina?
Poznato nam je da plinovite tvari imaju masu. Stavimo li stakleni cilindar sa svijećom prije gorenja na vagu te ga opet izvažemo nakon gorenja, vidjet ćemo da se masa cilindra nije promijenila, premda se svijeća smanjila.
Proučimo sljedeći primjer kemijske reakcije
u kojoj nastaje talog srebrova klorida.
Tijekom miješanja prozirnih otopina srebrova nitrata i natrijeva klorida
kao produkti nastaju bijeli talog srebrova klorida
i vodena otopina natrijeva nitrata.
Proučimo sljedeći primjer kemijske reakcije u kojoj nastaje talog srebrova klorida.
Tijekom miješanja prozirnih otopina srebrova nitrata i natrijeva klorida kao produkti nastaju bijeli talog srebrova klorida i vodena otopina natrijeva nitrata.
Mjerenjem i uspoređivanjem masa tvari
prije i nakon kemijske reakcije
uočili smo da je masa ostala nepromijenjena.
Ukupna masa tvari koje ulaze u kemijsku reakciju
jednaka je ukupnoj masi tvari koje nastaju tom reakcijom.
Ta se zakonitost naziva zakon o očuvanju mase
i temeljni je kemijski i prirodni zakon.
Taj su zakon, neovisno jedan o drugome,
otkrila i dokazala dva kemičara:
- ruski kemičar Mihail Vasiljevič Lomonosov 1748.
- francuski kemičar Antoine Laurent Lavoisier 1785. godine.
Mjerenjem i uspoređivanjem masa tvari prije i nakon kemijske reakcije uočili smo da je masa ostala nepromijenjena.
Spoznaja do koje smo došli na temelju rezultata izvedenih pokusa vrijedi za sve kemijske reakcije u zatvorenom sustavu.
Ukupna masa tvari koje ulaze u kemijsku reakciju jednaka je ukupnoj masi tvari koje nastaju tom reakcijom.
Ta se zakonitost naziva zakon o očuvanju mase i temeljni je kemijski i prirodni zakon.
Taj su zakon, neovisno jedan o drugome, otkrila i dokazala dva kemičara – ruski kemičar Mihail Vasiljevič Lomonosov 1748. i francuski kemičar Antoine Laurent Lavoisier 1785. godine.
Pokuse su izvodili mjerenjem i uspoređivanjem mase tvari koje reagiraju i nastaju nakon reakcije.
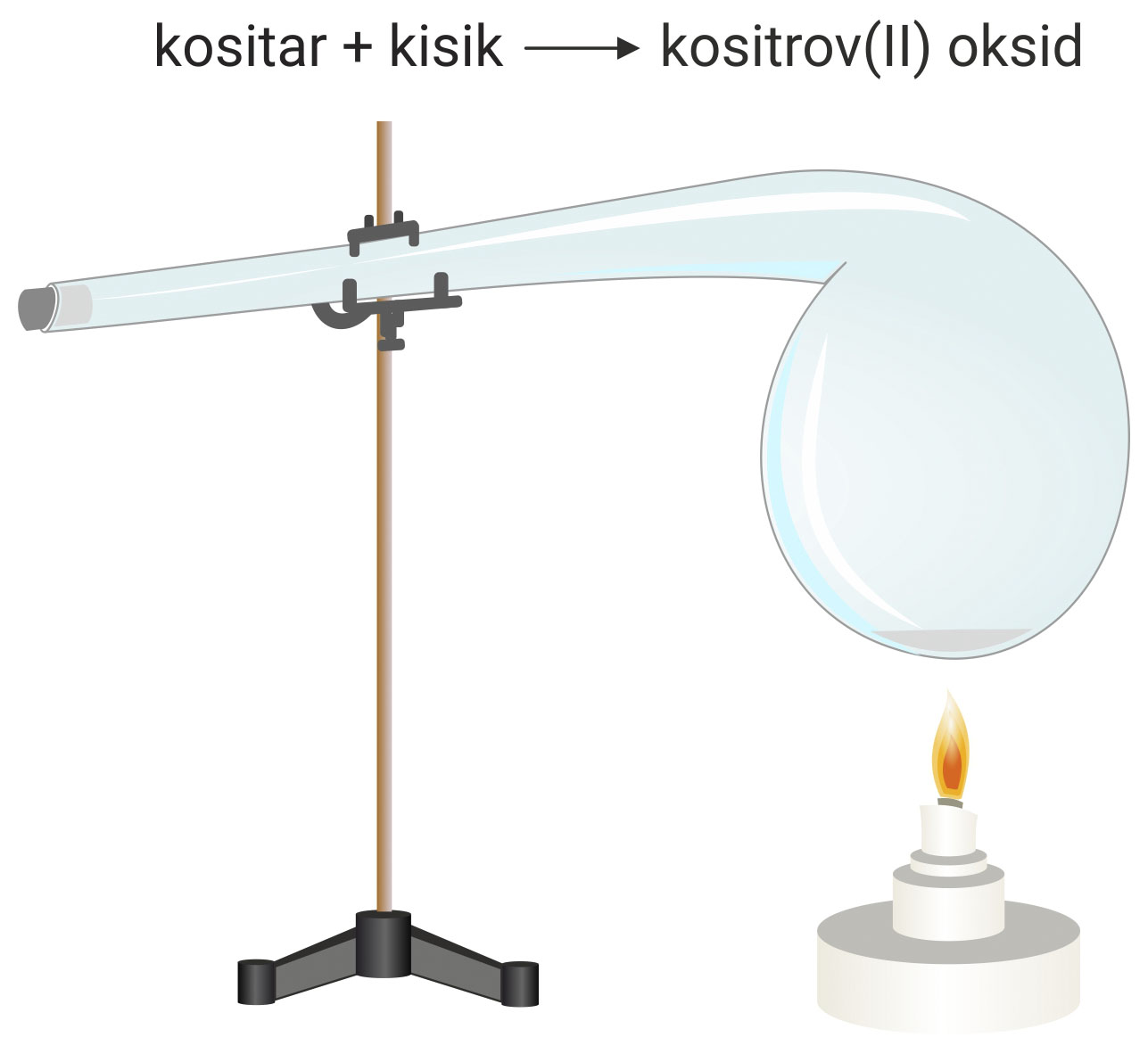
Od osobita je značenja Lavoisierov pokus oksidacije kositra. On je u tikvicu (retortu) stavio malo kositra, a potom je zatalio i izvagao.
Tikvicu s kositrom zagrijavao je dok sav kositar nije prešao u crni prah, kositrov(II) oksid (SnO). Kositar je reagirao s kisikom iz zraka u zataljenoj tikvici.
Retorta
Na izvoru 1 pročitajte više o retorti. Podijelite se u grupe te koristeći sliku retorte osmislite logo za podstranicu Kemije.
Prema kriterijima određenim od strane učitelja, odaberite najbolji uradak te ga u dogovoru s web administratorom postavite na mrežnu stranicu vaše škole.
Masa tvari tijekom reakcije nije se promijenila.
Kako to objašnjavamo?
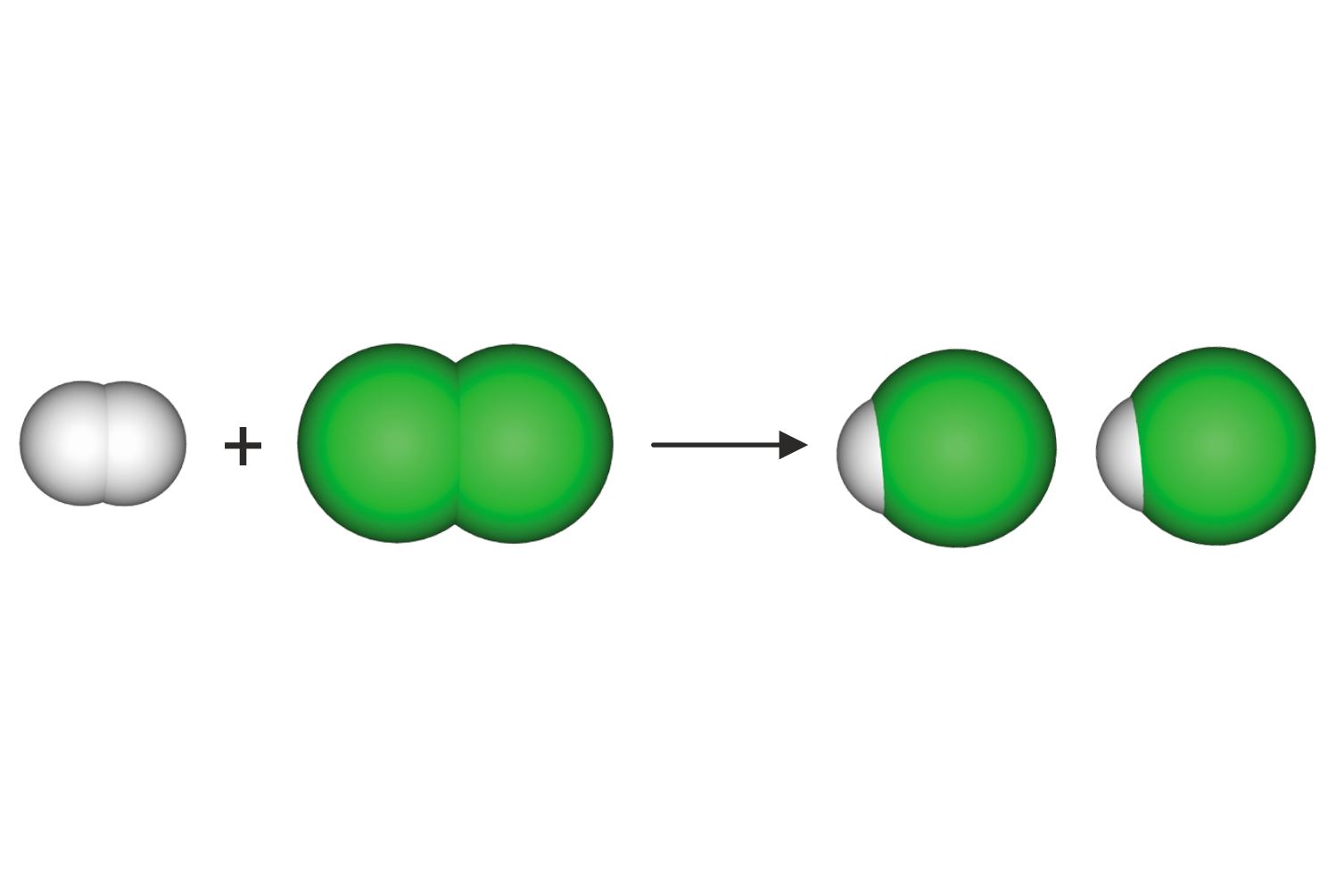
Za lakše objašnjenje možemo se vratiti
na dobro poznat primjer sinteze vode.
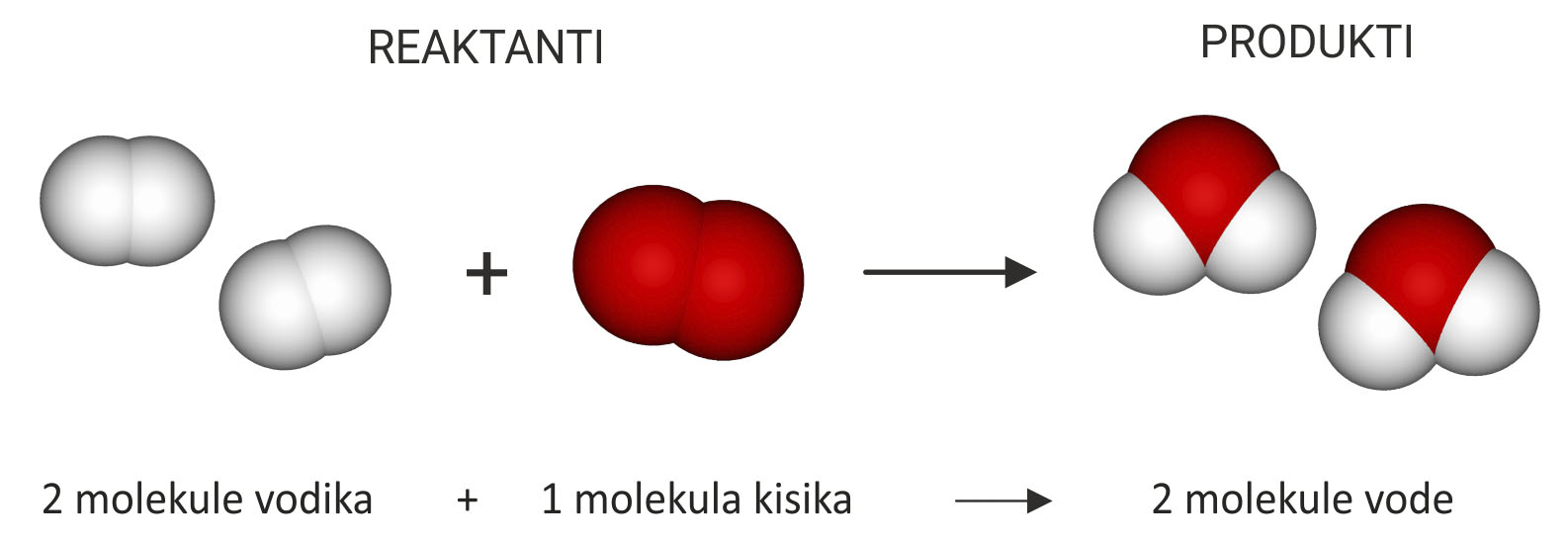
Voda nastaje reakcijom vodika i kisika.
Oba su plina građena od dvoatomnih molekula
i reaktanti su u ovoj kemijskoj reakciji.
Kao produkt nastaje voda.
Predočimo modelima
kemijsku reakciju sinteze vode.
Masa tvari tijekom reakcije nije se promijenila. Kako to objašnjavamo?
Za lakše objašnjenje možemo se vratiti na dobro poznat primjer sinteze vode. Voda nastaje reakcijom vodika i kisika. Oba su plina građena od dvoatomnih molekula i reaktanti su u ovoj kemijskoj reakciji, a kao produkt nastaje voda.
Predočimo modelima kemijsku reakciju sinteze vode.
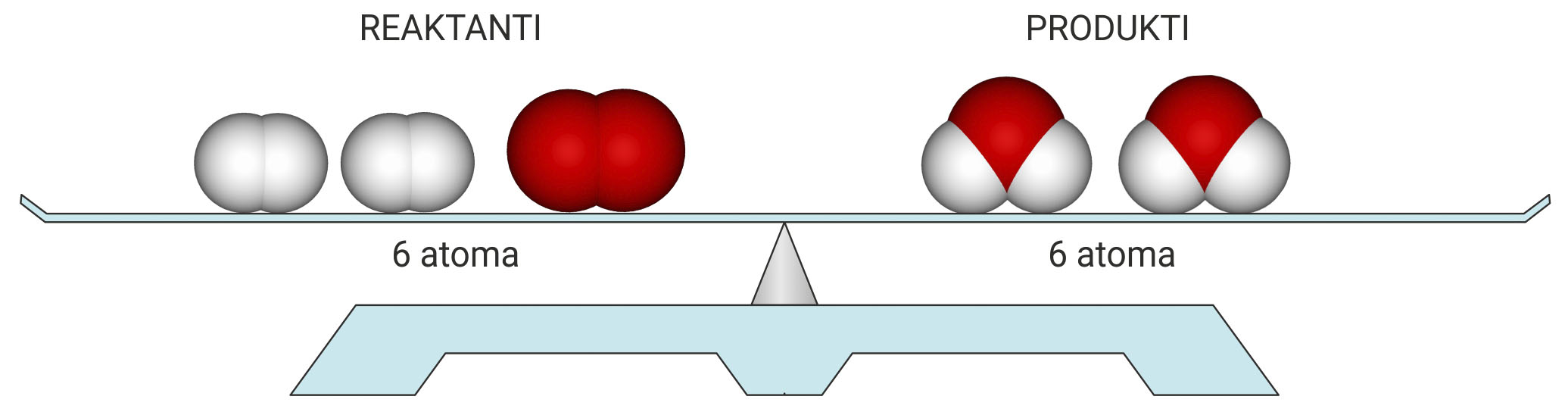
Prebrojimo li broj i vrstu atoma, vidimo da su u reakciju ušla četiri atoma vodika i dva atoma kisika, a isti su atomi, ali pregrupirani, izišli iz reakcije.
Tijekom kemijske reakcije masa ostaje nepromijenjena
jer se ne mijenjaju ni ukupni broj ni masa atoma.
Zakon o očuvanju mase može se primijeniti
pri računanju mase neke tvari
koja reagira ili nastaje nekom kemijskom reakcijom
ako su nam poznate mase ostalih tvari koje sudjeluju u toj reakciji.
Tijekom kemijske reakcije masa ostaje nepromijenjena jer se ne mijenjaju ni ukupni broj ni masa atoma.
Zakon o očuvanju mase može se primijeniti pri računanju mase neke tvari koja reagira ili nastaje nekom kemijskom reakcijom ako su nam poznate mase ostalih tvari koje sudjeluju u toj reakciji.
Antoine Laurent Lavoisier (1743. – 1794.), francuski kemičar,
otac suvremene kemije.
Bio je odličan eksperimentator:
uporabom vage uveo je egzaktne,
kvantitativne metode u kemijska istraživanja.
Utemeljio je načelo očuvanja tvari u kemijskim reakcijama.
Razvio je novu teoriju gorenja,
što je dovelo do odbacivanja flogistonske doktrine
koja je kemijom vladala više od jednoga stoljeća.
Njegova istraživanja oksidacije pokazala su ulogu kisika
u kemijskim procesima.
Kvantitativno je pokazao sličnost između oksidacije i disanja.
Dokazao je da je voda spoj kisika i vodika.
Objasnio je razliku između elemenata i spojeva .
Postavio osnove modernoga sustava kemijskoga nazivlja.
Tako je, oslobodivši se svih predrasuda,
proveo pravu revoluciju u kemiji
i učinio je egzaktnom znanošću.
Mihail Vasiljevič Lomonosov (1711. – 1795.), ruski znanstvenik i pjesnik,
utemeljitelj ruske kemije.
Osnovao je Moskovsko sveučilište koje nosi njegovo ime.
Njegova teorija slična je Boyleovoj.
Kaotično gibanje čestica je uzrok toplinskih pojava.
Uveo je ideju univerzalnoga zakona prirode,
tj. zakona o očuvanju mase i energije,
što čini temelj njegovih istraživanja.
Prvi je upotrijebio naziv fizikalna kemija.
Antoine Laurent Lavoisier (1743. – 1794.), francuski kemičar, otac suvremene kemije. Bio je odličan eksperimentator: uporabom vage uveo je egzaktne, kvantitativne metode u kemijska istraživanja i utemeljio načelo očuvanja tvari u kemijskim reakcijama. Razvio je novu teoriju gorenja, što je dovelo do odbacivanja flogistonske doktrine koja je kemijom vladala više od jednoga stoljeća. Njegova istraživanja oksidacije pokazala su ulogu kisika u kemijskim procesima, čime je kvantitativno pokazao sličnost između oksidacije i disanja. Dokazao je da je voda spoj kisika i vodika. Objasnio je razliku između elemenata i spojeva i postavio osnove modernoga sustava kemijskoga nazivlja. Tako je, oslobodivši se svih predrasuda, proveo pravu revoluciju u kemiji i učinio je egzaktnom znanošću.
Mihail Vasiljevič Lomonosov (1711. – 1795.), ruski znanstvenik i pjesnik, utemeljitelj ruske kemije, osnovao je Moskovsko sveučilište koje nosi njegovo ime. Njegova korpuskularna teorija slična je Boyleovoj, prema kojoj se najmanje čestice udružuju u složene čestice, a u osnovi je toplinskih pojava kaotično gibanje čestica. Uveo je ideju univerzalnoga zakona prirode, tj. zakona o očuvanju mase i energije, što čini temelj njegovih istraživanja. Prvi je upotrijebio naziv fizikalna kemija.
Primjena zakona o očuvanju mase
Rezultati mjerenja pokazali su da tijekom izgaranja 2,43 g magnezija nastaju 4,03 g magnezijeva oksida. Izračunajte masu kisika koji je reagirao sa zadanim uzorkom magnezija.

Zadano je:
Traži se:
Postupak:
Odgovor:
Masa utrošenog kisika pri gorenju zadanog uzorka magnezija iznosi 1,60 g.
Zakon stalnosti masenih omjera
Francuski kemičar Joseph Proust proučavao je kemijske spojeve. Tijekom svoga rada otkrio je da isti kemijski spoj pripremljen na različite načine uvijek sadržava iste masene udjele elemenata koji čine taj spoj.
Proust je definirao zakon stalnosti masenih omjera. On kaže da se dva ili više kemijskih elemenata uvijek međusobno spajaju u kemijski spoj u stalnom omjeru njihovih masa.
Otkrio je da su maseni omjeri vodika i kisika u vodi uvijek u
odnosu 1 : 8. Izračunajte koliko će ostati neizreagiranog kisika ako se za sintezu vode uzmu 4 g vodika i 34 g kisika.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izračunajte s pomoću kalkulatora masu magnezijeva oksida koji je nastao spajanjem 4,86 grama magnezija i 3,2 grama kisika.
Zadano je:
m (magnezij) = 4,86 g
m (kisik) = 3,2 g
Traži se:
m (magnezijev oksid) = ?
Postupak:
m (magnezij) + m (kisik) = m (magnezijev oksid)
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Elektrolizom 50 g vode dobiju se kisik i 5,6 g vodika. Izračunajte masu dobivena kisika.
Zadano je:
m (voda) = 50g
m (vodik) = 5,6 g
Traži se:
m (kisik) = ?
Postupak:
m (kisik) + m (vodik) = m (voda)
m (kisik) = m (voda) – m (vodik)
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izračunajte masu klora koji se spaja s 1,16 g vodika te nastaje 42 g klorovodika.
Zadano je:
m (vodik) = 1,16 g
m (klorovodik) = 42 g
Traži se:
m (klor) = ?
Postupak:
m (klor) + m (vodik) = m (klorovodik)
m (klor) = m (klorovodik) – m (vodik)
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za reakciju kemijske analize:
izračunajte masu kisika ako je masa vodikova peroksida 3,4 grama, a masa vode 1,8 grama.
Zadano je:
m (vodikov peroksid) = 3,4 g
m (voda) = 1,8 g
Traži se:
m (kisik)= ?
Postupak:
m (vodikov peroksid) = m (voda) + m (kisik)
m (kisik) = m (vodikov peroksid) – m (voda)
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izračunajte masu magnezijeva oksida koji je nastao spajanjem 4,86 grama magnezija i 3,2 grama kisika.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Elektrolizom 50 g vode dobiju se kisik i 5,6 g vodika. Izračunajte masu dobivena kisika.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izračunajte masu klora koji se spaja s 1,16 g vodika te nastaje 42 g klorovodika.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za reakciju kemijske analize:
vodikov peroksid → voda + kisik
izračunajte masu nastalog kisika ako je masa vodikova peroksida 3,4 grama, a masa vode 1,8 grama.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Jednadžba kemijskih reakcija
Kemijske reakcije mogu se opisivati riječima
ili prikazivati modelima čestica koje sudjeluju u nekoj reakciji.
Međutim, takvo prikazivanje kemijskih reakcija nije potpuno
jer nam ne govori o sastavu i masi reaktanata i produkata.
Stanje prije i poslije kemijske reakcije može se točno
i potpuno prikazati kemijskim simbolima i formulama.
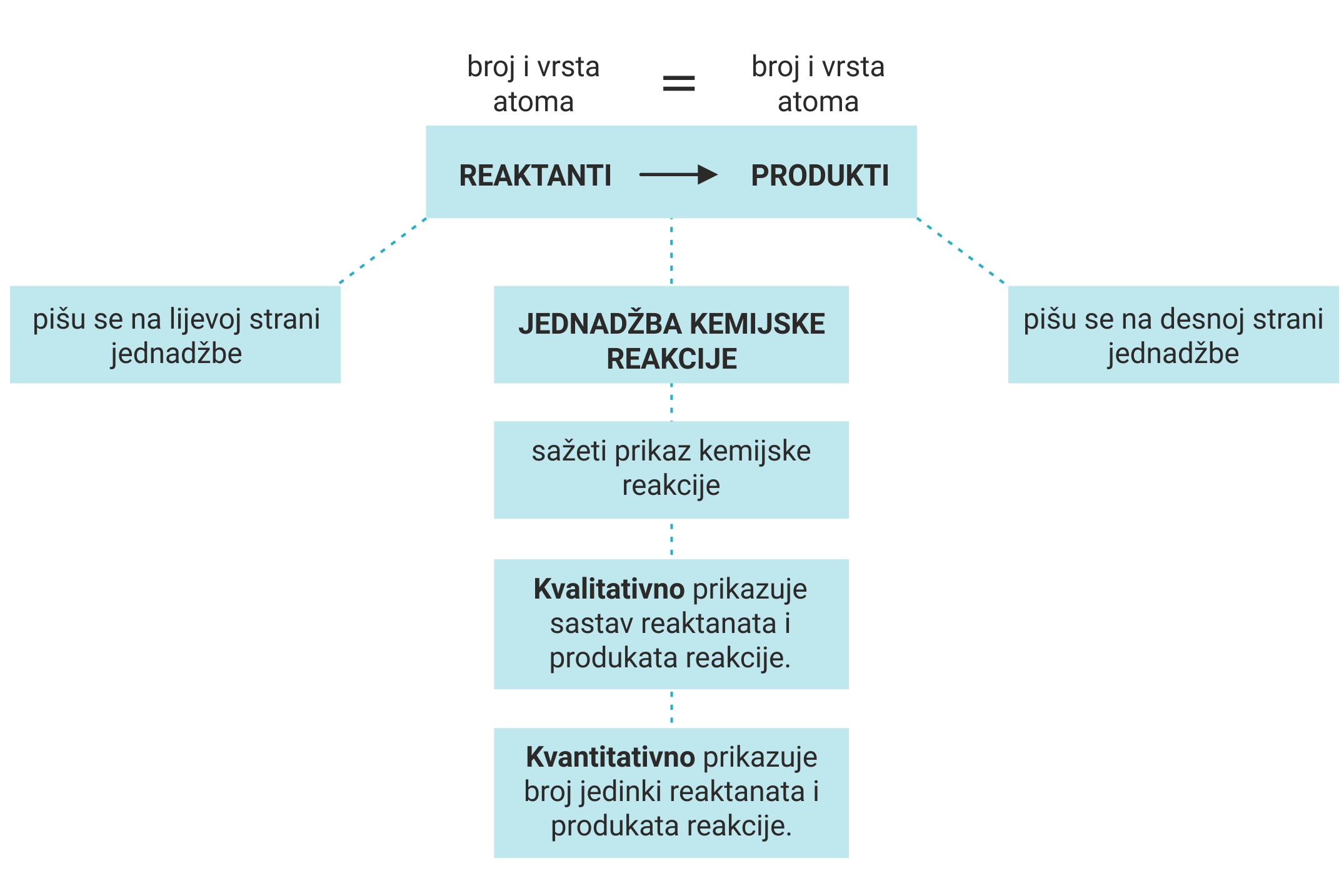
Tako zapisana kemijska reakcija naziva se kemijska jednadžba.
Svaka kemijska jednadžba mora biti napisana u skladu sa
zakonom o očuvanju mase, odnosno izjednačena.
Kemijska jednadžba jest sažet prikaz kemijske reakcije.
Pri pisanju jednadžbi kemijskih reakcija
koristimo se sljedećim pravilima:
– Imenujte reaktante i produkte u kemijskoj reakciji.
– Prikažite ih kemijskim oznakam (simbolima i kemijskim formulama).
– Kemijski simboli i formule moraju biti pravilno napisani.
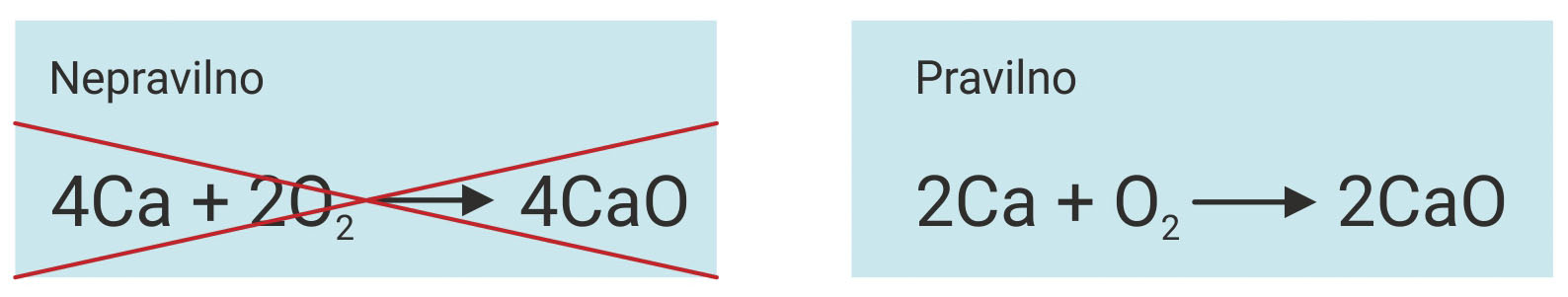
– Broj istovrsnih atoma u reaktantima (lijevo) mora biti jednak
broju tih atoma u produktima (desno).
– Jednadžbu reakcije izjednačujemo dodavanjem koeficijenata
ispred simbola ili formula reaktanata i produkata.
– Broj atoma na lijevoj strani jednadžbe mora biti jednak
broju atoma na desnoj strani jednadžbe.
– Indeksi u formulama moraju ostati isti
(ne smiju se brisati ili dodavati).
Jednadžba kemijskih reakcija
Kemijske reakcije mogu se opisivati riječima ili prikazivati modelima čestica koje sudjeluju u nekoj reakciji. Međutim, takvo prikazivanje kemijskih reakcija nije potpuno jer nam ne govori o sastavu i masi reaktanata i produkata.
Stanje prije i poslije kemijske reakcije može se točno i potpuno prikazati uporabom kemijskih simbola i formula. Tako zapisana kemijska reakcija naziva se kemijska jednadžba. Svaka kemijska jednadžba mora biti napisana u skladu sa zakonom o očuvanju mase, odnosno izjednačena. Kemijska jednadžba jest sažet prikaz kemijske reakcije.
Pri pisanju jednadžbi kemijskih reakcija koristimo se sljedećim pravilima:
- Imenujte reaktante i produkte u kemijskoj reakciji i prikažite ih kemijskim oznakama (simbolima i kemijskim formulama).
- Kemijski simboli i formule moraju biti pravilno napisani.
- Broj istovrsnih atoma u reaktantima (lijevo) mora biti jednak broju tih atoma u produktima (desno).
- Jednadžbu reakcije izjednačujemo dodavanjem koeficijenata ispred simbola ili formula reaktanata i produkata da bi broj atoma na lijevoj strani jednadžbe bio jednak broju atoma na desnoj strani jednadžbe.
- Indeksi u formulama moraju ostati isti (ne smiju se brisati ili dodavati).
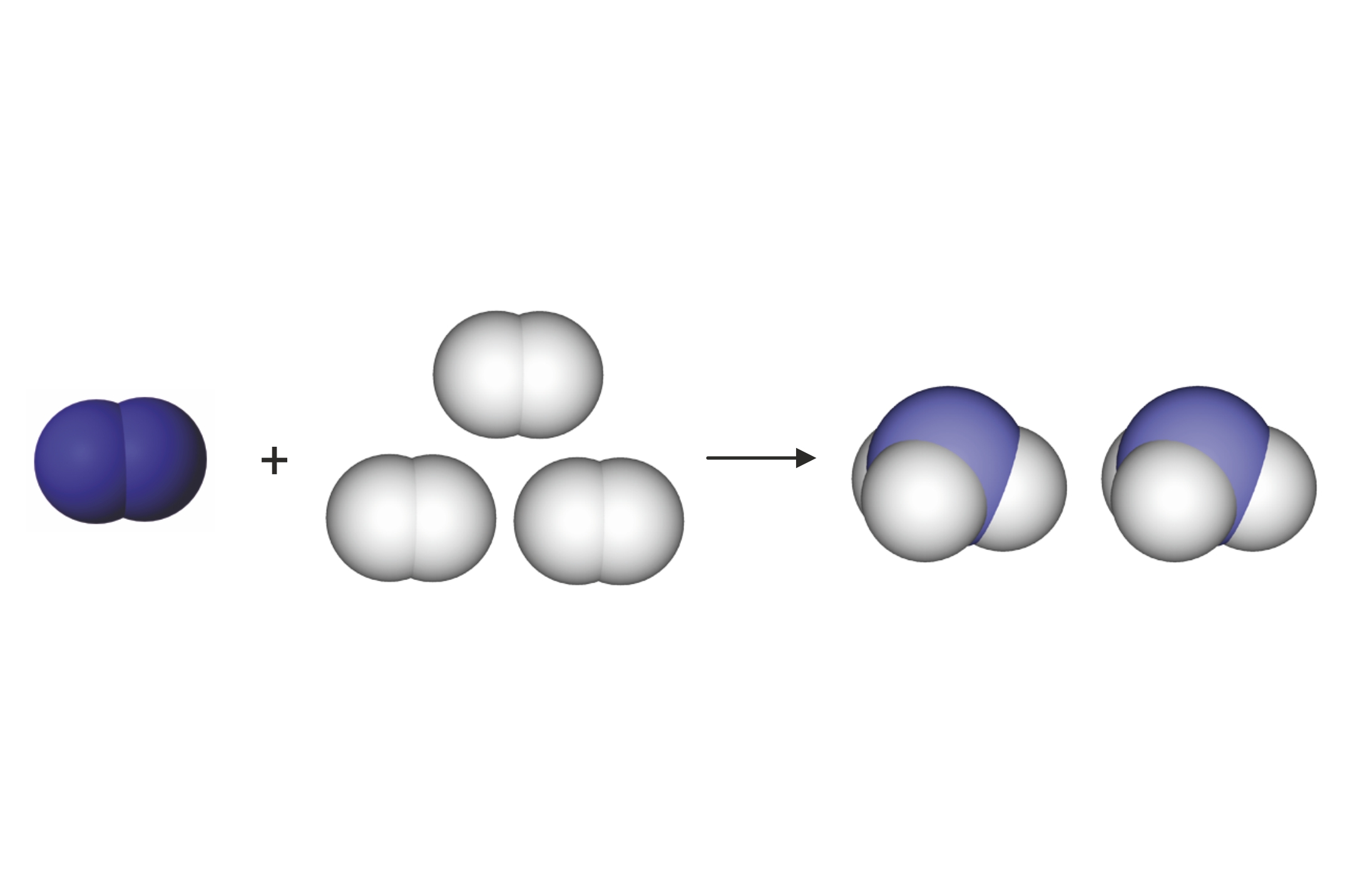
Primjeri primjene pravila pisanja jednadžbi kemijskih reakcija
Jednadžba kemijske reakcije pokazuje samo vrstu i najmanji višekratnik broja pojedinih atoma koji sudjeluju u njoj.
Dobivanje vodika u Kippovu aparatu
Vodik se u laboratoriju najčešće dobiva u Kippovu aparatu djelovanjem razrijeđene klorovodične kiseline na granule cinka. Pritom nastaju mjehurići plina koji se skuplja u posudama s otvorom okrenutim prema dolje jer je gustoća vodika manja od gustoće zraka. U aparatu zaostaje otopljeni cinkov klorid.
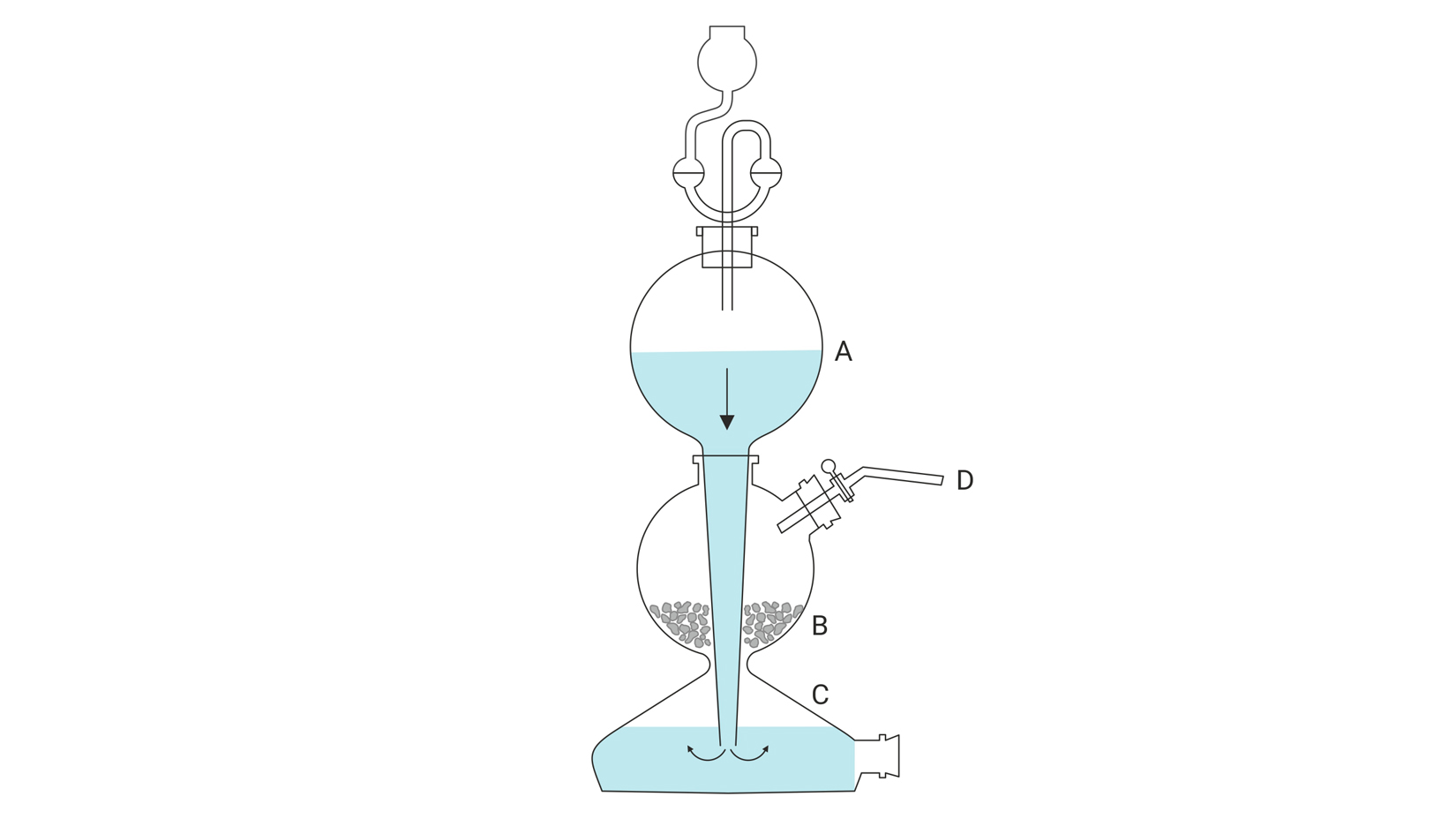
Kippov aparat
Napišite jednadžbu opisane kemijske reakcije služeći se alatom Pisanje kemijskih jednadžbi na webu i navedite agregacijska stanja reaktanata i produkata.
Na izvoru proučite kratak opis Kippova aparata. Na temelju toga opisa oznakama A, B, C i D na slici, pronađite odgovarajuće značenje.
Postupak:
1. Imenujte reaktante i produkte u ovoj kemijskoj reakciji i odredite im agregacijsko stanje.
Reaktanti:
klorovodična kiselina (otopina) –
metal cink (čvrsta tvar) –
Produkti:
sol cinkov klorid (otopljen) –
nemetal vodik (plin) –
2. Opis reakcije nazivima reaktanata i produkata
3. Prikaz jedinki reaktanata i produkata znakovima
4. Izjednačavanje broja istovrsnih atoma u jedinkama reaktanata i produkata
a) izjednačavanje broja atoma vodika:
b) izjednačavanje broja atoma klora:
Zn(s) + 2HCl(aq) → H2(g) + ZnCl2(aq)
c) izjednačavanje broja atoma cinka:
Zn(s) + HCl(aq) → H2(g) + ZnCl2(aq)
5. Jednadžba kemijske reakcije i provjera broja istovrsnih atoma na lijevoj i desnoj strani kemijske jednadžbe
Značenje jednadžbe kemijskih reakcija
Jednadžbe kemijskih reakcija su,
poput simbola i kemijskih formula,
međunarodno dogovoreni izrazi.
Jednadžbama iskazujemo kemijske reakcije,
zato one u svim zemljama i na svim jezicima imaju isto značenje.
Ispravno napisana kemijska jednadžba kvalitativno opisuje sastav reaktanata i produkata.
Kvantitativno opisuje broj jedinki reaktanata i produkata
koji sudjeluju u reakciji s najmanjim mogućim brojem jedinki.
Značenje jednadžbe kemijskih reakcija
Jednadžbe kemijskih reakcija, poput simbola i kemijskih formula, međunarodno su dogovoreni izrazi kojima iskazujemo kemijske reakcije.Stoga one u svim zemljama i na svim jezicima imaju isto značenje. Ispravno napisana kemijska jednadžba kvalitativno opisuje sastav reaktanata i produkata.
Kvantitativno opisuje broj jedinki reaktanata i produkata koji sudjeluju u reakciji s najmanjim mogućim brojem jedinki.
| kemijska jednadžba | kvalitativno značenje | kvantitativno značenje |
|---|---|---|
| reakcijom natrija i klora nastaje natrijev klorid | reakcijom dvaju atoma natrija i jedne molekule klora nastaju dvije formulske jedinke natrijeva klorida | |
| reakcijom vodika i kisika nastaje voda | reakcijom dviju molekula vodika i jedne molekule kisika nastaju dvije molekule vode | |
| reakcijom fosfora i kisika nastaje fosforov(V) oksid | reakcijom jedne molekule fosfora i pet molekula kisika nastaje jedna molekula fosforova(V) oksida | |
| raspadom živina(II) oksida dobiju se živa i kisik | raspadom dviju formulskih jedinki živina(II) oksida nastaju dva atoma žive i jedna molekula kisika |
Na kraju…
Proučite shematski prikaz i odgovorite na sljedeća pitanja!
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Označite slovo ispred jednoga točnog odgovora.
Provjerite je li broj atoma elementa na lijevoj i desnoj strani jednadžbe jednak.
Koja je jednadžba kemijske reakcije pravilno napisana?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja je jednadžba kemijske reakcije pravilno napisana?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Na temelju navedenoga kvantitativnog značenja izjednačite zadanu kemijsku jednadžbu tako da označite odgovor koji nudi točan redoslijed zapisa stehiometrijskih koeficijenata.
Napomena: Stehiometrijski koeficijenti navedeni su na način koji prati čitanje jednadžbe kemijske reakcije – s lijeva (reaktanati) na desno (produkti).
Jedna molekula metana reagira s dvjema molekulama kisika pri čemu nastaju jedna molekula ugljikova(IV) oksida i dvije molekule vode.
Stehiometrijski koeficijenti u jednadžbi kemijske reakcije su:
_CH4 + _O2 → _CO2 + _H2O
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izjednačite jednadžbu kemijske sinteze aluminijeva oksida tako da označite odgovor koji nudi točan redoslijed zapisa stehiometrijskih koeficijenata.
Napomena: Stehiometrijski koeficijenti navedeni su na način koji prati čitanje jednadžbe kemijske reakcije – s lijeva (reaktanati) na desno (produkti).
Stehiometrijski koeficijenti u jednadžbi kemijske reakcije su:
_Al + _O2 → _Al2O3
Želite li pokušati ponovo?