Stehiometrija kemijskih reakcija
- odrediti vrijednosti stehiometrijskih koeficijenata reaktanata i produkata u kemijskoj jednadžbi
- iz jednadžbe kemijske reakcije uočiti da je odnos množina jednak odnosu stehiometrijskih brojeva u jednadžbi
- objasniti odnos mjerodavnog reaktanta i reaktanta u suvišku
- objasniti pojam dosega kemijske reakcije
Uvod
koje sudjeluju u kemijskoj reakciji.
Napredovanjem kemijske reakcije smanjuju se
množine reaktanata, a povećavaju množine produkata.
Navedene množine odnose se kao
omjeri broja jedinki reaktanata i produkata u jediničnoj reakcijskoj pretvorbi.
Uvod
Riješeni primjer 1
Izračunajte volumen kisika koji nastaje termičkim razlaganjem 7,50 g kalijeva klorata pri normalnim uvjetima. Termičkim razlaganjem kalijeva klorata osim kisika nastaje i kalijev klorid.
Zadano je:
Traži se:
Postupak:
Korak 1
Jednadžba kemijske reakcije termičkog razlaganja kalijeva klorata:
Iz jednadžbe kemijske reakcije može se odrediti omjer množine kisika koji u reakciji nastaje i množine kalijeva klorata koji se u reakciji utrošio:
Iz dobivenoga omjera može se izračunati množina kisika razvijenog u reakciji:
Korak 2
Volumen kisika pri normalnim uvjetima je:
Odgovor:
Volumen kisika pri normalnim uvjetima koji nastaje termičkim razlaganjem kalijeva klorata je .
Izračunajte volumen vodika koji se može razviti pri normalnim uvjetima u reakciji granula cinka mase 4,30 g s razrijeđenom klorovodičnom kiselinom u suvišku.
Napišite jednadžbu kemijske reakcije služeći se alatom Pisanje kemijskih jednadžbi na webu.
Rješenje:
1,47 dm3
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Zagrijavanjem 28,12 g hidratne soli nastaje 13,72 g anhidrida .
a) Izračunajte broj molekula vode u uzorku hidratne soli.
b) Odredite formulu hidratne soli na temelju omjera množina i .
Rješenje:
: = 0,114 mol : 0,799 mol
: = 1:7
Formula hidratne soli je .
Mjerodavni ili limitirajući reaktant
Riješeni primjer 2.
Izračunajte masu natrijeva klorida koja teorijski može nastati reakcijom 1,95 g natrija i 3,30 g klora.
Jednadžba kemijske reakcije je:
Zadano je:
Traži se:
Izradak
Korak 1
Za određivanje mjerodavnog (limitirajućeg) reaktanta u reakciji potrebno je izračunati množine reaktanata u reakciji.
Korak 2
Doseg reakcije, (grč. ksi), odnosno množina jediničnih pretvorbi, definira se kao omjer promjene množine nekoga sudionika u reakciji i njegova stehiometrijskog koeficijenta:
gdje je stehiomerijski koeficijent ispred reaktanta ili produkta A.
Prema tomu, dobivene množine reaktanata podijele se s apsolutnim vrijednostima njihovih stehiometrijskih koeficijenata. Na taj se način izračuna doseg reakcije.
Budući da tvari reagiraju u stalnim omjerima, doseg reakcije ne može biti veći od onoga koji proizlazi iz množine reaktanta kojeg ima najmanje.
Reaktant koji određuje koliko reakcija najdalje može ići zove se mjerodavni ili limitirajući reaktant.
Stoga je mjerodavni reaktant natrij jer je njegov doseg u ovoj reakciji manji od dosega za klor.
Korak 3
Množina natrijeva klorida koji u reakciji nastaje kao produkt stavi se u omjer s množinom mjerodavnog reaktanta, natrija.
Odgovor:
Masa natrijeva klorida nastala reakcijom 1,95 g natrija i 3,30 g klora iznosi 4,96 g.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Proučite shematski prikaz i odgovorite na sljedeća pitanja.
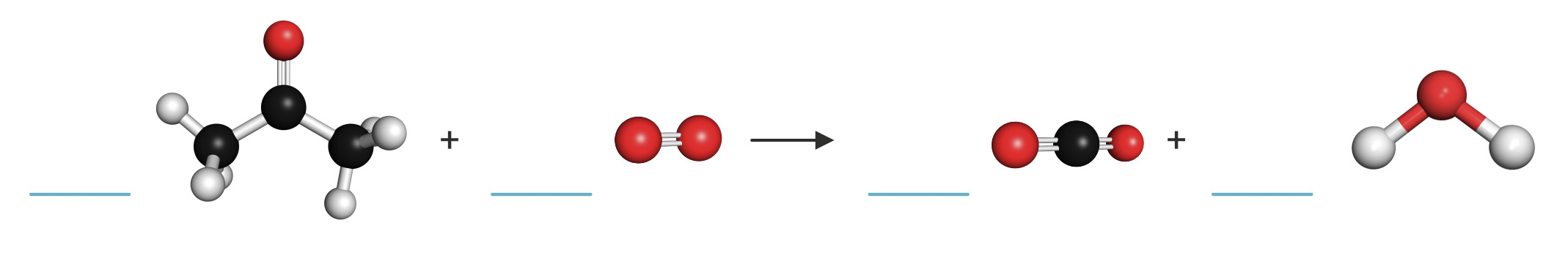
a) Napišite i izjednačite jednadžbu kemijske reakcije služeći se alatom Pisanje kemijskih jednadžbi na webu.
b) Volumen kisika pri normalnim uvjetima potreban za potpuno izgaranje (oksidaciju) 25,00 g acetona je:
Želite li pokušati ponovo?
Želite li pokušati ponovo?
Pozorno pogledajte videozapis i odgovorite na pitanja koja slijede.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Riješeni primjer 3.
Reakcijom smjese kalcijeva karbonata, , i pijeska, , s klorovodičnom kiselinom oslobađa se ugljikov(IV) oksid, . Izračunajte maseni udio kalcijeva karbonata u smjesi ako je masa smjese 4,0 g, a masa nastalog ugljikova(IV) oksida 0,88 g.
Zadano je:
Traži se:
Izradak:
Jednadžbe kemijske reakcije
nema reakcije
Odgovor: Maseni udio kalcijeva karbonata u smjesi je 50 %.
Iskorištenje reakcije
Tijekom kemijskih reakcija osim predviđenih produkata mogu nastati i neželjeni produkti u reakciji, a moguće je i da reaktanti ne izreagiraju u potpunosti.
Zbog toga se računa iskorištenje reakcije, ,
kao omjer eksperimentalno dobivene mase produkta i teorijske mase produkta.
Teorijska masa produkta računa se prema jednadžbi kemijske reakcije.
Pri tome se u obzir uzima mjerodavni reaktant jer on određuje doseg reakcije.
Iskorištenje se iskazuje postotkom.
Iskorištenje reakcije označava se grčkim slovom eta, .
= masa dobivenog produkta / teorijska masa produkta
Iskorištenje reakcije
Tijekom kemijskih reakcija osim predviđenih produkata mogu nastati i neželjeni produkti, a moguće je i da reaktanti ne izreagiraju do kraja.
Zbog toga se računa iskorištenje reakcije, , kao omjer eksperimentalno dobivene mase produkta i teorijske mase produkta.
Teorijska masa produkta računa se prema jednadžbi kemijske reakcije uzevši u obzir mjerodavni reaktant jer on određuje doseg reakcije.
Iskorištenje reakcije je omjer mase dobivenog produkta u reakciji i teorijske mase produkta. Iskorištenje reakcije označava se grčkim slovom eta, . Iskorištenje se iskazuje postotkom.
Riješeni primjer 4
Sintezom 10,00 g željeza i 10,00 g klora nastaje 11,35 g željezova(III) klorida. Izračunajte iskorištenje reakcije.

Zadano je:
Traži se:
Iskorištenje kemijske reakcije,
Izradak
Korak 1
Teorijska masa željezova(III) klorida računa se prema napisanoj jednadžbi kemijske reakcije.
1. Napisati jednadžbu kemijske reakcije:
2. Izračunati množine svih reaktanata.
Korak 2
Doseg reakcije, , je množina jediničnih pretvorbi, a definira se kao omjer promjene množine nekog sudionika u reakciji i njegovog stehiometrijskog koeficijenta:
3. Za svaki od reaktanata izračunati mogući doseg.
4. Najmanji doseg je ujedno i maksimalni mogući doseg reakcije i pripada mjerodavnom reaktantu.
Prema vrijednostima dosega reakcije može se zaključiti da je mjerodavni reaktant u reakciji klor.
Korak 3
5. Izračunati teorijsku masu produkta.
Odgovor:
Izračunana teorijska masa željezova(III) klorida prema jednadžbi kemijske reakcije iznosi 15,25 g.
Korak 4
Iskorištenje reakcije, , predstavlja omjer mase dobivenog produkta (može se vagati) i teorijske mase produkta (koja se može izračunati na temelju jednadžbe kemijske reakcije):
= masa dobivenog produkta / teorijska masa produkta
Odgovor:
Iskorištenje reakcije je prema tomu 74,43 %.
Na kraju…
Riješite interaktivni kviz!
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.

Današnja oprema automobila nezamisliva je bez zračnoga jastuka.
Za napuhavanje jastuka upotrebljavaju se natrijev azid (),
kalijev nitrat () i silicijev dioksid ().
Pri sudaru automobila dolazi do brzoga punjenja zračnog jastuka plinovitim dušikom koji nastaje raspadom natrijeva azida, .
Jednadžba kemijske reakcije:
Za izradu zračnog jastuka upotrebljava se trevira (poliester), materijal čija su vlakna čvršća od čeličnih i oko šest puta lakša.
Masa natrijeva azida potrebna za nastanak 15,0 litara dušika pri 22,0 °C i tlaku od 1024,7 hPa je:
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?

